热解温度对土霉素菌渣焦炭化学性质的影响
洪 晨,王志强,邢 奕,3*,杨 强,司艳晓,李益飞,冯丽慧,贾蒙蒙(.北京科技大学能源与环境工程学院,北京 00083;2.中国科学院生态环境研究中心,北京 00085;3.北京科技大学工业典型污染物资源化处理北京市重点实验室,北京 00083;.清华大学环境学院,北京 0008)
热解温度对土霉素菌渣焦炭化学性质的影响
洪 晨1,2,王志强1,邢 奕1,3*,杨 强1,司艳晓4,李益飞1,冯丽慧1,贾蒙蒙1(1.北京科技大学能源与环境工程学院,北京 100083;2.中国科学院生态环境研究中心,北京 100085;3.北京科技大学工业典型污染物资源化处理北京市重点实验室,北京 100083;4.清华大学环境学院,北京 100084)
研究了热解温度对土霉素菌渣化学性质的影响.采用电子自旋共振(ESR)波谱、X射线光电子能谱(XPS)和碳-13核磁共振(13C NMR)波谱分析了土霉素菌渣及热解焦碳中自由基、碳官能团的变化.结果表明,土霉素菌渣中含有大量自由基,自由基浓度随热解温度的升高显著变化.热解温度为320℃时,焦碳中自由基浓度最高,为1.239×1019spins/g.热解过程中,随着挥发分分解析出、缩聚反应加剧,土霉素菌渣及其热解焦碳中的自由基由含氧自由基、烃基自由基、含氮自由基向芳香碳自由基转化.土霉素菌渣的碳结构在热解中发生明显改变,甲氧基CH3—O—、脂肪族C—C键、脂肪族C—O键以及羰基(C=O)基团断键,产生大量的芳香族C—C键、芳香族C—O键.热解温度为600℃时,焦碳中芳香族碳官能团(芳香族C—H、C—C、C—O键)的比例达到94.14%.
土霉素菌渣;热解;焦碳;自由基;碳官能团
中国是抗生素的主要生产国之一,全球 80%的头孢菌素类抗生素、75%的青霉素工业盐及90%的链霉素类抗生素均产自中国.抗生素菌渣是抗生素发酵工艺产生的有机废物,由菌丝体、剩余培养基成分、中间代谢产物及少量的残留抗生素等[1]组成,包含大量蛋白质、脂肪、多糖等物质[2-3].菌渣中的抗生素残留,易在生物体中累积造成耐药性[4-5].因此,抗生素菌渣于2008年被列入《国家危险废物名录》(HW 02).热解和焚烧是抗生素菌渣处理和资源化的有效途径.工业化实验结果表明抗生素菌渣加入不会明显影响焚烧系统性能及污染物排放[6].同时,抗生素菌渣-煤混合热解/燃烧行为的研究表明,抗生素菌渣和煤在高温条件下可能发生协同反应[7-8].
生物质或化石燃料热解过程中发生自由基反应,加热使共价键容易发生均裂,促进自由基形成和耦合.自由基的存在时间差别非常大,一些自由基的寿命短至纳秒级,很难被检测到[9-10].因此,能够被检测到的一般都是由于位阻流动性差或难以接近的长寿命自由基(稳定自由基)[11-12].采用电子顺磁共振波谱研究煤的热解中自由基变化的研究发现焦碳中稳定自由基浓度随温度升高而显著升高[13].同时,热解后焦碳中自由基浓度明显多于热解焦油,并且自由基 g值、线宽等参数受温度影响较大[14].自由基特性变化意味着样品的化学结构在热解中发生了改变[15-17].
共价键断键和自由基耦合等分子内变化在热解产物形成方面扮演着关键的角色[18].热解后,生物质或化石燃料中碳氢化合物结构逐渐消失,转变为高含碳的芳香结构[15].如细茎针茅热解过程中,随着升温速率增高,热解油中 H/C比例升高、O/C比例降低[19];木质素热解后,甲氧基团、脂肪族 C—C键、羰基基团断键,产生更多的多环芳烃和脂肪族C—O键[20];氨基葡萄糖、壳聚糖单体热解后能够转换为含氮化合物,如脱氧果糖嗪、果糖胺等[21].
尽管化石燃料和生物质热解方面的研究已较多,但是抗生素菌渣热解化学特性,特别是自由基、官能团的研究仍较少.本文采用电子自旋共振(ESR)、X射线光电子能谱(XPS)和碳-13核磁共振(13C NMR)方法,研究热解工艺对土霉素菌渣及其焦碳中自由基、碳官能团的影响,以阐明自由基特性、化学结构与热解温度的关系.
1 材料与方法
1.1 抗生素菌渣样品
实验所用抗生素菌渣产自土霉素发酵工艺.土霉素菌渣在 105℃下烘干至恒重,磨碎成细颗粒.菌渣的平均粒径为 46.68μm,粒径分布如图 1所示,工业分析、元素分析如表1所示.

图1 土霉素菌渣粒径分布Fig.1 particle size distribution of terramycin ferment residue
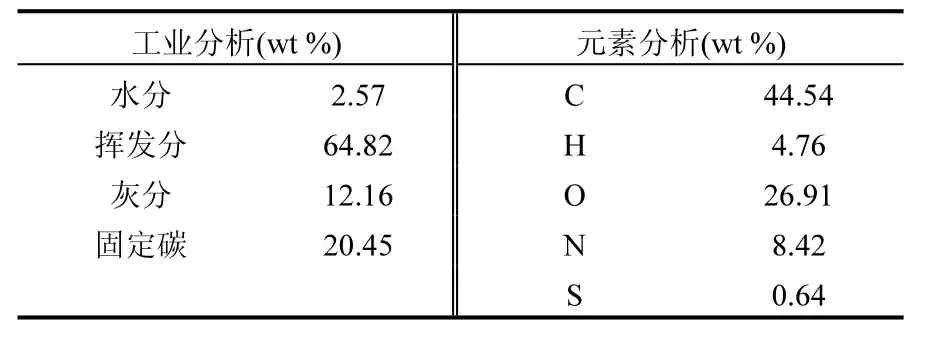
表1 土霉素菌渣工业分析和元素分析Table 1 proximate analysis and elemental analysis of terramycin ferment residue
1.2 抗生素菌渣热解实验
采用管式炉热解反应器热解土霉素菌渣,热解气氛为高纯度 N2(99.999%).将土霉素菌渣样品(约 5g)置于管式炉反应器中,载气流速为2L/min,以 10 /min℃ 的升温速率从常温(25 )℃分别加热至 160,320,480,600℃并保持 30min,然后以 5 /min℃ 的速率降温至常温,制得实验所用土霉素菌渣热解焦碳样品.
1.3 电子自旋共振(ESR)
采用JES-FA 200 (JEOL, Japan)电子自旋共振(ESR)波谱仪测量土霉素菌渣及热解焦碳中自由基特性.调制频率 100Hz,微波频率9069.418MHz,微波功率 0.0997mW,中心磁场324.254mT,扫描宽度 10mT,扫描时间 1.0min,时间常量0.1s.实验温度为25 ,℃实验结果与1,1-二苯基-2-三硝基苯肼(DPPH)标样对比得到自由基浓度[22],g值、线宽(ΔH)通过CW-ESR软件分析得出.
1.4 X射线光电子能谱 (XPS)
采用 XPS能谱仪(AXIS ULTRADLDsystem, Kratos, Japan)分析土霉素菌渣样品的C1s谱.试验操作参数如下:X射线源为单色化Al靶, Al Kα hυ=1486.6eV;X射线工作功率为150W;透过能为 20eV;样品分析区域为 800×800μm;扫描步长为0.05eV,用 C1s(284.6,eV)作内标进行校正.采用Peakfit软件对13C NMR图谱进行分峰拟合处理.
1.5 碳-13核磁共振 (13C NMR)
采用固态13C NMR(Bruker advance 400MHz, Germany)土霉素菌渣样品及其热解焦碳,表征碳结构特性及官能团.共振频率100.63MHz,交叉极化接触时间1ms,循环延迟4s,自旋速率5KHz.为了详细分析热解作用对土霉素菌渣中多种碳官能团的影响,采用Peakfit软件对13C NMR图谱进行分峰拟合,通过计算拟合谱线峰面积分析不同碳官能团所占比例.
2 结果与讨论
2.1 热解温度对土霉素菌渣自由基特性的影响
2.1.1 ESR图谱及自由基浓度变化 土霉素菌渣在热化学转换过程中会发生化学键断裂,进而导致自由基产生.热解过程中土霉素菌渣/焦碳的电子自旋共振波谱如图2所示.可以看出,所有 ESR谱线的基本形状相同,均为无超精细结构的对称曲线.热解前后,ESR谱线的峰强、位置、谱线宽度均发生明显变化.这表明热解温度对土霉素菌渣中自由基的组成、分布和特性有明显影响.
土霉素菌渣的自由基浓度随热解温度的升高而发生显著的变化(图3).热解温度由25℃升至160 ,℃自由基浓度仅有小幅上升.在160℃条件下,土霉素菌渣中有机物的分解反应刚刚开始,仅有轻度的共价键断键反应发生,因此只有少量的自由基形成.热解温度继续升高至320 ,℃自由基浓度迅速上升,达到1.239×1019spins/g.在这一热解温度下,土霉素菌渣中大量的有机物发生分解,有机物分子中的弱键如烷基侧链、羟基、醚基等在热分解作用下易于断裂,分解产生H2O、CO2、烃类等气体,同时产生大量新的自由基[15].新的自由基能够自身缩合或与周围环境中的稳定组分结合,进而形成稳定自由基,最终导致焦碳中自由基含量升高[13].480℃时,土霉素菌渣中的自由基浓度大幅降低.这是由于温度升高能够提高土霉素菌渣的碳化程度,并产生大量芳香族化合物.在芳香族化合物形成过程中,自由基之间发生结合,导致大量自由基消失.当热解温度达到600℃时,聚合和缩合反应加剧,焦碳中结构芳香族化组分缩聚成分子量更大的多环芳香族化合物,自由基进一步结合,自由基浓度降低.
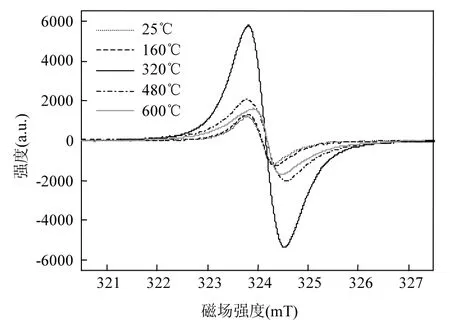
图2 电子自旋共振波谱(25~600℃)Fig.2 Electron spin resonance spectrum
2.1.2 热解温度对土霉素菌渣 g值的影响 g值取决于未成对电子所处的化学环境,能够反映顺磁中心分子中电子自旋运动和轨道运动之间的相互作用,是表征分子内部结构的重要参数.根据 g值的不同,自由基可分为含氧自由基(σ型, 2.0008~2.0014)、石墨基(2.0015~2.0025)、脂肪族烃基自由基(π型,2.0025~2.0026)、芳香族烃基自由基(π型,2.0025~2.00291)、含氧自由基(π型, 2.0035~2.00469)、含氮自由基(2.0031)及含硫自由基(2.0080~2.0081)[23].由于土霉素菌渣及焦碳化学结构上的复杂性,g值反映的是样品中全部类型自由基性质叠加的总结果.热解过程中,土霉素菌渣、焦碳中g值的变化如图4所示.

图3 土霉素菌渣自由基浓度变化Fig.3 Free radicals concentration of terramycin ferment residue
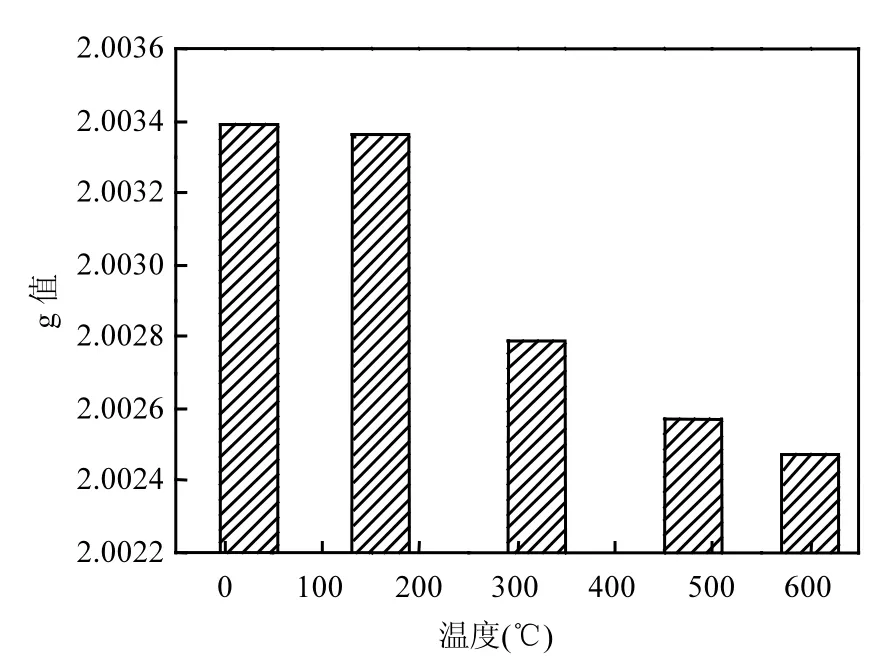
图4 土霉素菌渣g值变化Fig.4 g values of terramycin ferment residue
25℃时,土霉素菌渣的g值最高,为2.00339.同时,土霉素菌渣的元素组成主要为C、H、O、N(表1),因此大部分自由基可能以π型含氧自由基、脂肪族/芳香族烃基自由基、含氮自由基的形式存在[22].一些位于S原子上的未成对电子具有很强的自旋-轨道耦合作用,这也是土霉素菌渣g值较高的一个原因.随着热解温度升高,g值呈现单调递减的趋势.160℃之前,g值减小幅度较小.在这个温度范围,属于土霉素菌渣的脱水阶段,水分子和轻质气体发生解析,而有机质热解反应较少.因此,自由基种类的变化较少,g值与土霉素菌渣原样相近.热解温度由160℃升至480 , ℃ g值大幅降低.这是由于,一方面,脱氢反应加剧,含氧组分(醚基、羟基、羰基等)在还原反应中消耗,含氮组分分解减少,导致烃基自由基、含氧自由基、含氮自由基含量降低;另一方面,热解反应使焦碳化学结构发生剧烈变化,大量芳香组分产生,一些未成对电子在新生成芳香碳结构上积累,使自由基g值趋向于石墨基.热解温度的继续升高(480~600 ),℃ 焦碳中芳香环之间的缩合反应增多,更多类石墨结构的大型多环芳香族化合物在热解碳化过程中生成,未成对电子进一步在这些芳香碳结构上积累,促使 g值进一步降低至2.00247[23].
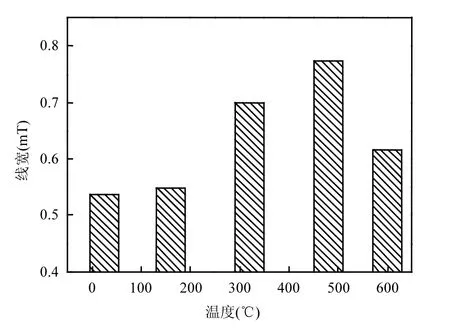
图5 土霉素菌渣线宽变化Fig.5 Linewidths of terramycin ferment residue
2.1.3 热解温度对土霉素菌渣线宽的影响 线宽反映自旋电子从激发能级回到低能级的弛豫时间,线宽与弛豫时间呈反比例关系.热解过程中,土霉素菌渣的线宽变化如图5所示.当热解温度≤480℃时,线宽单调递增,由 0.537mT升至0.773mT.在 25~480℃温度范围内,随着温度的升高和挥发分的释放,剩余的焦碳中小分子有机物发生缩聚反应,产生结构较简单的芳香组分(1~3环).位于这些简单芳香结构上的自旋电子的偶极自旋-自旋作用增强,导致谱线变宽[13,22].而当热解温度继续升高至 600 ,℃焦碳中的芳香环在碳化过程中迫位缩合,产生出大量多环芳香单元甚至尺寸更大的芳香簇,自旋电子与大型多环芳香结构之间的强烈的自旋-晶格作用使弛豫时间延长,进而线宽变窄,降至0.617mT.
2.2 土霉素菌渣的化学结构的XPS分析
土霉素菌渣及其热解焦碳的表面化学结构特性如图6所示.XPS C1s谱图可以拟合为5个拟合峰,分别位于 284.75,285.3,286.3,287.5,289.0 ± 0.2eV,对应的官能团分别为 C1(碳碳键/碳氢键,C—C/C—H),C2(碳氮键,C—N),C3(醚基或羟基,C—O/C—OH),C4(羰基 C=O,或 O—C—O),C5(羧基或酯类,O—C=O)[2,24-25],各官能团的比例变化如图7所示.另外,CO为C3、C4、C5的之和,表示碳氧官能团的总比例.
当热解温度在25~160℃范围内时,各官能团比例的变化较小;而当热解温度继续升高至600 ,℃官能团比例发生明显的变化.C1比例由56.33%大幅升至78.76%,表明土霉素菌渣热解过程中发生芳构化反应,促进了芳香组分的生成,进而导致 C—C键比例增加.土霉素菌渣中的含氮组分,如胺类、蛋白质氨基等在热解过程中发生分解,并释放出NH3、HCN、NOx等气体[26].因此C2比例呈降低趋势,由 7.3%降至 1.89%.此外,随着热解温度的升高,碳氧官能团 CO的比例由36.42%降至 19.35%,这主要由于 C4(C=O, O—C—O)的大量断键分解,C3、C5的贡献较小.热解过程中,C3比例呈现先升高后降低的趋势,这可能是由于土霉素菌渣中的脂肪族 C—O官能团热解温度较低时(320 )℃发生分解,而在高温下(480~600℃)又有一定量的芳香族 C—O官能团生成.C5比例较低(≤2.8%),并在600℃条件下完全消失.碳官能团与自由基之间存在相互联系[23],位于C1~C5中C—C、C—H、C—N、C—O(H)、C=O、O—C—O等结构上的未成对电子可能是土霉素菌渣中自由基的主要来源;热解过程中,C1比例升高,C2、CO比例降低,导致芳香族自由基增多,含氧/含氮/烃基自由基减少,这与2.1.2节中自由基特性变化的分析相一致.

图6 土霉素菌渣的XPS (C 1s)图谱及分峰结果Fig.6 XPS (C1s) spectrum and curve-fitting results of terramycin ferment residue
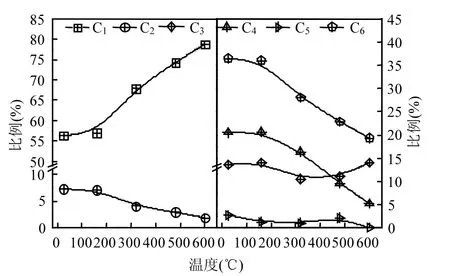
图7 土霉素菌渣的表面碳结构Fig.7 Carbon structures on surface of terramycin ferment residue
2.3 土霉素菌渣化学结构的13C NMR图谱分析
2.3.113C NMR图谱分析 采用13C NMR详细分析热解过程中土霉素菌渣的碳结构的演化.13C NMR图谱及其分峰拟合曲线如图8所示,拟合后R2均大于0.99,拟合程度较好.土霉素菌渣热解后,碳官能团的特征峰发生了显著地变化.土霉素菌渣原样(25 )℃中,脂肪碳(0~95.8ppm)、羰基碳(166.5~215.0ppm)的特征峰非常显著,这是由于土霉素菌渣中主要成分为脂肪、蛋白质.随着热解温度的增加,脂肪碳、羰基碳特征峰群逐步变小直至难以观察到.相比之下,芳香碳(95.8~166.5ppm)的特征峰群不断增大.这表明在土霉素菌渣的热解过程中,碳官能团由脂肪碳、羰基碳逐渐向芳香碳转化.
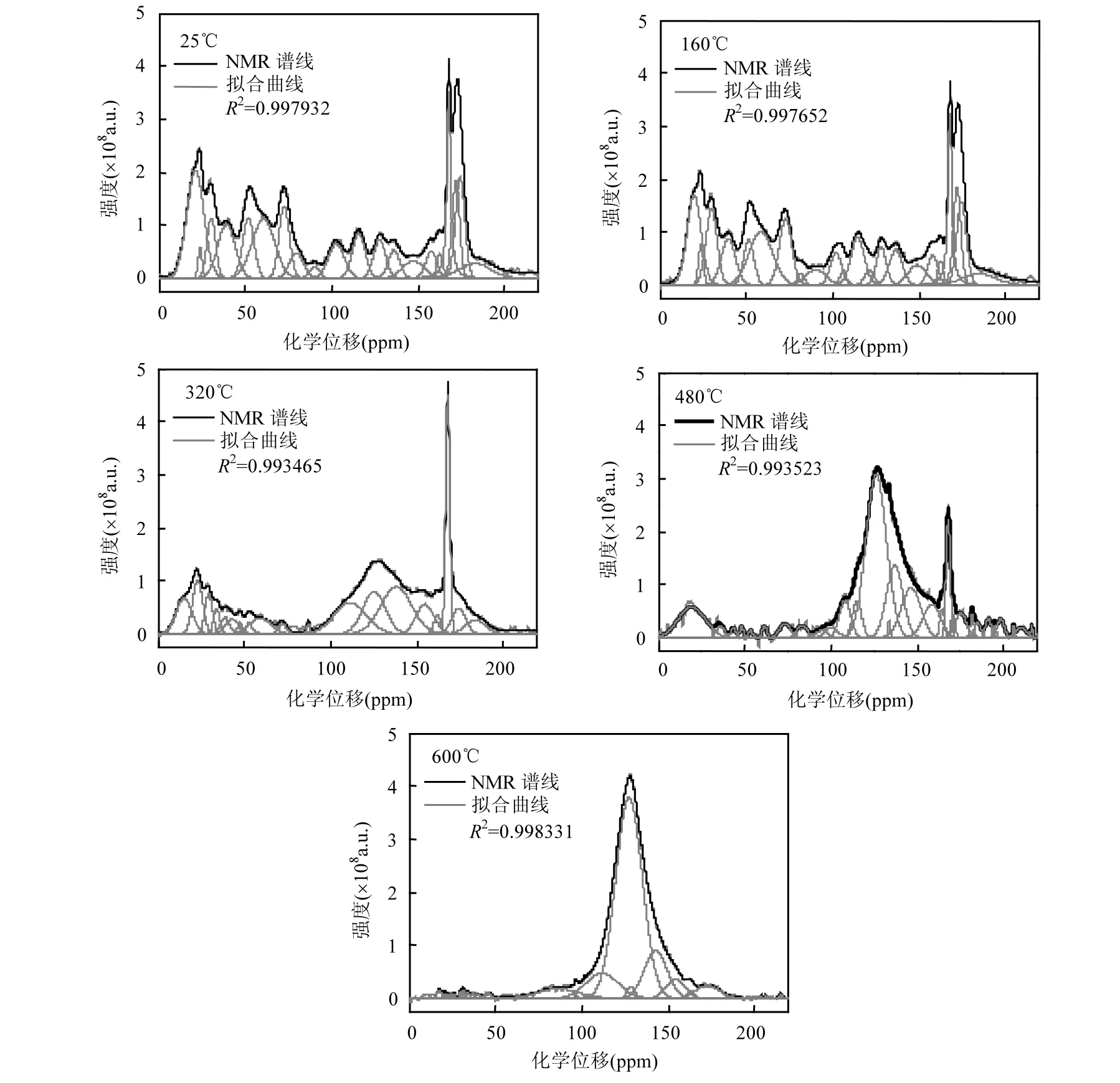
图813C NMR图谱及分峰拟合曲线Fig.813C NMR and Peak fitting curves
2.3.2 热解过程中官能团类型及比例变化 以往的研究结果表明,生物质中的碳官能团主要有脂肪族C—C键(0~55.2ppm)、甲氧基CH3—O—(55.2~60.8ppm)、 脂 肪 族 C—O 键 (60.8~95.8ppm)、芳香族C—H键(95.8~125.0ppm)、芳香族 C—C键(125.0~142.0ppm)、芳香族 C—O键 (142.0~166.5ppm)、 羰 基 (C=O)(166.5~215.0)[27-29].根据图8中13C NMR图谱的分峰拟合分析,土霉素菌渣热解前后各类型碳官能团所占比例如图9所示.25℃时,土霉素菌渣中脂肪族C—C键、甲氧基、脂肪族C—O键所占比例之和为 51.88%,羰基所占比例为 24.67%;芳香族C—H键、芳香族C—C键、芳香族C—O键所占比例之和仅为23.45%.
热解温度升至 320 ,℃焦碳中甲氧基所占比例由10.65%大幅降至2.58%,脂肪族C—O的比例由 10.65%降至 4.91%,表明甲氧基、脂肪族C—O键等侧链基团更易热解断键;随着热解温度增加,甲氧基、脂肪族 C—O键的比例继续降低,特别是甲氧基,在600℃时几乎完全消失.相比之下,脂肪族 C—C键、羰基的断键反应需要更多能量,因此这两种官能团的比例在热解温度达到480℃时才显著降低.
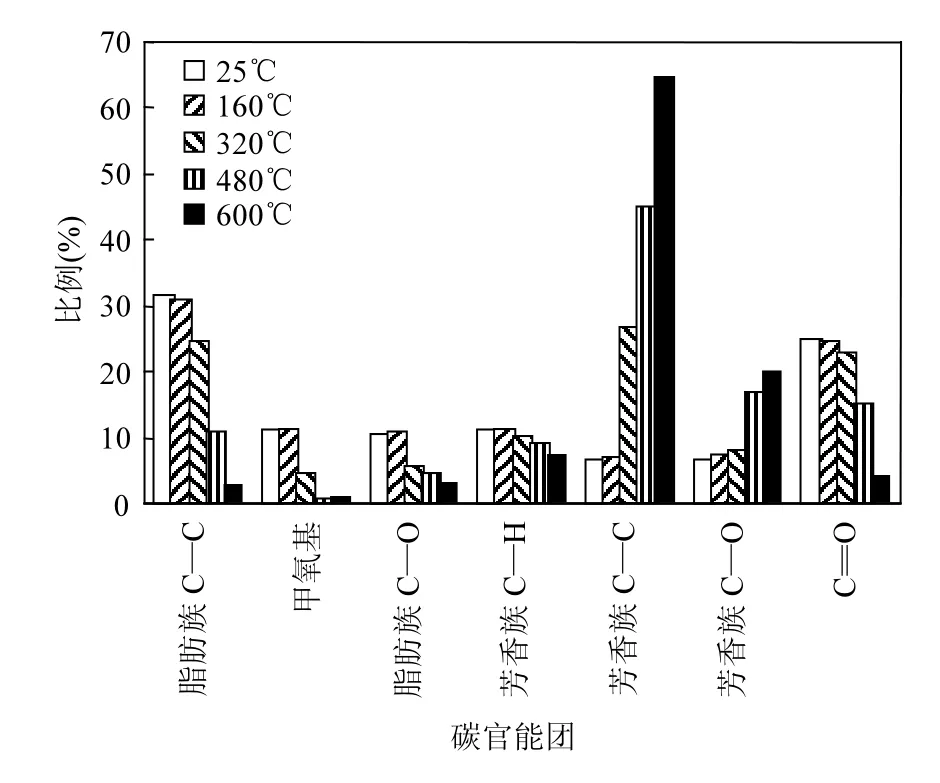
图9 土霉素菌渣中碳官能团比例Fig.9 Percentage of carbon functional groups in terramycin ferment residue
土霉素菌渣热解焦碳中芳香族C—C、C—O键的比例随热解温度的升高而升高,而芳香族C—H键的比例随热解温度的增加而小幅减小.脂肪碳C—C键、甲氧基、脂肪族C—O键、羰基等官能团的热解缩聚反应是导致芳香族C—C键比例持续升高主要原因.同时,芳香族C—O键比例增大可能是芳香族羟基与脂肪族羟基、羰基之间自由基反应的结果[30-31].芳香族 C—H键比例降低可能是由于甲氧基官能团和芳香族C—H键破裂产生芳香族自由基并随后形成芳香族C—C键的结果,Ben等[20,32]分析硫酸盐木素热解后的碳官能团,并得到相似的结果.600℃热解后,焦碳中芳香族碳官能团(芳香族 C—H、C—C、C—O键)的比例达到94.14%,碳官能团几乎完全芳香化.
3 结论
3.1 热解工艺对土霉素菌渣自由基特性有显著影响,土霉素菌渣热解焦碳中自由基浓度在320℃时最大,达到1.239×1019spins/g.
3.2 随着热解温度升高,挥发分析出、缩聚反应发生,土霉素菌渣芳香化进程加剧,自由基种类由含氧自由基、烃基自由基向芳香族自由基转变.
3.3 热解后土霉素菌渣中碳官能团种类和比例变化明显,甲氧基消失,脂肪族C—C键、脂肪族C—O键以及羰基基团比例大幅降低,同时芳香族C—C键、芳香族C—O键比例显著增高.
[1] Li C, Zhang G, Zhang Z, et al. Hydrothermal pretreatment for biogas production from anaerobic digestion of antibiotic mycelial residue [J]. Chemical Engineering Journal, 2015,279:530-537.
[2] Ma D, Zhang G, Zhao P, et al. Hydrothermal treatment of antibiotic mycelial dreg: More understanding from fuel characteristics [J]. Chemical Engineering Journal, 2015,273:147-155.
[3] 韩洪军,牟晋铭,马文成,等.微波辐射对青霉素菌渣破壁效果的影响 [J]. 化工学报, 2013,64(10):3812-3817.
[4] 张俊珂,曾 萍,宋永会,等.受四环素影响的活性污泥胞内外聚合物特征 [J]. 中国环境科学, 2016,36(3):751-758.
[5] 谢晓琳,曾 萍,宋永会,等.制药废水中磷霉素和α-苯乙胺的生物降解及相互作用 [J]. 中国环境科学, 2014,34(11):2824-2830.
[6] Jiang X, Feng Y, Lv G, et al. Bioferment residue: TG-FTIR study and cocombustion in a MSW incineration plant [J]. Environmental Science & Technology, 2012,46(24):13539-13544.
[7] Du Y, Jiang X, Lv G, et al. Thermal behavior and kinetics of bio-ferment residue/coal blends during co-pyrolysis [J]. Energy Conversion and Management, 2014,88:459-463.
[8] Du Y, Jiang X, Ma X, et al. Evaluation of cofiring bioferment residue with coal at different proportions: combustion characteristics and kinetics [J]. Energy & Fuels, 2013,27(10): 6295-6303.
[9] Zhan J, Wu R, Liu X, et al. Preliminary understanding of initial reaction process for subbituminous coal pyrolysis with molecular dynamics simulation [J]. Fuel, 2014,134:283-292.
[10] Hedegaard R V, Liu L, Skibsted L H. Quantification of radicals formed during heating of β-lactoglobulin with glucose in aqueous ethanol [J]. Food Chemistry, 2015,167:185-190.
[11] Liu M, Yang J, Liu Z, et al. Cleavage of covalent bonds in the pyrolysis of lignin, cellulose, and hemicellulose [J]. Energy & Fuels, 2015,29(9):5773-5780.
[12] He W, Liu Q, Shi L, et al. Understanding the stability of pyrolysis tars from biomass in a view point of free radicals [J]. Bioresource Technology, 2014,156:372-375.
[13] He W, Liu Z, Liu Q, et al. Behaviors of radical fragments in targenerated from pyrolysis of 4coals [J]. Fuel, 2014,134:375-380.
[14] Liu J, Jiang X, Shen J, et al. Influences of particle size, ultraviolet irradiation and pyrolysis temperature on stable free radicals in coal [J]. Powder Technology, 2015,272:64-74.
[15] Wang W, Ma Y, Li S, et al. Effect of temperature on the EPR properties of oil shale pyrolysates [J]. Energy & Fuels, 2016, 30(2):830-834.
[16] Qiao Y, Chen S, Liu Y, et al. Pyrolysis of chitin biomass: TG–MS analysis and solid char residue characterization [J]. Carbohydrate Polymers, 2015,133:163-170.
[17] Wang Y, Pedersen C M, Deng T, et al. Direct conversion of chitin biomass to 5-hydroxymethylfurfural in concentrated ZnCl2aqueous solution [J]. Bioresource Technology, 2013,143: 384-390.
[18] Sanchez-Silva L, Lopez-Gonzalez D, Villasenor J, et al. Thermogravimetric-mass spectrometric analysis of lignocellulosic and marine biomass pyrolysis [J]. Bioresource Technology, 2012,109:163-172.
[19] Jia L. Efficient one-pot synthesis of deoxyfructosazine and fructosazine from D-glucosamine hydrochloride using a basic ionic liquid as a dual solvent-catalyst [J]. RSC Advances, 2014,4(83):44253-44260.
[20] Debdoubi A, El Amarti A, Colacio E, et al. The effect of heating rate on yields and compositions of oil products from esparto pyrolysis [J]. International Journal of Energy Research, 2006, 30(30):1243,1250.
[21] Ben H, Ragauskas A J. Comparison for the compositions of fast and slow pyrolysis oils by NMR characterization [J]. Bioresource Technology, 2013,147:577-584.
[22] Liu J, Jiang X, Shen J, et al. Chemical properties of superfine pulverized coal particles. Part 1. Electron paramagnetic resonance analysis of free radical characteristics [J]. Advanced Powder Technology, 2014,25(3):916-925.
[23] Petrakis L, Grandy D W. Electron spin resonance spectrometric study of free radicals in coals [J]. Analytical Chemistry, 1978, 50(2):303-308.
[24] Liao B Q, Lin H J, Langevin S P, et al. Effects of temperature and dissolved oxygen on sludge properties and their role in bioflocculation and settling [J]. Water Research, 2011,45(2): 509-520.
[25] Pilawa B, Wieckowski A B, Pietrzak R, et al. Oxidation of demineralized coal and coal free of pyrite examined by EPR spectroscopy [J]. Fuel, 2002,81(15):1925-1931.
[26] Zhu X, Yang S, Wang L, et al. Tracking the conversion of nitrogen during pyrolysis of antibiotic mycelial fermentation residues using XPS and TG-FTIR-MS technology [J]. Environmental Pollution, 2016,211:20-27.
[27] Nagy M, Kosa M, Theliander H, et al. Characterization of CO2precipitated Kraft lignin to promote its utilization [J]. Green Chemistry, 2010,12(1):31-34.
[28] Sannigrahi P, Ragauskas A J, Miller S J. Lignin structural modifications resulting from ethanol organosolv treatment of loblolly pine [J]. Energy & Fuels, 2009,24(1):683-689.
[29] Samuel R, Pu Y, Raman B, et al. Structural characterization and comparison of switchgrass ball-milled lignin before and after dilute acid pretreatment [J]. Applied biochemistry and biotechnology, 2010,162(1):62-74.
[30] Desisto W J, Hill N I, Beis S H, et al. Fast pyrolysis of pine sawdust in a fluidized-bed reactor [J]. Energy & Fuels, 2010, 24:2642-2651.
[31] Younker J M, Ariana B, Buchanan A C. Computational study of bond dissociation enthalpies for substituted β-O-4lignin model compounds. [J]. Chemphyschem, 2011,12(12):3556-3565.
[32] Ben H, Ragauskas A J. Heteronuclear Single-quantum correlation–nuclear magnetic resonance (HSQC–NMR) fingerprint analysis of pyrolysis Oils [J]. Energy & Fuels, 2011, 25(12):5791-5801.
Effect of temperature on chemical properties of chars in terramycin ferment residue paralysis process.
HONG Chen1,2, WANG Zhi-qiang1, XING Yi1,3*, YANG Qiang1, SI Yan-xiao4, LI Yi-fei1, FENG Li-hui1, JIA Meng-meng1(1.School of Energy and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China;2.Research Center for Eco-Environmental Sciences, Chinese Academy Science, Beijing 100085, China;3.Beijing Key Laboratory of Resource-oriented Treatment of Industrial Pollutants, University of Science and Technology Beijing, Beijing 100083, China;4.School of Environment, Tsinghua University, Beijing 100084, China). China Environmental Science, 2017,37(3):1058~1065
The effects of pyrolysis technology on the chemical properties of terramycin ferment residue were investigated. The changes of free radicals and carbon structure in terramycin ferment residue during the pyrolysis process were analyzed by electron spin resonance spectroscopy (ESR), X-ray photoelectron spectroscopy and13C nuclear magnetic resonance (NMR) techniques. The results indicated that large amount of free radicals were found in terramycin ferment residue and its concentrations changed significantly with the increase of pyrolysis temperature. When the pyrolysis temperature increased to 320 ℃, the free radical concentrations in chars reached 1.239×1019spins/g. The g-values and linewidths analysis showed that the free radicals shifted from oxygen-containing radicals and carbon-hydrogen radicals to aromatic radicals, which was due to the release of volatile matters and the aggravation of polycondensation reaction. The carbon structures such as methoxyl groups (CH3—O—), aliphatic C—C bonds, aliphatic C—O bonds and carbonyl(C=O) group bonds in terramycin ferment residue were ruptured and more aromatic C—C and C—O bonds were generated during the pyrolysis process. The proportion of aromatic carbon functional groups (aromatic C—H, C—C, and C—O bonds) was up to 94.14% at the pyrolysis temperature of 600 .℃
terramycin ferment residue;pyrolysis;chars;free radicals;carbon functional groups
X787,X705
A
1000-6923(2017)03-1058-08
洪 晨(1984-),男,河北三河人,博士,主要从有机固体废弃物资源化处理研究.发表论文30余篇.
2016-06-23
国家自然科学基金资助项目(51508553);科技北京百名领军人才培养工程资助项目(LJ201620);中国博士后科学基金资助(2016M591266)
* 责任作者, 教授, xingyi@ustb.edu.cn

