国际临床数据交换标准协会标准在电子数据采集系统中的应用研究*
李庚,李晓彦,温泽淮,3**
(1.广州中医药大学第二附属医院广州510120;2.广东省中医院广州510120;3.广州中医药大学DME中心广州510405)
国际临床数据交换标准协会标准在电子数据采集系统中的应用研究*
李庚1,2,李晓彦1,2,温泽淮1,2,3**
(1.广州中医药大学第二附属医院广州510120;2.广东省中医院广州510120;3.广州中医药大学DME中心广州510405)
数据采集是影响临床研究质量的关键环节之一,通过电子数据采集软件系统(Electronic Data Capture System,EDC)实现数据采集具有节约时间和人力物力、提高效率、保证质量和可靠性等优势。国际临床数据交换标准协会(Clinical Data Interchange Standards Consortium,CDISC)建立了一系列临床研究数据标准,用于支持临床及临床前数据的电子获取、交换、递交和归档。在EDC系统中应用CDISC标准,能更好地保证临床研究数据有效、规范化的采集。本文以Oracle公司的Oracle临床数据管理软件(Oracle Clinical/Oracle Remote Data Capture,OC/RDC)系统为例,从直接应用、间接应用两方面具体介绍了如何在EDC系统实施CDISC标准。为了更好地在EDC系统中应用CDISC标准,我们建议从临床试验设计开始考虑数据采集问题,并且在病例报告表(Case Report Form,CRF)设计阶段应用CDISC标准。利用EDC系统结合CDISC标准设计电子CRF(electronic CRF,eCRF)需要耗费一定的时间与精力,而且如果设计考虑不周到,会造成数据采集错误。因此,建议在应用EDC系统时,设置一个专门人员进行eCRF设计与维护,同时,一个组织内建立一套基于CDISC标准的标准化eCRFs和标准操作规程。
国际临床数据交换标准协会标准电子数据采集软件系统应用设计
数据采集是影响临床研究质量的关键环节之一,准确、及时、完整、规范地采集数据对于提高临床研究质量、缩短研究周期、节约研究成本至关重要。CRF是临床研究数据收集的重要工具,是临床研究数据的主要来源[1]。目前主要的数据收集方式有两种,一种是纸质的CRF,另一种是通过EDC实现的eCRF。鉴于纸质CRF数据采集方式存在消耗较多人力、物力和时间、数据管理的整个过程时间跨度长、数据易丢失、数据核查工作费时等问题[2],通过EDC系统采集研究数据越来越受到临床研究者、试验申办者青睐。目前国际比较流行的EDC系统有:Oracle公司的OC/RDC(Oracle Clinical/Oracle Remote Data Capture)系统;美国MediData的Rave系统等。其中,OC/RDC系统是美国食品药品监督管理局(U.S.Food and Drug Administration,FDA)目前使用的EDC系统。
临床数据的采集、传输、存储、共享和分析的高效率基于统一、良好的数据标准。CDISC建立了一系列临床研究数据标准,用于支持临床和临床前数据的电子获取、交换、递交和归档***。美国FDA****和日本药政当局(Pharmaceuticals and Medical Devices Agency,PMDA)②*要求使用CDISC标准格式提交电子数据;中国药审中心也在积极的探讨在国内建立递交数据标准的要求**。因此,EDC系统支持CDSIC标准显得尤为重要,二者结合,能节省临床试验成本,保证数据质量,提高临床研究效率。我院于2015年引进使入Oracle公司的OC/RDC系统,本文以该系统为例介绍如何在EDC系统中使用CDISC标准。
1 电子数据采集软件系统介绍
美国药品研究和制造商协会(Pharmaceutical Research and Manufacturers of America,PhRMA)认为EDC是采用电子形式而非纸质的形式将临床试验数据直接传送至申办者的数据采集技术***。EDC的前身是20世纪80年代末到90年代初之间诞生的远程数据录入(Remote Data Entry,RDE)系统[3]。早期的RDE系统是胖客户端形式(客户需要在本地电脑上安装系统文件)。随着网络技术的不断发展,以及《FDA:21CFR Part11电子记录与电子签名有关的规定》等法律法规的出台,更加轻便的瘦客户端形式(客户端通过浏览器访问)的EDC系统应运而生。根据《美国EDC市场:支出预测及分析(2007-2012年)》显示:截止2009年,美国有50%以上的临床试验在使用EDC,随着EDC相关技术的不断进步,EDC的使用比例仍在上升。国际上EDC系统的开发和应用,包括严格的系统验证规程,不仅包括计算机系统本身的硬件和软件系统本身的合规性,还要求对操作人员、运用环境和操作流程的规范等都必须符合监管要求[4]。使用EDC系统会带来很多益处,包括:节省数据录入时间(无需转录纸质CRF),提高录入数据质量;数据清理与审核和数据采集整个过程同步进行,节省时间[5];数据质疑解决速度更快,费用降低[6];方便研究相关人员及时了解项目进度;处理不良事件更加快捷、及时;电子数据存储器容量大,占用物理空间小,运输、传递的成本低于纸质数据采集;使用EDC建立标准库,方便eCRF等重复利用,提高工作效率[5];另外,EDC系统使用角色权限控制,安全性更强[7]。我院引入的EDC系统(OC/RDC,版本5.1.0)及与其配套使用的术语管理系统TMS已通过EDC相关质量体系认证。
2 国际临床数据交换标准协会介绍
CDSIC建立了一系列临床研究数据交换标准;其中,临床数据获取协调标准(Clinical Data Acquisition Standards Harmonization,CDASH)标识出了从临床、科研以及监管角度所需的基本数据采集字段,使得研究中心的数据采集更加高效和一致。它在临床研究数据流较早的阶段定义了一组基本的“强烈推荐和推荐/有条件”的数据采集字段,而这些字段一般会出现在大多数的CRF上****。研究数据列表模型(Study Data Tabulation Mode,SDTM)定义了数据递交的标准,采用CDASH数据采集字段(或变量)有助于SDTM结构的映射*****。
3 国际临床数据交换标准协会标准在远程数据收集系统中的应用
CRF的设计是一个规范化、有文档记录的受控过程,与方案设计和数据库设计密切相关[8]。因此,为方便后期EDC系统中建立eCRF采集数据,在设计CRF时,可以参考CDISC CDASH标准。具体上,虽然CDASH未就CRF布局进行规范,但是我们可以尽量安排属于同一域的变量在同一模块;同时,尽量选择CDASH推荐或有条件推荐变量收集数据。另外,在设计变量选项时,可以参考受控术语(Controlled Terminology,CT)。在数据库设计阶段引入CDISC标准,保持数据标准的统一和数据的可追溯性,可从数据库中直接抽取出大量符合SDTM的数据集,进而减少后期繁杂的映射转换[9]。在EDC系统中建立eCRF,设计数据库时,也可以参考CDISCCDASH和SDTM标准进行。
3.1 临床数据获取协调标准和研究数据制表模型标准
在介绍如何在EDC系统中使用CDISC标准时,先了解一下数据结构的两种类型:水平(横向)型数据结构和垂直(纵向)型数据结构。水平型数据结构将采集到每一个数据建立一个变量,数据集中的每一个数据与CRF中每一个数据点呈一一对应关系,每个受试者对应一条记录。垂直型数据结构以人次为单位,每一事件/观察一条记录,每个观察通过一系列的变量来描述。传统的临床试验习惯采用水平型数据结构。而CDISC标准中,除人口学资料域(DM)外,其他域基本采用垂直型数据结构[10]。
3.1.1 直接应用
采用水平型数据结构的域能直接应用CDASH、SDTM标准。如:DM域中的性别变量、出生日期变量等,可直接根据CDISC标准进行数据库变量设计。此外,垂直型数据结构的域中,若纸质版数据采集字段题录是CDISC标准中某个字段的值域,如:生命体征域(Vital Signs,VS),“身高”是纸质版CRF的采集字段的题录,但是在CDSIC标准中,“身高”是变量VSTEST值域之一,同时搭配VSORRES变量存储“身高”结果,则不能直接应用,反之,能直接应用。又如不良事件(Adverse Event,AE)域、合并用药(Priorand Concomitant Medications,CM)域虽然是垂直型数据结构,但是该域中的大部分变量能直接应用。因此,为了更好的与CDISC标准保持一致性,我们建议此类数据在进行CRF设计时,尽量直接参照CDISC标准。
图1为AE域中变量在OC/RDC系统中的应用,除AEACNNY、AEUNBLN外,其他变量均为直接应用。在应用时,可以结合参考CDASH和SDTM两个标准。

图1 不良事件域中变量在电子数据采集软件系统中的直接应用
3.1.2 进行相关设置后直接应用
直接应用有点困难,但能通过一些设置进行应用。纸质CRF的采集字段题录是CDISC变量值域的垂直型数据结构域,若存储采集数据结果的变量(如:VSORRES)属性都是文本型,则可以通过设置重复次数和默认值实现。如图2,CDISC变量VSTEST以及VSUNIT利用设置重复值的方式(图3)进行采集。
3.1.3 间接应用
间接应用分为两种情况,一是不能直接使用,设置默认值也难以实现。有些垂直型数据结构的域,纸质CRF的题录文字和答案选项结合起来构成CDISC某个变量,或存储采集数据结果的变量属性或变量值域不一样,不能通过设置默认值的方式应用。图4中的处置(Disposition,DS)域,是否完成研究、退出研究决定者、退出研究原因等都对应DS域中DSTERM和DSDECOD变量。但是,因为是否完成研究、退出研究决定者、退出研究原因的答案选项(值域)不一样,不能通过设置默认值而实现。此时,可以参考CDISC标准设置新的变量(图5),再在后台编写程序为CDISC变量赋值。
另一种间接应用的情况是CDISC标准中未涉及的内容。由于CDISC标准未涉及中医药相关的内容,对于中医药临床研究,存在包括诊断、治疗、环境等相关内容无法直接应用CDISC标准设置变量。对于这种情况,可以采取两种措施,一是参考CDISC标准,设计一个全新的中医药相关域,并且设置相关变量;二是应用QS域,将所有中医药相关研究内容通过QS域变量进行采集。图6将中医证候信息应用QS域变量进行采集。
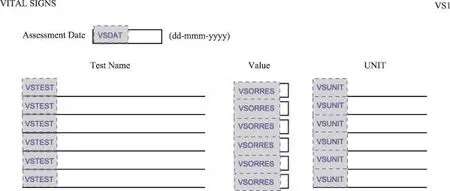
图2 生命体征域变量设置

图3 生命体征域重复次数和默认值设置效果
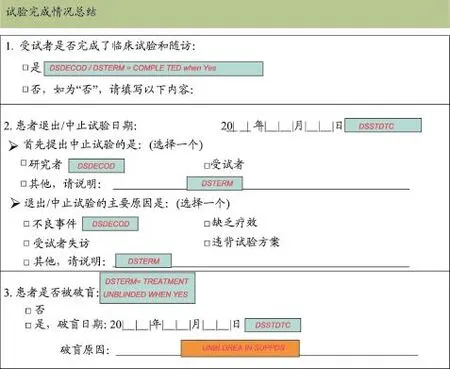
图4 基于国际临床数据交换标准协会研究数据列表模型标准的处置域注释病例报告表
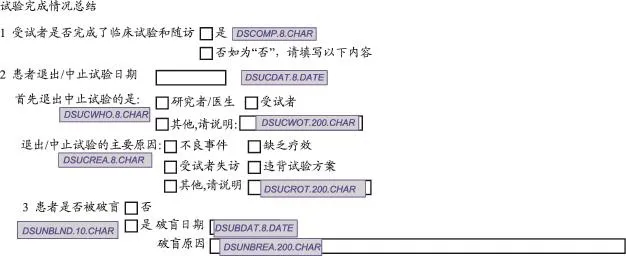
图5 处置域在Oracle临床数据管理软件系统中变量命名
3.2 控制术语(Controlled Term inology,CT)
CT是CDISC标准体系中的一个内容标准,笔者认为在CRF设计阶段就应该参考本标准进行变量值域设计。此外,在设置eCRF时,对于一些无法直接应用的垂直型数据结构的域,可以使用CT中的值域范围进行变量命名。比如CT标准中规定了受试者特征(SubjectCharacteristics,SC)域中变量SCTESTCD的值域范围(包括受教育程度、职业、居住地等)(图7),我们可以参考这些值域将受教育程度变量命名为EDLEVEL,将职业变量命名为EMPJOB,将居住地变量命名为RESIDENC(图8)。

图6 运用QS域采集中医证候信息
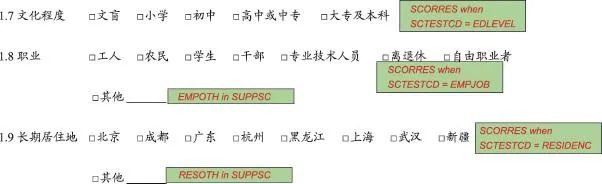
图7 基于国际临床数据交换标准协会SDTM标准的受试者特征域注释CRF
4 讨论
数据采集电子化与智能化、数据审核远程化、数据标准透明化是电子化临床数据管理的长期发展趋势[4]。中国临床研究数据管理规范化面临两大问题,一是缺少规范化的临床研究数据管理软件,二是缺少数据标准。由于国内临床试验经费问题和引用国外成熟正规的EDC高成本之间难以协调,国内大多数临床研究采用的是本土化的EDC系统,这些系统可能存在未遵循国际上EDC系统标准(如:FDA推出的临床试验中采用计算机系统的指导原则),尤其是未进行系统验证的问题。因此,广东省中医院于2015年引进OC/RDC系统,希望借此系统,提高我院临床试验数据管理质量,提高效率,提高临床研究质量。CDISC标准致力于促进数据交换、提高临床研究效率与质量,在EDC系统中应用CDISC标准,能更好的保证临床研究数据有效、规范化的采集。本文作者借助OC/RDC平台在中医药临床研究数据采集中应用CDISC标准,并进行创新性的本土化改造,从直接应用、相关参数配置等方面总结CDISC应用规律,有助于临床研究数据采集系统的研发或者临床研究数据采集过程中了解和把握数据规范化采集的技巧,对类似应用具有一定的参考价值。

图8 受试者特征域在Oracle临床数据管理软件系统中变量命名
为了更好的在EDC系统中应用CDISC标准,我们建议一方面从临床试验设计开始考虑数据采集问题,并且在CRF设计阶段应用CDSIC标准,特别是CDASH、SDTM标准以及CT控制术语。特别需要注意的是,CDISC标准数据结构(垂直型数据结构)与我们习惯的水平型数据结构之间的转换,有时候会带来数据录入界面不友好,数据录入过程复杂化的问题[9,11-13]。为了更好的提高效率,我们不建议直接采用CDSIC标准变量,而是通过间接方式实现CDISC标准应用,后期再行数据映射。另一方面在中医药临床研究中,缺乏中医药特色相关内容,建议采用组织标准进行标准化。目前国家食品药品监督管理总局已经成立临床试验数据标准化工作指导组,并针对中医药临床研究如何实现CDISC标准设立了TCM专业小组。三是EDC系统结合CDISC标准的应用一方面能更好的保证数据质量,实现标准化,但另一方面,设计eCRF需要耗费一定的时间与精力,而且如果设计考虑不周到,会造成数据采集错误,另外,由于EDC实现了数据采集、审核、数据验收电子化,流程繁琐、用户权限多样,需要花费比纸质CRF更多的时间进行培训与管理。因此,建议在应用EDC系统时,设置一个专门人员进行eCRF设计与维护,同时,一个组织内建议一套标准化的eCRFs和标准操作规程,以节约培训成本。
1李庚,李晓彦,温泽淮.临床数据交换标准协会标准在中医药临床研究病例报告表设计中的应用.广州中医药大学学报,2014,31(1):138-141.
2孙亚林,贺佳,曹阳,等.临床数据管理的电子化趋势.中国新药杂志,2005,14(4):393-395.
3 El Emam K,Jonker E,Sampson M,et al.The use of electronic data capture tools in clinical trials:Web-survey of 259 Canadian trials.J Med InternetRes,2009,11(1):e8.
4邓亚中,于嘉,刘川,等.电子化时代临床数据管理现状和未来趋势.中国新药杂志,2014,23(8):879-884.
5谢高强,姚晨.数据管理在临床研究中的地位和作用.北京大学学报(医学版),2010,42(6):641-643.
6 Babre D.Electronic data capture-Narrowing the gap between clinical and datamanagement.PerspectClin Res,2011,2(1):1-3.
7谢高强,李英山,姚晨.电子数据采集对我国临床研究的机遇和挑战.中国新药杂志,2013,22(6):620-623.
8卜擎燕,熊宁宁,邹建东,等.从临床研究数据管理角度设计病例报告表.中国新药杂志,2007,16(5):339.
9陆芳,李庆娜,赵阳,等.中药新药临床研究数据管理应用CDISC标准的初步探讨.中国中医药信息杂志,2016,23(1):9-14.
10艾艳坷,何丽云,刘保延,等.中医临床研究中实现CDISCSDTM标准的方法.世界科学技术-中医药现代化,2015,17(3):301-305.
11黎燕兰,胡镜清,刘保延.CDISC标准与中医药临床研究数据标准化.世界科学技术-中医药现代化,2012,14(6):2109-2114.
12董雯雯.CDISC标准在药物临床试验中的应用.上海:复旦大学硕士学位论文,2012.
13向楠,邓阿黎,丁晓娟,等.中药新药临床试验病例报告表的标准化及电子化研究探讨.中药新药与临床药理,2006,17(4):297-299.
App lication of ClinicalData Interchange Standards Consortium(CDISC)Standards to Electronic Data Cap ture System
LiGeng1,2,LiXiaoyan1,2,Wen Zehuai1,2,3
(1.The Second Affiliated HospitalofGuangzhou University ofChineseMedicine,Guangzhou 510120,China; 2.Guangdong ProvincialHospitalofChineseMedicine,Guangzhou 510120,China; 3.NationalCenterforDesign Measurementand Evaluation in ClinicalResearch,Guangzhou University of ChineseMedicine,Guangzhou 510405,China)
Data acquisition is one of the key links that influencing the quality of clinical research.Electronic data capture system(EDC)embodies the advantages of saving time,manpower and material resources and improving efficiency and reliability by data acquisition.CDISC has established worldwide industry standards to support the electronic acquisition,exchange,submission and archiving of clinical research data.The application of CDISC standards to EDC system is favorable in ensuring the validity and standardization of clinicaldata.Thispaper takes the Oracle’sOC/ RDC(Oracle Clinical/Oracle Remote Data Capture)system as an example to discuss the application of CDISC standard to EDC system from the two aspects:direct application and indirect application.We suggest that data collection should be taken into account during the design phase of a clinical trial,and the CDISC standard be applied at the CRF design stage.A design for eCRF takes time and effortby the combination of EDC system and CDISC standard,while thoughtless designmay collect thewrong data.Therefore,it is suggested thata specialized personnel should be put in charge ofeCRF design andmaintenance during the operation of EDC system,and a setof standardized eCRFs based on CDISC standard and standard operating proceduresshould be built in oneorganization.
Clinicaldata interchange standards consortium standard,electronic data capture system,application,design
10.11842/wst.2017.02.023
R2
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2017-01-16
修回日期:2017-02-15
*广东省中医院中医药科学技术研究专项课题(YN2015QN22):CDISC针灸治疗领域标准制定,负责人:李庚;广东省中医药局课题(20142060):CDISC标准在中医药临床试验数据管理中的应用研究,负责人:李晓彦。
**通讯作者:温泽淮,研究员,主要研究方向:临床研究方法学。
***http://www.cdisc.org/CDISC-Vision-and-Mission.2015
****http://www.appliedclinicaltrialsonline.com/fda-binding-guidance-pivotal-milestone-cdisc-standards
*https://www.cdisc.org/news/japan-pmda-releases-technical-notification-electronic-data-submission-technical-conformance
**http://www.cde.org.cn/news.do?method=largeInfo&id=313176.2013
***https://rammellconsulting.files.wordpress.com/2011/05/edc-position-paper-revision-1-final-version.pdf
****https://www.cdisc.org/cdash-v1-1
*****https://www.cdisc.org/standards/foundational/study-data-tabulation-model-implementation-guide-sdtmig/sdtmig-v32

