高速逆流色谱快速分离山竹子素的制备方法实验研究*
张宝军,房庆伟,谭红胜,郑昌武,付文卫**
(1.上海中医药大学中药学院上海201203;2.中药创新药物研发上海高校工程研究中心上海201203)
高速逆流色谱快速分离山竹子素的制备方法实验研究*
张宝军1,2,房庆伟1,2,谭红胜1,2,郑昌武1,2,付文卫1,2**
(1.上海中医药大学中药学院上海201203;2.中药创新药物研发上海高校工程研究中心上海201203)
目的:制备山竹子素(garcinol)化学对照品。方法:采用高速逆流色谱法,从多花山竹子、山木瓜、大叶藤黄三种藤黄属植物粗提物中快速分离化合物garcinol,溶剂系统为正己烷-乙酸乙酯-95%乙醇-水(8:8:12:4,体积比),上相做固定相,下相做流动相,仪器转速850 rpm,温度25℃,检测波长254 nm,目标化合物馏分经Sephadex LH-20凝胶柱柱色谱纯化,所得样品由高效液相色谱法检测纯度。结果:可从104.765 g多花山竹子枝、105.270 g山木瓜枝、102.318 g大叶藤黄果实中分离得到garcinol的量分别为45mg、281mg、4080mg,纯度分别为98.72%、98.36%、98.42%。结论:通过对比三种植物样品处理方法,结果以大叶藤黄果实作为原料时,正己烷-乙酸乙酯-95%乙醇-水(5:5:5:5,体积比)萃取的上相浸膏,经高速逆流色谱法结合凝胶柱柱色谱法,可快速高效、大量制备化合物garcinol。实验表明该方法效率高,可操作性强,制备量大。
高速逆流色谱大叶藤黄山竹子素制备方法
山竹子素(garcinol)是从藤黄科(Guttiferae)植物山木瓜Garcinia esculenta Y.H.Li枝、怒江藤黄Garcinia nujiangensis C.Y.Wu et Y.H.Li枝或叶、大叶藤黄Garcinia xanthochymus Hook.f.ex T.Anders.果实、印度藤黄果实等中提取分离的一种氧杂蒽酮衍生物类活性成分[1-3]。现代药理研究表明,garcinol具有抗肿瘤、抗病毒、抗炎、抗衰老、抗氧化等作用,能够抑制前列腺癌、乳腺癌、胰腺癌等多种肿瘤的生长[4-6],具有增加肿瘤细胞放射增敏性的潜能和抑制肿瘤增殖的作用[7]。目前,garcinol的主要提取方法有冷浸法、渗漉法、回流法,主要的分离方法是反复硅胶柱柱色谱法、重结晶法、高效液相制备法[1,7,8]。采用传统经典柱色谱法分离制备,过程繁琐,耗时长且伴随着样品的损失,效率低。目前,还没有快速分离纯化garcinol较好方法。因此,研究garcinol(结构见图1)的高效分离制备方法具有重要意义。
高速逆流色谱技术(High-Speed Counter-Current Chromatography,HSCCC)作为一种连续高效的液-液分配分离技术,由于无需固态支持物,因此可避免固态基质或载体不可逆吸附造成的样品吸附、损失、失活变性等问题,特别适合于天然生物活性成分的分离。与传统经典柱色谱法相比,HSCCC具有操作简单、溶剂消耗少、快速高效、制备量大、高纯度、应用范围广、适用性好等优点,已广泛应用于酚类、黄酮类、香豆素类、生物碱类、皂苷类、萜类、多肽、蛋白等多种物质的制备分离[9-14]。
本研究选取了多花山竹子、山木瓜、大叶藤黄3种藤黄属植物,经样品前处理后,结合分配系数测定法及参考相关文献,考察并优化了一系列不同配比的溶剂体系,从中筛选出了一种适合于garcinol分离的溶剂体系,并成功用于garcinol的高效制备性分离。
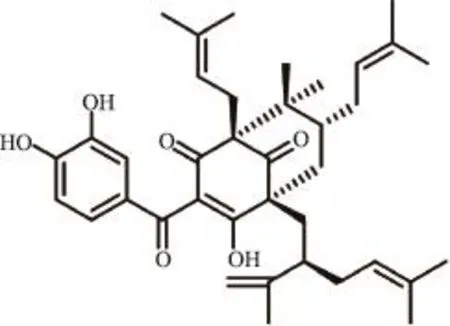
图1 garcinol结构式
1 实验材料
1.1 仪器与试药
高速逆流色谱仪(HSCCC):主机(TEB-300C,上海同田生化科技有限公司),紫外检测器(UV2000D,上海三为科学仪器有限公司),低温恒温槽(DC-0506,上海同田生化科技有限公司)。Waters e2695高效液相色谱仪(美国,包括输液泵、脱气装置、自动进样装置、PDA检测器),Aglient ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5µm)。SephadexTMLH-20凝胶柱(GEHealthcareBio-Sciences)。
garcinol对照品(上海中医药大学中药创新研发上海工程中心提供,纯度≥98%);95%乙醇、正己烷、乙酸乙酯、甲醇、二氯甲烷等溶剂均为分析纯(国药集团化学试剂有限公司);液相色谱分析用的乙腈为色谱纯(国药集团化学试剂有限公司),水为娃哈哈纯净水(杭州娃哈哈集团有限公司)。
1.2 实验样品
多花山竹子枝(广西桂林),山木瓜枝(云南怒江),大叶藤黄果实(云南德宏),经上海中医药大学中药学院张红梅副研究员鉴定为藤黄属植物多花山竹子的干燥枝、藤黄属植物山木瓜的干燥枝、藤黄属植物大叶藤黄的干燥成熟果实,植物标本存放于上海中医药大学中药创新药物研发上海高校工程研究中心。
2 实验方法
2.1 样品的制备
称取104.765 g多花山竹子枝粉末、105.270 g山木瓜枝粉末、102.318 g大叶藤黄果实粉末分别置于冷凝回流装置中,以7倍量95%乙醇加热回流提取3次,每次1h,趁热过滤,合并滤液,50℃下减压浓缩至粘稠状,真空干燥,得到25.144 g多花山竹子枝乙醇粗提物(A)、3.447 g山木瓜枝乙醇粗提物(B)、56.130 g大叶藤黄果实乙醇粗提物(C);分别以正己烷-乙酸乙酯-95%乙醇-水(5:5:5:5,体积比)作为溶剂系统,进行萃取,收集上相有机相减压浓缩至无溶剂味,依次得7.542 g浸膏(A1),1.729 g浸膏(B1),13.247 g浸膏(C1),置干燥器中保存,备用。
取7.542 g多花山竹子枝浸膏(A1)经硅胶柱色谱分离,依次用二氯甲烷、二氯甲烷:甲醇(30:1)混合溶液作为洗脱剂洗脱,经薄层色谱法收集合并含有目标化合物的馏分(A2);再经Sephadex LH-20凝胶柱色谱分离,甲醇作为洗脱剂洗脱,经薄层色谱法收集合并含有目标成分的馏分,减压浓缩干燥,得到406.96mg浸膏(A3),置干燥器中保存,备用。
2.2 HSCCC溶剂系统的选择
第一,扰乱社会市场。道德与利益的冲突时有发生,因为市场永远都是追求利益最大化的地方,部分企业为了支撑业绩、吸引投资,通过舞弊、造假来粉饰报表,舞弊案件层出不穷。若是这种现象泛滥,资本市场将充斥着“虚假”,这给市场经济的健康发展带来非常不利的影响,市场经济是信用经济,诚信缺失必将危及市场经济根基。
两相溶剂系统的选择是依据目标化合物在两相溶剂中分配系数来确定,一般理想的分配系数(K)在0.5-2.5之间,可通过高效液相色谱法来计算K值。具体步骤如下:取一定量的提取物于1.5mLEP管中,加入预先平衡好的两相溶剂上相、下相各500µL,剧烈震摇使其充分溶解混合,静置分层后,取等体积上相、下相各200µL,挥干溶剂,残渣用500µL甲醇溶解,分别取10µL通过HPLC分析。待分离物质在上相的峰面积响应值记作AU,在下相的峰面积响应值记作AL,根据公式K=AU/AL计算其在不同体系下的分配系数。
2.3 两相溶剂体系及样品溶液的配制
本实验选用正己烷-乙酸乙酯-95%乙醇-水(8:8:12:4,体积比)作为溶剂系统,将各溶剂按照比例加入分液漏斗中,充分振摇,溶剂系统以无乳化,分层时间在20-30 s为宜,静置分层后,将上下相分开,超声脱气20min,脱气后静置至室温,备用。
分别称取浸膏(A3)201 mg、(B1)500 mg、(C1)500mg,加入一定体积的上相溶液(Vm≤20mL),振荡混匀使其完全溶解,进样前配制。
2.4 样品的分离
HSCCC的色谱条件:正己烷-乙酸乙酯-95%乙醇-水(8:8:12:4,体积比)溶剂系统,取上相作为固定相,下相为流动相;转速850 rpm,检测波长:254 nm,温度:25℃。在上述色谱条件下,待检测器出口有下相流出且保持恒定时,即螺旋管内已建立两相流体动力学平衡,将已准备好的浸膏(A3)、(B1)、(C1)样品溶液分别注入色谱仪中,使用色谱工作站采集数据,采用自动接收器收集馏分,经薄层色谱显色反应和HPLC检测,收集合并含有目标化合物的馏分,减压浓缩干燥,得29.02mg粗品(A4)、82.28mg目标成分(B2)、164.51mg粗品(C2)。
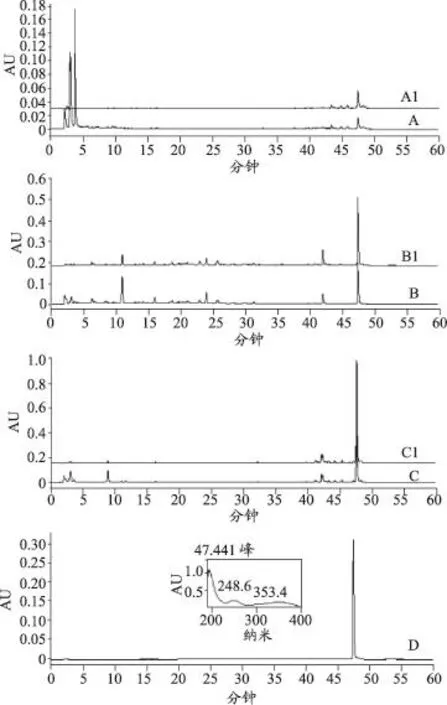
图2 三种藤黄属植物HPLC色谱图
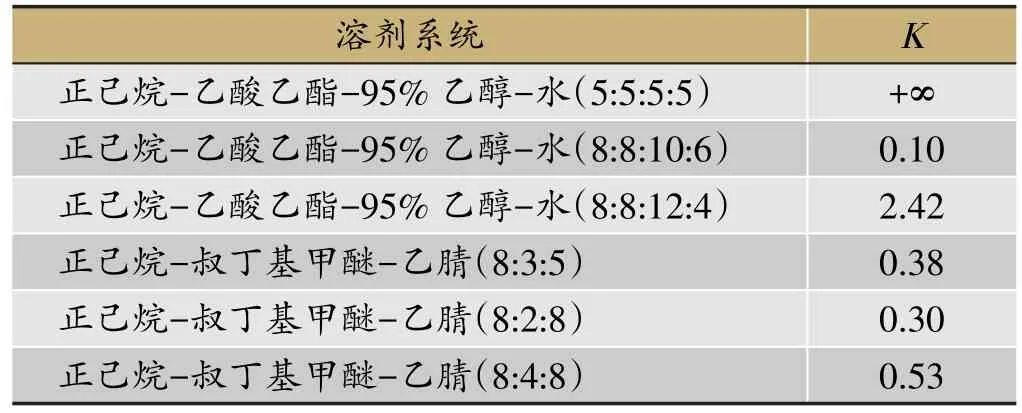
表1 目标成分garcinol在不同系统中的分配系数(K值)表
上述多花山竹子枝粗品(A4)、大叶藤黄果实粗品(C2)分别经Sephadex LH-20凝胶柱色谱分离,甲醇作为洗脱剂洗脱,经薄层色谱显色反应和HPLC检测,收集合并目标成分,减压浓缩干燥分别得到21.75mg、154.80mg目标成分。
2.6 三种藤黄属植物粗提物及分离物的garcinol分析
多花山竹子枝、山木瓜枝、大叶藤黄果实粗提物和经HSCCC、凝胶柱色谱分离所得馏分均经HPLC分析。HPLC的色谱条件:色谱柱:Aglient ZORBAX SBC18色谱柱(250 mm×4.6 mm,5µm);流动相:乙腈-0.1%甲酸水,梯度洗脱,0-45min,30%→98%乙腈,45-50min,98%→30%乙腈,50-60min,30%乙腈;流速:1.0mL·min-1;进样量:10µL;柱温:35℃,检测波长:254 nm。
HSCCC及Sephadex LH-20凝胶柱色谱分离所得目标成分均与garcinol对照品对照鉴定。
3 结果与分析
3.1 HPLC分析
本研究采用乙腈-0.1%甲酸水作为流动相对三种藤黄属植物粗提物进行分析,采用2.6项下洗脱程序时,样品中的目标峰得到很好地分离,全波长扫描发现,在254 nm的波长下,三种植物样品色谱峰信息丰富,与目标峰有较好的分离度且响应值大,因此,选择254 nm作为检测波长。与对照品HPLC的保留时间和紫外光谱对比,确定组分1为garcinol,在后续目标物分离中以其为参照进行,如图2所示。
3.2 HSCCC溶剂系统的选择优化
溶剂系统的选择是影响HSCCC分离的关键因素,根据目标成分的理化性质,结合研究报道[15-17],考察了HSCCC中应用最广泛的正己烷-乙酸乙酯-甲醇-水溶剂体系,实验中选用了更为经济环保的95%乙醇替换了甲醇。考察了一系列不同配比的溶剂体系对目标化合物分配系数的影响,结果见表1。
从表1可以看出,选择正己烷-乙酸乙酯-95%乙醇-水(5:5:5:5,体积比)作为溶剂系统时,目标化合物几乎完全分配于上相,因此,首先选择正己烷-乙酸乙酯-95%乙醇-水(5:5:5:5,体积比)溶剂系统对三种藤黄属植物醇提物进行萃取,以靶向富集目标成分。结合研究报道,选择正己烷-乙酸乙酯-95%乙醇-水(8:8:10:6,体积比)溶剂系统作为初始筛选体系,随着体系中95%乙醇比例的增加,上相的保留能力显著增加,目标成分的分配系数显著增大。选择正己烷-叔丁基甲醚-乙腈溶剂系统筛选时,上相保留能力较低,目标成分的分配系数偏小,可导致出峰时间提前,不利于高纯度目标产物的制备。溶剂系统的选择是依据目标化合物在两相溶剂中分配系数来确定,一般理想的分配系数(K)在0.5-2.5之间。结合上述因素及HSCCC实际分离效果,选择正己烷-乙酸乙酯-95%乙醇-水(8:8:12:4,体积比)溶剂系统。
3.3 HSCCC结合Sephadex LH-20凝胶柱色谱分离纯化结果
HSCCC法采用正己烷-乙酸乙酯-95%乙醇-水(8:8:12:4,体积比)溶剂系统,结合Sephadex LH-20凝胶柱柱色谱法,可从201mg多花山竹子枝粗提物(A3)中得到纯度为98.72%的garcinol 21.75mg(HSCCC保留时间82-87min),得率:0.04%(得率=产物质量/药材质量×100%);可从500mg山木瓜枝粗提物(B1)中得到纯度为98.36%的garcinol 82.28mg(HSCCC保留时间225-260min),得率:0.27%;可从500mg大叶藤黄果实粗提物(C1)中得到纯度为98.42%的garcinol 154.80 mg(HSCCC保留时间220-245 min),得率:3.98%,HSCCC色谱图见图3。
3.4 纯度检测和结构鉴定
在分离过程中,一直采用薄层色谱显色反应和HPLC检测对分离过程中所得馏分进行跟踪检测。目标成分纯度在不同波长下经HPLC峰面积归一化法测定,经对照品对比鉴定为garcinol,结构见图1,HPLC谱图见图2。
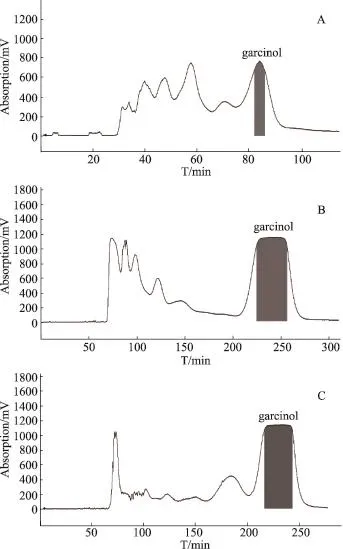
图3 三种藤黄属植物粗提物HSCCC色谱图
4 讨论
为增加产物的量,本文采用正己烷-乙酸乙酯-95%乙醇-水(5:5:5:5,体积比)作为溶剂系统对粗提物进行萃取,除杂率分别为70%(多花山竹子),50%(山木瓜),77%(大叶藤黄),是一种高效的目标成分富集方法。样品经逆流色谱分离后,结合Sephadex LH-20凝胶柱色谱法进一步纯化目标馏分,可得到高纯度产物。
本研究建立了适合于多花山竹子、山木瓜、大叶藤黄3种藤黄属植物提取物中garcinol的高速逆流色谱分离方法,结合实验步骤、实际分离效果及产率,通过对比三种材料的提取方法,发现以大叶藤黄果实作为原料时,经高速逆流色谱法结合凝胶柱色谱法,可快速高效、大量制备化合物garcinol,该方法产品收率高,制备方法可操作性强,为garcinol的制备提供了一条新的技术路线,为进一步garcinol生理活性及作用机制的研究奠定夯实的物质基础。
1 Tang Z Y,Xia Z X,Qiao SP,et al.Four new cytotoxic xanthones from Garcinia nujiangensis.Fitoterapia,2015,102:109-114.
2 Kaur R,Chattopadhyay SK,Tandon S,et al.Large scale extraction of the fruits of Garcinia indica for the isolation of new and known polyisoprenylated benzophenone derivatives.Ind Crops Prod,2012,37:420-426.
3 Sang S,Cheng X,Stark R E,et al.Chemical studies on antioxidant mechanism of tea catechins:analysis of radical reaction products of catechin and epicatechin with 2,2-Diphenyl-1-picrylhydrazyl.Bioorgan Med Chem,2002,10(7):2233-2237.
4 Ahmad A,Sarkar SH,Bitar B,et al.Garcinol regulates EMT and Wnt signaling pathways in vitro and in vivo,leading to anticancer activity againstbreastcancer cells.MolCancerTher,2012,11(10):2193-2201.
5 Ahmad A,Wang Z,Wojewoda C,et al.Garcinol-induced apoptosis in prostate and pancreatic cancer cells is mediated by NF-kappaB signaling.FrontBiosci(Elite Ed),2010,3:1483-1492.
6 Parasramka M A,Gupta SV.Synergistic effect of garcinol and curcumin on antiproliferative and apoptotic activity in pancreatic cancer cells.J Oncol,2012,2012:709739.
7 Balasubramanyam K,Altaf M,Varier R A,et al.Polyisoprenylated benzophenone,garcinol,a natural histone acetyltransferase inhibitor, represses chromatin transcription and alters global gene expression.J BiolChem,2004,279(32):33716-33726.
8 Fuller R W,Blunt JW,Boswell J L,et al.Guttiferone F,the First Prenylated Benzophenone from Allanblackia stuhlmannii.J Nat Prod, 1999,62(1):130-132.
9 Liu Q,Zeng H,Jiang S,et al.Separation of polyphenols from leaves of Malus hupehensis(Pamp.)Rehder by off-line two-dimensional High Speed Counter-Current Chromatography combined with recycling elution mode.Food Chem,2015,186:139-145.
10 Jiang S,Liu Q,Xie Y,et al.Separation of five flavonoids from tartary buckwheat(Fagopyrum tataricum(L.)Gaertn)grains via off-line two dimensional high-speed counter-current chromatography.Food Chem, 2015,186:153-159.
11 GuoW,Wang L,Gao Y,etal.Isolation of isochlorogenic acid isomers in flower buds of Lonicera japonica by high-speed counter-current chromatography and preparative high performance liquid chromatography. JChromatogrBAnalytTechnolBiomed Life Sci,2015,981-982:27-32.
12 Bakri M,Chen Q,Ma Q,et al.Separation and purification of two new and two known alkaloids from leaves of Nitraria sibirica by pH-zonerefining counter-current chromatography.J Chromatogr B Analyt TechnolBiomed LifeSci,2015,1006:138-145.
13李爱峰,刘宁宁,柳仁民.高速逆流色谱原理及其在天然产物化学成分分离中的应用研究进展.理化检验-化学分册,2008,44(5):481-489.
14祝顺琴,谈锋.高速逆流色谱在天然产物分离中的应用.中国医药工业杂志,2005,36(12):788-791.
15 Ito Y.Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography.J Chromatogr A,2005, 1065:145-168.
16 Fang L,Liu Y,Zhuang H Y,et al.Combined microwave-assisted extraction and high-speed counter-current chromatography for separation and purification of xanthones from Garcinia mangostana.JChromatogr B,2011,879:3023-3027.
17刘东锋,万冬梅.一种纯化藤黄酮E的方法.CN 102826984A,2012-12-19.
Preparative Isolation and Purification of Garcinolby High-Speed Countercurrent Chromatography
Zhang Baojun1,2,Fang Qingwei1,2,Tan Hongsheng1,2,Zheng Changwu1,2,FuWenwei1,2
(1.SchoolofPharmacy,ShanghaiUniversity ofTraditionalChineseMedicine,Shanghai201203,China; 2.Engineering Research CenterofShanghaiCollegesforTCM New Drug Discovery,Shanghai201203,China)
This study aimed at preparing the chemical reference substance of garcinol.A preparative high-speed countercurrent chromatography(HSCCC)was adopted for the isolation of garcinol from the twigs of Garcinia multiflora Champ,G.esculenta Y.H.Liand the fruitsof G.xanthochymus Hook.f.ex T.Anders.The crude extractswere separated by HSCCC with two phase solvent systems composed of n-hexane-ethyl acetate-95%ethanol-water(8:8:12:4,volume ratio)using the upper stationary phase and the lowermobile phase.Under the conditionsofa flow rate of 2.0 and 4.0mL· min-1,and the apparatus rotation at850 rpm,the column temperature at25℃and the detection wavelength at254 nm,the fraction containing garcinol was purified by the Sephadex LH20 chromatography.The purity test in the extracts wasdetermined by high-performance liquid chromatography.As a result,the contents ofgarcinolwere 45,281 and 4080mg respectively separated from 104.765 g twigs of G.multiflora Champ,105.270 g G.esculenta Y.H.Liand 102.318 g the fruits of G.xanthochymus Hook.f.ex T.with the purity of 98.72%,98.36%and 98.42%.Compared with the sample pretreatments and separation efficiency of the three plants,it was found that the fat-soluble extracts rapidly and efficiently extracted using n-hexane-ethyl acetate-95%ethanol-water(5:5:5:5,volume ratio)contained abundant garcinol taking fruitsof G.xanthochymus Hook.f.ex Tas the rawmaterialwith the combination ofHSCCC and Sephadex LH-20 chromatography.In conclusion,itwas indicated that the combinationmethod is efficientwith high operability and large preparation quantity.
High-speed countercurrent chromatography,Garcinia xanthochymus Hook.f.ex T.Anders,garcinol,preparativemothod
10.11842/wst.2017.02.011
R93
A
(责任编辑:王慧慧,责任译审:朱黎婷)
2017-02-20
修回日期:2017-02-20
*上海中医药大学预算内项目(2016YSN06):菲岛福木果实抗肿瘤活性成分研究,负责人:付文卫;上海中医药大学青年基金项目(81602990):岭南山竹子中活性提取化合物的合成,结构修饰及抗EV71病毒研究,负责人:郑昌武。
**通讯作者:付文卫,副研究员,博士/硕士生导师,主要研究方向:中药活性成分研究。

