倾注法与涂布法对蜂蜜中嗜渗酵母计数的比较分析
苏 华 罗兆飞* 覃艳淑 韦梅良 李 娟
(1.广西出入境检验检疫局检验检疫技术中心南宁530021;2.广西-东盟食品药品安全检验检测中心南宁530021)
倾注法与涂布法对蜂蜜中嗜渗酵母计数的比较分析
苏 华1罗兆飞1*覃艳淑2韦梅良1李 娟1
(1.广西出入境检验检疫局检验检疫技术中心南宁530021;2.广西-东盟食品药品安全检验检测中心南宁530021)
本研究旨在建立准确、可靠、稳定的检测蜂蜜中嗜渗酵母计数的分析方法。分别采用GB 14963-2011中嗜渗酵母计数的涂布方法以及GB 4789.2-2010中菌落总数测定的倾注法,对蜂蜜样品中的嗜渗酵母计数。并通过以上两种不同方式对不同温度下储藏的蜂蜜样品进行比较试验。结果发现同一样品、同一稀释度、同样的培养条件下,使用倾注法测得的嗜渗酵母数量比涂布法更多,差异极显著(P<0.01)。对经不同温度下储藏的蜂蜜样品进行嗜渗酵母计数,各浓度条件下倾注法计数结果比涂布法更多,差异极显著(P<0.01)。
倾注法涂布法嗜渗酵母计数蜂蜜
GB14963-2011《食品安全国家标准蜂蜜》于2011年10月20日开始实施,它代替了GB14963-2003《蜂蜜卫生标准》以及GB18796-2005《蜂蜜》中的对应指标,并且在微生物限量中增加了嗜渗酵母计数限量[1-2]。在蜂蜜水分含量超过20%时,其存在的嗜渗酵母容易大量繁殖起来,造成蜂蜜酸败,同时产生的二氧化碳使得盛装蜂蜜的密闭容器气压过大,有发生容器爆破和蜂蜜外泄的风险[3-4]。因此,新的国家标准增加嗜渗酵母计数限量要求,也是进一步提高蜂蜜产品安全性的需要。
目前,针对嗜渗酵母计数的检测,主要依据GB14963-2011《食品安全国家标准蜂蜜》附录A规定的方法进行。该方法采用的是常规取样稀释后,再进行平板涂布培养,即在每个平板表面接种0.1mL,用无菌L型涂布棒进行涂布,选择菌落数量在15~150个的平板计数菌落数量[1]。样品的最高稀释度只能达到10-2,而GB 14963-2011中嗜渗酵母限量为≤200 CFU/g,一旦在10-2稀释度平板上长出3~14个菌落,检测结果为超标结果,而这些数值恰恰不在标准规定“选择菌落数量在15~150个的平板,计数菌落数量”的要求中,意味着检测过程偏离标准要求,给检测机构的检测及判断评判带来较大的风险,也给监督执法部门的公正执法带来了技术风险。此外,笔者在实际操作过程中,发现该方法有操作繁琐、同稀释度培养计数结果平行性差等问题。因此,迫切需要对蜂蜜中嗜渗酵母的计数方法进行进一步的研究。
本研究拟通过先行常用的菌落计数方法--倾注法与GB14963-2011附录A的涂布法进行比较分析,寻找更加准确、可靠、稳定的检测方法。
1 材料与方法
1.1 材料
1.1.1样品来源购自当地蜂蜜加工企业原料基地。
1.1.2 仪器恒温培养箱、冰箱(2~5℃)、无菌均质袋和均质器、电子天平、无菌试管(18 mm× 180mm)、无菌吸管(1mL,具0.01 mL刻度;10 mL,0.1 mL刻度)、无菌培养皿、无菌L型涂布棒、显微镜(10×~100×)。
1.1.3 培养基和试剂30%葡萄糖溶液(pH 6.5± 0.5)、氯硝胺18%甘油(DG18)琼脂。
1.2 方法
1.2.1 取样以无菌操作在天平上称取固体或液体检样25 g,加入30%葡萄糖稀释液225 g,用拍击式均质袋拍击2min,制备成1∶10均匀稀释液。
1.2.2 梯度稀释用灭菌吸管吸取1∶10稀释液1 mL,注入含有9 mL 30%葡萄糖稀释液的试管内,置于漩涡混悬仪上混匀,制备1∶100稀释液。另取1mL灭菌吸管,按前述操作依次制备10倍递增稀释液,每递增稀释一次,换用1支1 mL灭菌吸管。
1.2.3 涂布法根据对检样污染情况的估计,选择2~3个连续的适宜稀释度,接种0.1 mL稀释液于DG18琼脂平板上,接着用无菌的L型涂布棒进行琼脂表面涂布,接种2个平板。同时在1个DG18琼脂平板表面接种0.1 m L稀释液作为空白对照。
1.2.4 倾注法按照GB 4789.2-2010《菌落总数测定》[5],选择2~3个连续的适宜稀释度,在每个培养皿接种1 mL,将15~20 mL冷却至40℃左右的DG18培养基倾注到无菌培养皿中,并转动平皿使其混合均匀。同时接种1mL稀释液作为空白对照。
1.2.5 培养接种完成后尽快将全部平板置25℃± 1℃恒温箱内避光培养,培养时勿翻转培养皿。为防止出现霉菌过度生长蔓延而掩盖目标菌落,培养48 h后即开始每日观察平板上真菌生长情况。培养7 d结束。
1.2.6 菌落计数选择菌落数量在15~150个的平板,计数菌落数量。如出现霉菌菌落干扰时,不应计数丝状菌落。
2 结果
2.1 涂布法和倾注法进行蜂蜜中嗜渗酵母计数对同一蜂蜜样品分别采用涂布法和倾注法检测嗜渗酵母的数量,选择菌落数在15~150个的平板进行计数,进行3次平行试验。结果显示(见表1),倾注法检出嗜渗酵母的数量要高于涂布法的检出量,差异极显著(P<0.01),具有统计学意义。图1为两种方法检测蜂蜜中嗜渗酵母数量较典型的平板结果。
2.2 不同温度储藏下,蜂蜜中嗜渗酵母数量的变化分别无菌称取25 g蜂蜜样品原料于无菌均质袋中,绑好无菌均质袋口,分别置于4℃、25℃、30℃、37℃、42℃环境下储藏48 h,接着无菌加入225 g 30%葡萄糖溶液,测定蜂蜜中嗜渗酵母的数量。结果见表2、图2-图3,储藏温度在25~37℃时,嗜渗酵母的增殖速度加快,但是≥42℃后,嗜渗酵母的死亡率急剧加快。而相应温度下倾注法的嗜渗酵母计数结果比涂布法更多,4℃、25℃、30℃、37℃、42℃下,涂布法与倾注法间存在极显著差异(P<0.01)。

表1 涂布法和倾注法检测蜂蜜中嗜渗酵母的结果
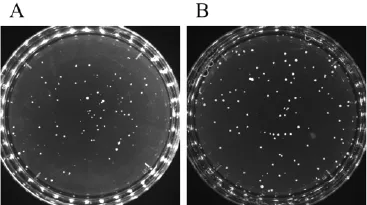
图1 涂布法和倾注法蜂蜜中嗜渗酵母平板结果

表2 不同温度储藏下,涂布法和倾注法蜂蜜中嗜渗酵母检测结果
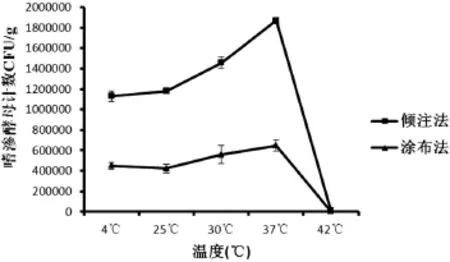
图2 不同温度储藏下,涂布法和倾注法检测蜂蜜中嗜渗酵母数量的变化
3 讨论
本试验通过涂布法和倾注法比较蜂蜜中嗜渗酵母计数结果的差异,得出以下结果。
1)同一样品、同一稀释度、同样的培养条件下,使用倾注法所测得的嗜渗酵母数量比涂布法更多,差异极显著(P<0.01)。
2)涂布法操作过程中,由于每个平板上加入的样品稀释液体积仅为0.1 mL,吸样过程使用标准规定1 mL吸管吸取,容易产生吸量误差;此外,使用涂布棒进行涂布的过程中,涂布棒本身会吸取一定量的样品稀释液,且涂布过程由于涂布棒的不均匀吸附效应,造成实际样品体积小于0.1 m L,且每个平板间存在偏差。上述两步操作后,引起实际能够用于培养的样品稀释液体积产生了较大的偏差,因而造成涂布法计数结果偏低、且同一稀释度的两个平板计数结果较难平行。
3)采用倾注法进行测定的过程,由于使用1 mL吸管吸取1 mL样品稀释液,倾注的体积较涂布法多,且更容易移液准确,操作过程造成的样品稀释液体积偏差较小,因此,检测结果更能够实际反映样品中嗜渗酵母的数量,结果更具有代表性。
4)通过不同温度储藏蜂蜜样品的比较试验发现,蜂蜜在不同温度储藏下,储藏温度在25~37℃时,嗜渗酵母的增殖速度加快,但是≥42℃后,嗜渗酵母的存活率急剧下降,大部分嗜渗酵母不能长时间耐受超过42℃的温度,这也许是当时制定国标方法考虑使用涂布法的原因,是为了防止倾注的培养基会杀灭样品中的嗜渗酵母。而本试验研究结果表明,在使用倾注法操作过程中,培养基温度虽然在45℃左右,但属于短时间的高温作用于样品,且对嗜渗酵母的杀灭作用还受到其本身对温度的耐受能力、蜂蜜中的水分和糖类等导热介质的影响,未产生对嗜渗酵母的杀灭作用。对经不同温度下储藏的蜂蜜样品进行嗜渗酵母计数,各浓度条件下倾注法计数结果比涂布法更多,也更稳定可靠。
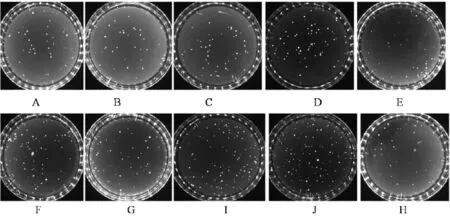
图3 不同温度储藏下,涂布法和倾注法蜂蜜中嗜渗酵母平板结果
综上所述,蜂蜜中嗜渗酵母计数方法的比较结果表明,倾注法比涂布法更加准确、稳定、可靠,更能确保公正地执行GB14963-2011《食品安全国家标准蜂蜜》的限量要求,最大可能减少监督执法检测过程中对企业产品质量的误判,同时建议对该标准附录A的方法进行修订,以保护各相关方的利益。
[1]中华人民共和国卫生部.GB14963-2011食品安全国家标准-蜂蜜[S].北京:中国标准出版社,2011.
[2]张敬惠.对新的食品安全国家标准-蜂蜜GB14963-2011的解读[J].蜜蜂杂志,2012(3):36.
[3]魏颖.蜂蜜国家标准探讨[J].食品与发酵工业,2015,41(1): 235-239.
[4]尤守智,蒋波.蜂蜜结晶与发酵问题解析[J].中国蜂业, 2008,59(3):30.
[5]中华人民共和国卫生部.GB4789.2-2010食品安全国家标准食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2011:2.
Com parative analysis of the osmophilic yeast counting in honey by pouring method and coatingmethod
Su Hua1Luo Zhaofei1*Qin Yanshu2WeiMeiliang1Li Juan1
(1.Guangxi entry-exit inspection and quarantine inspection and quarantine technology center,Nanning 530021; 2.Guangxi-ASEAN food and drug safety inspection and testing center,Nanning 530021)
The aim of this study was to establish an accurate,reliable and stablemethod for the detection of osmophilic yeast in honey. The coatingmethod(GB 14963-2011)and the pouringmethod(GB 4789.2-2010)were used to detect the osmophilic yeast in honey. And using the two kind ofmethods to detect and analyze the osmophilic yeast in honey samples thatwere stored at different temperatures.The results showed that,for the same dilution ratio of the same sample,the number of osmophilic yeast in honey detected by pouringmethod was higher than that detected by coatingmethod in the same culture conditions,the difference was significant(P<0.01).For the honey samples which were stored under different temperatures,the number of osmophilic yeast in honey detected by pouringmethod was higher than that detected by coatingmethod in the same dilution ratio,and the differencewas significant(P<0.01).
Pourmethod Coatingmethod Osmophilic yeast Honey
A
1003-4331(2017)02-0009-04
广西壮族自治区食品药品监督管理局项目资助(食品检验复检路径的设计与应用)。
苏华(1991-),女,硕士,助理工程师,主要从事微生物检验工作。E-mail:1932196279@qq.com。
*通信作者:罗兆飞(1979-),男,硕士,高级兽医师,主要从事食品检验工作。E-mail:975558@qq.com。

