中药注射剂安全性医院集中监测研究的统计分析相关问题及对策*
翟静波,张俊华**,阎小妍,王 辉,刘春香,郑文科,刘 智
(1. 天津中医药大学循证医学中心 天津 300193;2. 北京大学临床研究所 北京 100191)
中药注射剂安全性医院集中监测研究的统计分析相关问题及对策*
翟静波1,张俊华1**,阎小妍2,王 辉1,刘春香1,郑文科1,刘 智1
(1. 天津中医药大学循证医学中心 天津 300193;2. 北京大学临床研究所 北京 100191)
安全性医院集中监测研究是评价中药注射剂临床用药安全性的重要研究方法。合理的统计分析是保证研究质量的重要环节之一。目前,学术界尚无公认的中药注射剂安全性医院集中监测研究相关的统计分析指导原则或指南发布。这可能导致很多中药注射剂安全性医院集中监测研究因为统计分析方法使用不当而降低研究质量。为此,本文在分析既往相关研究的基础上,结合实际经验和体会,探讨中药注射剂医院集中监测研究中统计分析的相关问题以及对策,为相关研究的开展提供方法学参考。
中药注射剂 安全性 医院集中监测 统计分析
中药注射剂在感染、肿瘤、中风、心血管等危急重症的防治中发挥着重要作用,临床应用广泛,也造就了一批年销售额过亿元的大品种[1-3]。然而,随着临床用量的增加,其不良事件和不良反应的数量也大大增加。中药注射剂的安全性问题已成为管理部门、临床医生、生产企业、科研人员和公众关注的焦点。
中药注射剂安全性医院集中监测研究广泛用于评价中药注射剂临床用药的安全性。由于样本量较大、研究目的不同等,其统计分析过程与新药临床研究有一定区别。目前,尚无公认的与中药注射剂安全性医院集中监测研究相关的统计分析指导原则或指南发布。这可能导致很多中药注射剂安全性医院集中监测研究因为统计分析方法使用不当而导致研究质量的降低。
为此,本文在分析既往相关研究的基础上,结合相关研究经验和体会,探讨中药注射剂医院集中监测研究中统计分析的相关问题以及解决方法,为相关研究的开展提供参考。
1 中药注射剂安全性医院集中监测研究的数据特点
了解数据特点是进行统计分析的前提。与具有严格纳入、排除标准的新药临床试验研究数据相比,安全性集中监测研究数据来源于医院的真实诊疗环境,两者存在一定差异。为了清晰认识医院集中监测研究的数据特点,我们对比分析了上述两种研究的数据特点。从表1可知,中药注射剂医院集中监测研究的样本量更大,患者特征、病史、症状、合并用药等更加复杂,也对统计分析提出了一定的挑战。
2 统计分析问题及对策
2.1 制定统计分析计划的相关问题及处理方法
制定统计分析计划有利于明确分析内容、规范分析流程。目前,临床试验领域已经发布了《药物临床试验数据管理与统计分析的计划和报告指导原则》*http://www.sda.gov.cn/WS01/CL0087/160962.html。但是,尚无中药注射剂安全性医院集中监测研究相关的统计分析计划指导原则公布。
根据临床试验统计分析计划的制定原则结合既往经验,我们将中药注射剂安全性医院集中监测研究的统计分析计划分为研究概述、统计分析、图表模版3个部分。研究概述部分包括研究目的、设计类型、研究对象、病例来源、评价指标、样本量等内容。统计分析部分包括安全性分析数据集定义、缺失值和离群值的处理方法、描述性统计方法、不良事件/反应分析方法、检验水准、敏感性分析等部分。图表模版是统计分析结果的表格形式。我们建议在研究设计阶段就制定统计分析计划。在研究过程中允许修改并做好修改记录。在正式统计分析之前完成终稿,以便统计人员根据既定目的开展统计分析。
2.2 缺失值问题及处理方法
集中监测研究纳入的样本量较大,缺失值的产生不可避免。例如:年龄、性别、给药剂量、药品批号等信息的缺失。缺失值产生的原因多样,例如:研究者漏填、患者失访、未做相关检查等。由于缺失值可能发生在开始研究的多个阶段,所以,研究者在方案设计阶段就需要全面考虑缺失值问题及对应的处理方法。
在研究设计阶段,研究者需要仔细考虑拟收集与待研究中药注射剂安全性有关的信息,并合理设置于信息采集表中。明确信息采集表中信息的收集方式以及出现缺失值的处理方法。如有可能,将这些信息记录于研究者手册中,便于信息收集者及时翻阅查看。
在数据管理阶段,数据管理员需要根据方案制定数据管理计划,对缺失数据的处理形成标准化的操作流程。对于不允许缺失的内容,数据管理员需要及时反馈给研究者补充完善。对于允许缺失的内容,数据管理员需要制定合理的填充符号,以便于识别缺失信息。在完成数据管理工作之后,数据管理员需要将缺失数据的变量名、清单等信息整理归档,方便统计人员查阅。
在统计分析阶段,统计人员需要对缺失数据进行预评估,了解缺失数据的组间差异、缺失特点等。有助于判断缺失数据对后续分析可能造成的影响和选择合适的处理方法。缺失值的处理有多种方法,例如:剔除缺失值分析、简单填补方法、多重填补法、敏感性分析等[4]。虽然直接剔除缺失值是最常使用的处理缺失值的方法。但是,如果缺失代表了某些安全性信息,可能造成结果估计的偏倚。即使填补缺失值,也只是对真实情况的近似估计,存在估计偏倚的可能性。所以,我们建议在填补缺失值的同时,采用敏感性分析方法评估数据填补对研究结果的影响。当不同填补方法的结果一致性较高时,结果的可信度较高。当一致性较低时,研究者需要慎重解释数据缺失对结果的影响。
2.3 异常值问题及处理方法
异常值是指一组数据中明显背离总体观测值的个别数值。中药注射剂安全性医院集中监测研究属于真实世界研究,人群特征复杂,干预措施多样,不可避免会出现大量异常值。这些异常值往往提示安全性信息,不可直接剔除异常值。
在数据管理阶段,数据管理员需要密切关注异常值的问题,并设定正常范围,例如:当测量值超出均数±2或3倍标准差时,将被怀疑为异常值。当数据超出正常范围时,反馈给研究者,确认异常原因是录入错误还是确实异常。如果是录入错误需及时修正,如果确实属于异常值,数据管理员需要做好记录,以便统计人员分析使用。
异常值的产生可能通过改变数据分布而影响统计分析方法的选择和结果的正确性;因此,识别异常值也是统计分析的重要内容。在统计分析阶段,统计人员在正式分析之前,可以采用散点图、残差图、格拉布斯(Grubbs)检验法、t检验法等方法识别可能存在的异常值[5]。异常值可能属于同一总体的极端现象,也可能是某些原因引起的偏离总体的数值。因此,当统计方法识别出异常值时,需要反馈给研究者,结合专业知识决定处理异常值的最佳方法**http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm073137.pdf。
2.4 不良事件/反应发生率的分析问题及处理方法
中药注射剂安全性医院集中监测研究的重要目的之一是获得待研究中药注射剂在真实世界情况下不良事件和不良反应的发生率。尽管不良反应是从不良事件中进一步识别获得,但是不良事件和不良反应的统计分析内容仍有所不同。
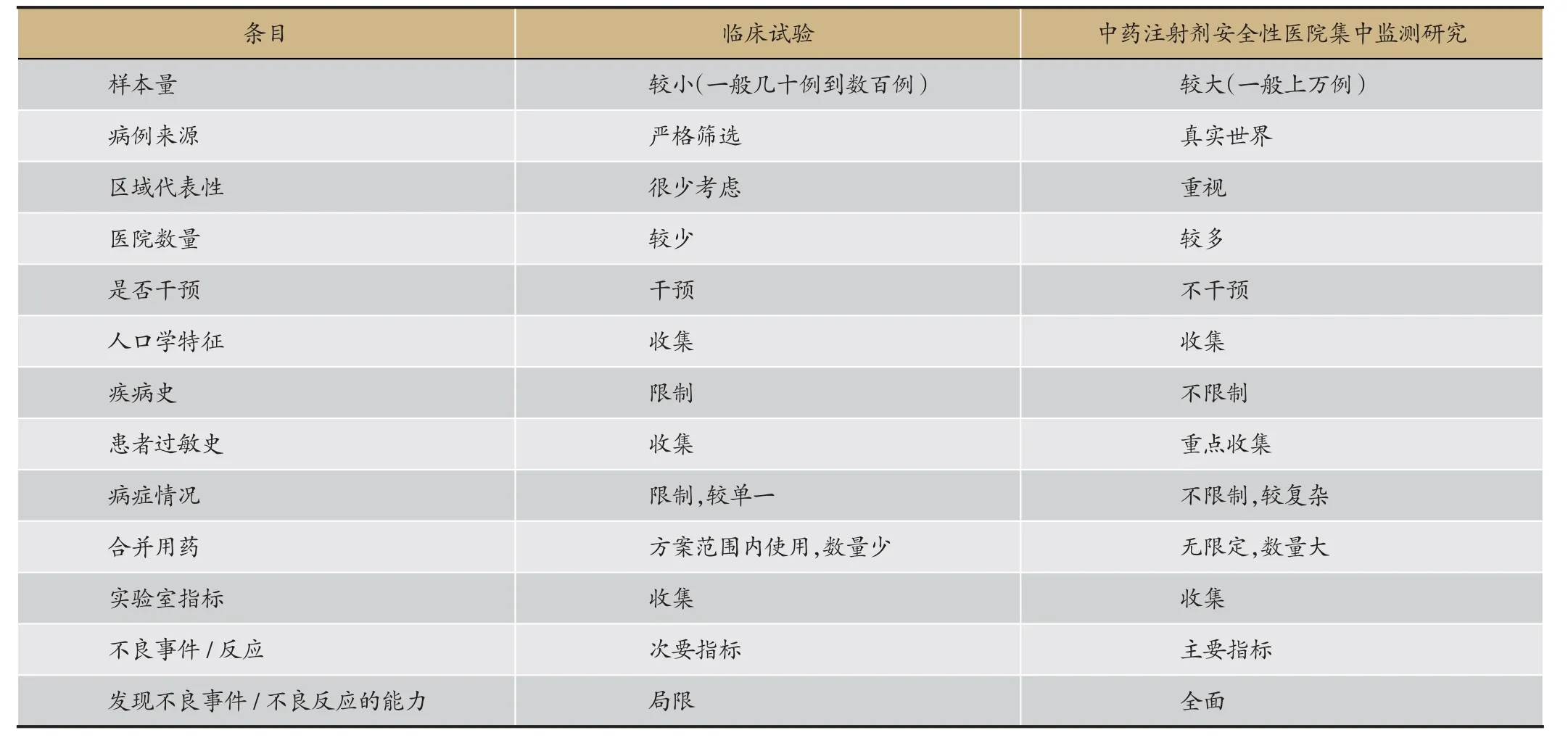
表1 中药安全性医院集中监测研究与新药临床试验数据特点比较
对于不良事件而言,需要区分重要不良事件和严重不良事件,计算不良事件发生率,并分析与研究药物的关系、临床使用的关系、疾病的关系、合并用药的关系、患者的差异等。对于不良反应而言,通常需要区分常见、少见、罕见、极罕见、新发、严重不良反应,分析不良反应与人群的关系,不良反应的预后等[6]。
不良事件/反应的发生通常为小概率事件,统计描述方法通常采用发生率和对应的95%可信区间。不良事件/反应的发生率通常采用发生不良事件/反应的总例数除以纳入观察人群总例数获得。可信区间反映的是总体率估计的精确性,有助于研究者了解不良事件/反应发生率的范围。正态近似法最常用于计算95%可信区间。此外,还可采用Wald连续校正法、Wilson计分法等计算[7]。但是,很多中药注射剂安全性医院集中监测研究仅仅报道观察人数和发生例数,或者仅给出发生率而无对应的95%可信区间,并不符合统计分析的原则[8,9]。
此外,仅仅报告总体AE或ADR发生率,而不进一步分析事件类型和严重程度,不利于全面认识中药注射剂的安全性。因此,对于发生率的报告,我们建议按照不良事件/反应的类型分别报告,也可参照《药物临床试验数据管理与统计分析的计划和报告指导原则》内容进行分类分析。
2.5 危险因素的分析问题及处理方法
识别用药危险因素也是中药注射剂安全性医院集中监测研究的重要目的之一。在方案设计阶段,研究者就应当充分考虑可能影响用药安全性的因素,并纳入信息采集表中。在数据管理阶段,数据管理员需要对这些因素进行标准化,以方便录入和后期统计分析。
当危险因素是定量资料且服从或近似服从正态分布时,可以采用t检验比较发生与未发生不良事件/反应人群相关危险因素的差异。如有需要,可以将其它影响因素作为协变量纳入方差分析模型,以控制这些因素对结果的影响。是否将协变量纳入模型,需要在统计分析计划中声明。如果不服从正态分布,则可以考虑非参数检验方法。
Logistic回归模型常用于危险因素分析,而且适用于因变量服从二项分布的情况。中药注射剂安全性医院集中监测研究的样本量估算常常假设不良事件/反应的发生服从二项分布。因此,Logistic回归模型适合用于不良事件/反应发生的危险因素分析[10]。如果假设不良事件/反应服从负二项分布或poisson分布,则需要采用负二项回归或poisson回归模型[11]。
中药注射剂安全性医院集中监测研究属于前瞻性研究,可以获取从开始用药到发生不良事件/反应的时间。当研究目的需要同时考虑不良事件/反应是否发生以及发生所需时间时,Logistic回归模型无法实现此类模型的拟合。此时,应当采用Cox回归模型(比例风险模型)。
此外,不良事件/反应的发生率较低,可能造成“异常多零”数据的存在,称为零膨胀现象。此时,采用poisson回归或负二项回归模型可能导致拟合不良的问题[12]。统计人员可以采用Hurdle模型和零膨胀模型处理此类问题[13]。
2.6 合并用药的分析问题及处理方法
集中监测研究的合并用药信息是在真实临床实践环境下收集的。通过分析这些患者的合并用药情况,能够更全面地了解临床实践中哪种或哪类药物与中药注射剂合并使用以及是否增加安全性风险。这些分析结果对指导临床合理使用中药注射剂具有重要指导价值。
由于集中监测研究样本量大、不限制合并用药的使用等,导致合并用药数据量巨大。此类数据的录入方式一般为半开放式结构,需要在数据管理阶段将文本数据清理成为标准化数据,划分层级,以利于统计分析[14]。我们建议采用数据挖掘中的关联规则算法分析不良事件/反应与合并用药的关系[15-17]。
3 小结
中药注射剂安全性医院集中监测研究是近些年使用较多的研究类型,这种研究类型的统计分析方法也需要不断完善,以保证研究的质量和数据价值[18]。集中监测研究数据具有信息量大、缺失值/异常值多、安全性信息丰富等特点,特别是要分析发生不良事件/反应与多种因素的相关性,使统计分析工作量大幅度增加,需要更加规范的流程和方法。
在研究实施之前,制定统计分析计划是必要步骤,需要充分考虑数据可能存在的缺失值、异常值等问题及处理方法,将可能涉及的风险因素以及相互关系进行事先界定。数据统计分析中可能遇到的问题,尽量在分析计划中事先考虑。如果遇到特殊情况,需要临床专家、统计学专家等共同讨论,以保证数据分析的规范性与研究需求相统一,提高研究结果可靠性和实用价值。
值得注意的是,真实、全面的数据采集是获得科学、准确统计分析结果的重要前提。在开展中药注射剂安全性医院集中监测研究时,研究者可以参考《临床试验数据管理工作技术指南》、《临床试验的电子数据采集技术指导原则》等临床研究数据管理文件制定相应的数据管理计划并严格执行,确保数据的真实、可靠。
总之,本文从统计学角度,探讨了中药注射剂安全性医院集中监测研究的统计分析过程可能遇到的问题及对策,以期为同类研究的开展提供方法学借鉴。
1 尹兰英,郝玉苓,王岑,等.生脉注射液对心脏瓣膜置换术丙泊酚全麻患者的心肌保护作用.中医杂志,2016,57(8):686-689.
2 吕涛.丹红注射液治疗不稳定性心绞痛的疗效观察.辽宁中医杂志,2016,43(7):1438.
3 刘浩.中药注射剂调控肿瘤血管生成信号传导通路的机制研究.北京:中国中医研究院博士学位论文,2002:8-9.
4 胡运涛,曹袁媛,章诗琪,等.生存质量资料中缺失值的内在机制及处理措施.中国卫生统计,2008,25(6):661-667.
5 王文周. T检验法优于格拉布斯检验法.信阳师范学院学报(自然科学版),2000,13(4):397-399.
6 黎元元,雷蕾,谢雁鸣.31 724例灯盏细辛注射液安全性医院集中监测研究.中国中药杂志,2015,40(24):4757-4761.
7 成琪.临床试验配对二项资料两组率差和率比可信区间估计研究.广州:南方医科大学硕士学位论文,2012:5-6.
8 李学林,唐进法,孟菲,等.10 409例丹红注射液上市后安全性医院集中监测研究.中国中药杂志,2011,36(20):2783-2785.
9 于倩,赵阿娜,付秀娟.多中心非干预前瞻性开放的3 000例苦碟子注射液应用情况及不良反应集中监测.中国药物应用与监测,2015,12(3):167-170.
10 温泽淮,庾慧,伍耀衡,等.中药注射剂不良反应监测的初步报告.中药新药与临床药理,2003,14(4):278-281.
11 李婵娟,夏结来,姚晨,等.负二项回归在新药安全性评价中的应用.第四军医大学学报,2004,25(24):2215-2218.
12 翟静波,郑文科,雷翔,等.零膨胀模型在药品安全性计数资料分析中的应用.中国中医药现代远程教育,2013,11(21):164-165.
13 原静,刘桂芬,薛玉强.零膨胀计数资料模型选择与比较.中国卫生统计,2011,28(4):354-360.
14 杨伟,王连心,谢雁鸣,等.10 029例感染性疾病患者常用中药注射剂安全性医院集中监测分析.中医杂志,2014,55(8):666-669.
15 黎元元,程豪,唐浩,等.参芪扶正注射液辅助治疗肺癌合并用药的真实世界研究.中医杂志,2014,55(12):1063-1065.
16 黄雯静,杨薇,姜俊杰,等.基于59 287例真实世界数据的疏血通注射液临床用药特征分析.中药新药与临床药理,2015,26(4):561-565.
17 杜婧,杨薇,易丹辉,等.基于HIS“真实世界”的丹红注射液治疗冠心病患者合并用药分析.中国中药杂志,2011,36(20):2821-2824.
18 李林贵.国内外医院药品不良反应监测研究进展.中国农村卫生事业管理,2010,30(5):333-335.
Problems and Solutions of Statistical Analysis for Hospital Centralized Safety Monitoring of Traditional Chinese Medical (TCM) Injections
Zhai Jingbo1, Zhang Junhua1, Yan Xiaoyan2, Wang Hui1, Liu Chunxiang1, Zheng Wenke1, Liu Zhi1
(1. Evidence-Based Medicine Center, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China; 2. Peking University Clinical Research Institute, Beijing 100191, China)
Safety hospital centralized monitoring is one of the important methods for evaluating the medication safety of TCM injections in clinic. It is critical to warrant research quality by reasonable statistical analysis. However, universally accepted standards and guidelines for the statistical analysis of hospital centralized monitoring of TCM injections have not been issued so far, which would probably reduce the research quality of safety hospital centralized monitoring of TCM injections since the unreasonable use of statistical analysis methods. Combined with previous practical experience and understanding, we put forward the problems of statistical analysis of hospital centralized monitoring of TCM injections with the provision of some advice in this paper based on the analysis of the preceding studies, laying a foundation for the same kind of researches.
Traditinoal Chinese medical injections, safety, hospital centralized monitoring, statistical analysis
10.11842/wst.2017.01.025
R288
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-12-16
修回日期:2017-01-05
* 国家自然科学基金委青年科学基金项目(81303093):体现个体动态信息综合价值的中医药防治肿瘤辅助疗效评价方法,负责人:翟静波;教育部新世纪优秀人才项目(NCET-13-0936),负责人:张俊华。
** 通讯作者:张俊华,副研究员,博士生导师,主要研究方向:中医药临床循证评价方法学。

