高乌甲素缩醛类化合物的合成及抗肿瘤活性研究
杨文艳, 冯国忠*, 梁承远, 裴少萌, 宋慧慧, 鞠伟会,冯壮壮
(1.中国药科大学 国际医药商学院, 江苏 南京 211198; 2.陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
高乌甲素缩醛类化合物的合成及抗肿瘤活性研究
杨文艳1, 冯国忠1*, 梁承远2, 裴少萌2, 宋慧慧2, 鞠伟会2,冯壮壮2
(1.中国药科大学 国际医药商学院, 江苏 南京 211198; 2.陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
为寻找抗肿瘤活性好且毒性小的天然产物先导化合物,以高乌甲素与芳香醛杂合化合物为原料,合成了一系列未见文献报道的高乌甲素缩醛类化合物.通过1H NMR、13C NMR与HRMS对合成的化合物进行了结构表征,并用MTT法测定了所合成高乌甲素缩醛类化合物对人肝癌细胞(HepG2),人肺癌细胞(A-549)及人结肠癌细胞(HCT-8)的细胞毒性.结果显示合成的化合物对不同的肿瘤细胞株表现出不同程度的抑制作用,为高乌甲素的衍生化开发利用提供理论依据.
高乌甲素; 芳香醛杂合化合物; 缩醛化合物; 抗肿瘤; 药物合成
0 引言
高乌甲素是毛茛科植物高乌头的主要有效成分,是我国首创的非成瘾性镇痛药,具有多种生物活性[1-11],有较高的药用开发价值.高乌甲素结构中具有羟基、酯基、酰胺基等多个活性位点[12],易于引入取代基进行结构修饰,通过衍生化可获得结构新颖且活性更好的高乌甲素衍生物.
高乌甲素是单酯型生物碱,本身具有毒性,而产生毒性的一个主要原因是8位[13]的羟基容易酯化.据报道,有研究对高乌甲素的C-18、C-14、氮原子[14]、C-4位及C-4位苯环上的氢原子[15]进行衍生化.我们发现,高乌甲素C-8、C-9位[16]的邻二羟基能与醛类衍生物的羰基缩合生成螺环结构,根据相关报道,已经证实芳香醛类衍生物,无毒性,具有较好的抗肿瘤活性,该抗肿瘤活性可能与芳香醛类小分子方向化合物有关.
本文尝试对高乌甲素C-8、C-9位进行修饰,利用高乌甲素与芳香醛类化合物反应合成高乌甲素缩醛类化合物,并对其抗肿瘤活性进行初步测试.
1 材料和方法
1.1 仪器与试剂
实验中主要使用的试剂及仪器分别如表1和表2所示.
表1 仪器列表

表2 试剂列表
高乌甲素(Sigma-Aldrich),NMR由Bruker公司的核磁共振仪(ADVANCEⅢ-400 MHZ)测定,HRMS由Bruker公司的质谱仪(MicrOTOF-QⅡ)测定.所用试剂均为分析纯,使用前未经进一步纯化.人肝癌细胞株,人肺癌细胞株,人结肠癌细胞株由广东医科大学提供.
1.2 实验方法
1.2.1 高乌甲素缩醛类化合物的合成
(1)于100 mL圆底烧瓶中,按芳香醛类化合物与原甲酸三甲酯摩尔比1∶2的比例投料,甲苯作为溶剂,室温磁力搅拌,在酸性条件下进行反应,用薄层色谱判断是否有新的产物生成以及追踪反应进度.
(2)按高乌甲素与芳香醛类化合物摩尔比为1∶1.2的比例向反应器中投入高乌甲素,加50 mL溶剂,置于磁力搅拌器上搅拌,保持酸性环境,加热在回流条件下进行反应,TLC追踪实验进度,反应完全后将溶剂减压蒸出.
(3)经柱层析进行分离提纯,得目标产物,称重并计算收率.合成路线如图1所示.
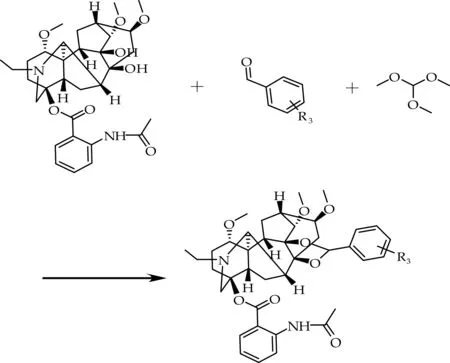
图1 高乌甲素缩醛类化合物的合成路线
1.2.2 高乌甲素缩醛类化合物的结构鉴定
取适量高乌甲素缩醛类化合物溶于氘代DMSO中,通过核磁共振氢谱(1H-NMR)、碳谱(13C-NMR)与质谱(HRMS)进行结构表征.
1.3 高乌甲素缩醛类化合物的抗肿瘤活性测定
对合成的化合物用MTT法进行肿瘤细胞增殖抑制试验.细胞株选用:人肝癌细胞(HepG2),人肺癌细胞(A-549),人结肠癌细胞(HCT-8),培养液为DMEM+15%NBS+双抗.
1.3.1 主要溶液的配制
(1)MTT贮存液:将1 mg的MTT粉溶于1 mL D-hanks液中,使终浓度为1 mg/ml,现配现用.
(2)DMEM培养基处理:DMEM培养基10.4 g溶于1 000 mL超纯水中,加NaHCO33.7 g,Hepes 2.385 g,青霉素,链霉素各10万Units,用CO2气调pH为7.2,过滤除菌,4 ℃冰箱保存,临用时加血清调浓度至10%.
(3)MEM培养基处理:MEM培养基10.4 g溶于1 000 mL 蒸馏水中,加NaHCO32.2 g,Heps 4.8 g,青霉素,链霉素各10万Units,用CO2气调pH为7.2,过滤除菌,4 ℃冰箱保存,临用时加血清调浓度至10%.
(4)结晶紫:用2.5%的多聚甲醛溶液溶解结晶紫,浓度为0.5%.
(5)样品液:用DMSO(Merck)溶解后,加入PBS(-)配成的100μmol/L的溶液或者均匀的混悬液,然后用DMSO的PBS(-)稀释,最终浓度分别为0.1,1,10,20,40,60,80,100μmol/L.
(6)对照液:将高乌甲素和上市的抗肿瘤药物5-氟脲嘧啶以同样的条件配成对照品溶液.
1.3.2 细胞培养
贴壁生长肿瘤细胞细胞培养于含10% 灭活新生牛血清和青霉素、链霉素(各100万U/L)的1640培养液中,置于37 ℃,5% CO2,饱和湿度的二氧化碳培养箱中培养.细胞贴壁生长,每2~3 d传代1次,传代时首先倒出培养液,PBS洗2次,胰酶消化后,加入新鲜的培养液吹打均匀,调整细胞至适当浓度移入新的培养瓶中,添加培养液至适量.取对数生长期细胞用于实验.
1.3.3 测试方法
取对数生长期细胞,消化、计数,以2×104/mL 的密度接种于 96 孔培养板中,每孔100μL.培养 24 h后,将待测化合物以2,4,8,16,32,64μmol/L浓度处理细胞.实验组每个浓度设5个复孔,以含0.4% DMSO的培养液作对照.药物作用48 h后,去上清,每孔加入100μL MTT(2-(4,5-二甲基-2-噻唑基)-3,5-二苯基-2H-四唑氢溴酸盐)(1 mg/mL),继续培养 4 h,弃上清,每孔加入100μL DMSO,振荡混匀,用酶标仪在570 nm处测定吸光度值.计算抑制率,公式:抑制率=(1-给药组吸光度值)/对照组吸光度值×100%.
1.4 统计学方法
将所得数据用SPSS 20统计学软件进行录入、分析、处理,计量资料用(x±s)表示,两组间的计数资料比较进行t检验,以P<0.05 为差异具有统计学意义.
2 结果与讨论
2.1 高乌甲素缩醛类化合物的合成
本课题按照上述实验步骤,合成了8个高乌甲素缩醛类化合物,产率在60.2 %~73.4%.
2.2 高乌甲素缩醛类化合物的结构及表征
2.2.1 化合物(1)
名称:(2R,3S,3aS,6aS,7R,7aR,10S,13S,13aR,13bS,14S,17S )-8-ethyl-5- ( 4- hydroxyphen yl ) -3,13,17- trimethoxy -13b,14-dimethyldodecah ydro -10,13a,7-( epiethane [1,1,2] triyl )-2,6a-ethano [1,3] dioxolo [4′,5′:7,7a] indeno [5,4-b] azocin -10-yl 2-acetamidobenzoate.
化合物(1)的结构如图2所示.
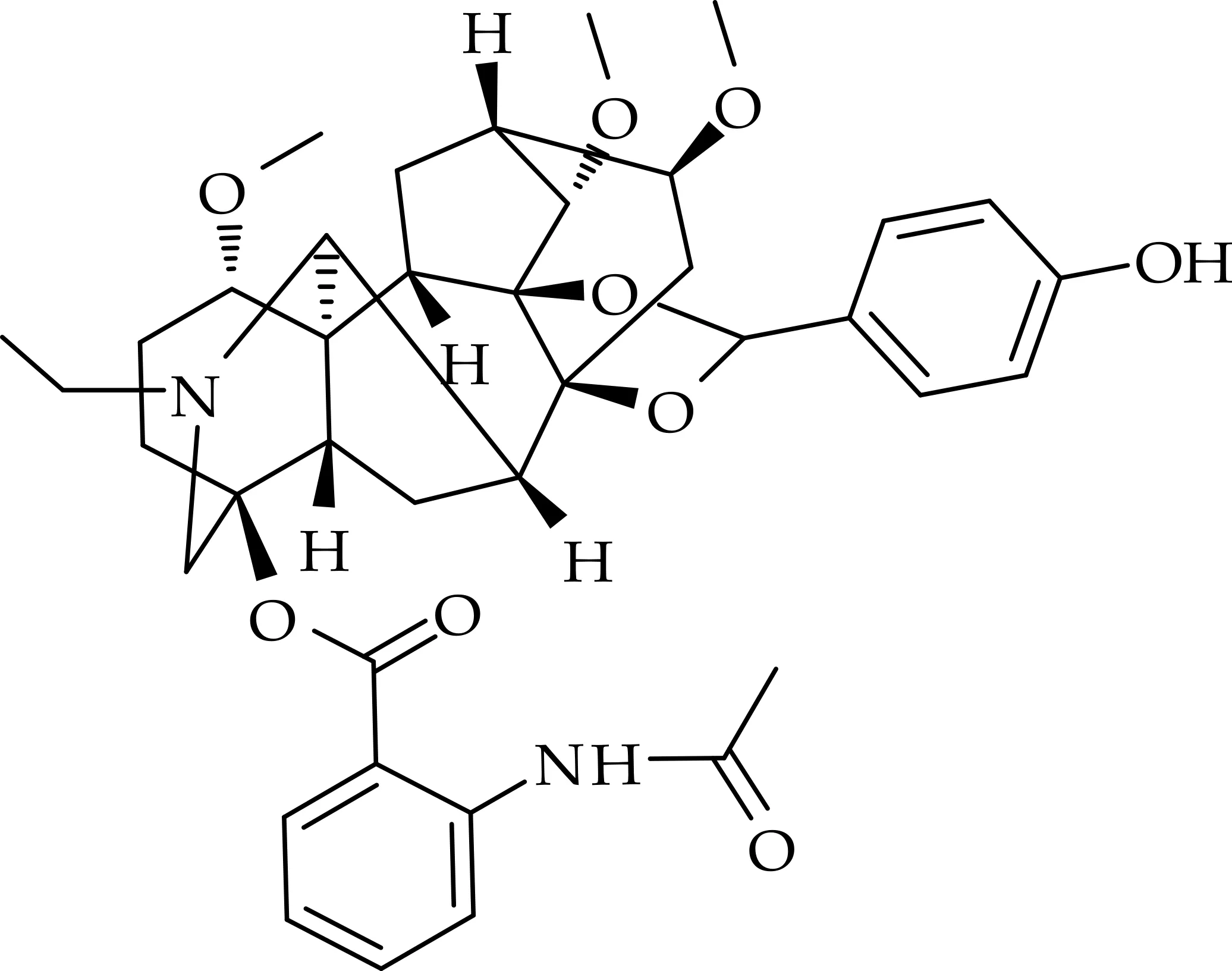
图2 化合物(1)的化学结构
白色无定粉末,产率为68.4%,M.P.232~234 ℃.1H NMR (400 MHz,DMSO- d6)δ(ppm):10.71 (1 H,s),8.27(1 H,d,J=8.6 Hz),7.85(1 H,d,J=8.0 Hz),7.76(2 H,d,J=8.8 Hz),7.57(1 H,t,J=7.9 Hz),7.17(1 H,t,J=7.7 Hz),6.92(2 H,d,J=7.8 Hz),5.83(1 H,s),5.25(1 H,s),3.41(1 H,d,J=11.3 Hz),3.38(6 H,s),3.26(3 H,s),3.18(8 H,m),2.89(1 H,s),2.68(2 H,q),2.34(1 H,d,J=10.8 Hz),2.26(2 H,t,J=7.9 Hz),2.12(3 H,s),2.05(2 H,dd,J=15.0,6.5),1.91(3 H,m),1.39(2 H,q),1.03(3 H,t,J=7.2 Hz).13C NMR(100 MHz,DMSO-d6)δ(ppm):168.11,165.89,163.29,156.37,154.61,139.94,133.64,132.35,132.07,130.60,130.14,129.48,128.38,122.53,115.80,89.32,84.08,82.66,78.13,73.50,57.04,55.87,55.36,50.56,48.18,42.46,35.24,31.47,26.02,25.63,24.14,13.25.HRMS(ESI) calcd.for C39H48N2O9[M+H]+:689.336 0,found:689.339 3.
2.2.2 化合物(2)
名称:(2R,3S,3aS,6aS,7R,7aR,10S,13S,13aR,13bS,14S,17S)-8-ethyl-5-(3-hydroxyphenyl)-3,13,17-trimethoxy-13b,14-dimethyldodecahydro-10,13a,7-(epiethane[1,1,2]triyl)-2,6a-ethano[1,3]dioxolo[4′,5′:7,7a]indeno[5,4-b]azocin-10-yl-2-acetamidobenzoate.
化合物(2)的结构如图3所示.

图3 化合物(2)的化学结构
淡黄色无定型粉末,产率为70.3%.M.P.218 ~220 ℃.1H NMR(400 MHz,DMSO-d6)δ(ppm):10.50(1 H,s),8.27(1 H,d,J=8.3 Hz),7.85(1 H,d,J=8.0 Hz),7.58(1 H,dd,J=6.8,6.8 Hz),7.42(1 H,t,J=7.7 Hz),7.36(1 H,d,J=7.5 Hz),7.25(1 H,m),7.17(1 H,t,J=10.2 Hz),7.10(1 H,d,J=7.9 Hz),5.81(1 H,s),5.36(1 H,s),3.41(1 H,d,J=11.3 Hz),3.35(3 H,s),3.27(6 H,s),3.18(8 H,m),2.89(1 H,s),2.68(2 H,q),2.35(1 H,d,J=10.8 Hz),2.25(3 H,m),2.12(3 H,s),1.91(4 H,m),1.39(2 H,q),1.03(3 H,t,J=7.1 Hz).13C NMR(100 MHz,DMSO-d6)δ(ppm):168.40,165.90,157.95,139.96,137.61,133.94,130.27,122.85,121.76,121.03,117.83,114.61,89.22,84.33,83.94,83.67,83.42,82.83,82.37,78.13,73.40,60.19,57.04,55.87,55.36,55.20,50.69,50.56,48.14,42.46,37.05,35.24,31.11,25.94,24.72,23.51,13.25.HRMS(ESI) calcd.for C39H48N2O9[M+H]+:689.336 0,found:689.339 3.
2.2.3 化合物(3)
名称:(2R,3S,3aS,6aS,7R,7aR,10S,13S,13aR,13bS,14S,17S)-8-ethyl-3,13,17-trimethoxy-13b,14-dimethyl-5-(4-nitrophenyl)dodecahydro-10,13a,7-(epiethane[1,1,2]triyl)-2,6a-ethano[1,3]dioxolo[4′,5′:7,7a]indeno[5,4-b]azocin-10-yl-2-acetamidobenzoate.
化合物(3)的结构如图4所示.
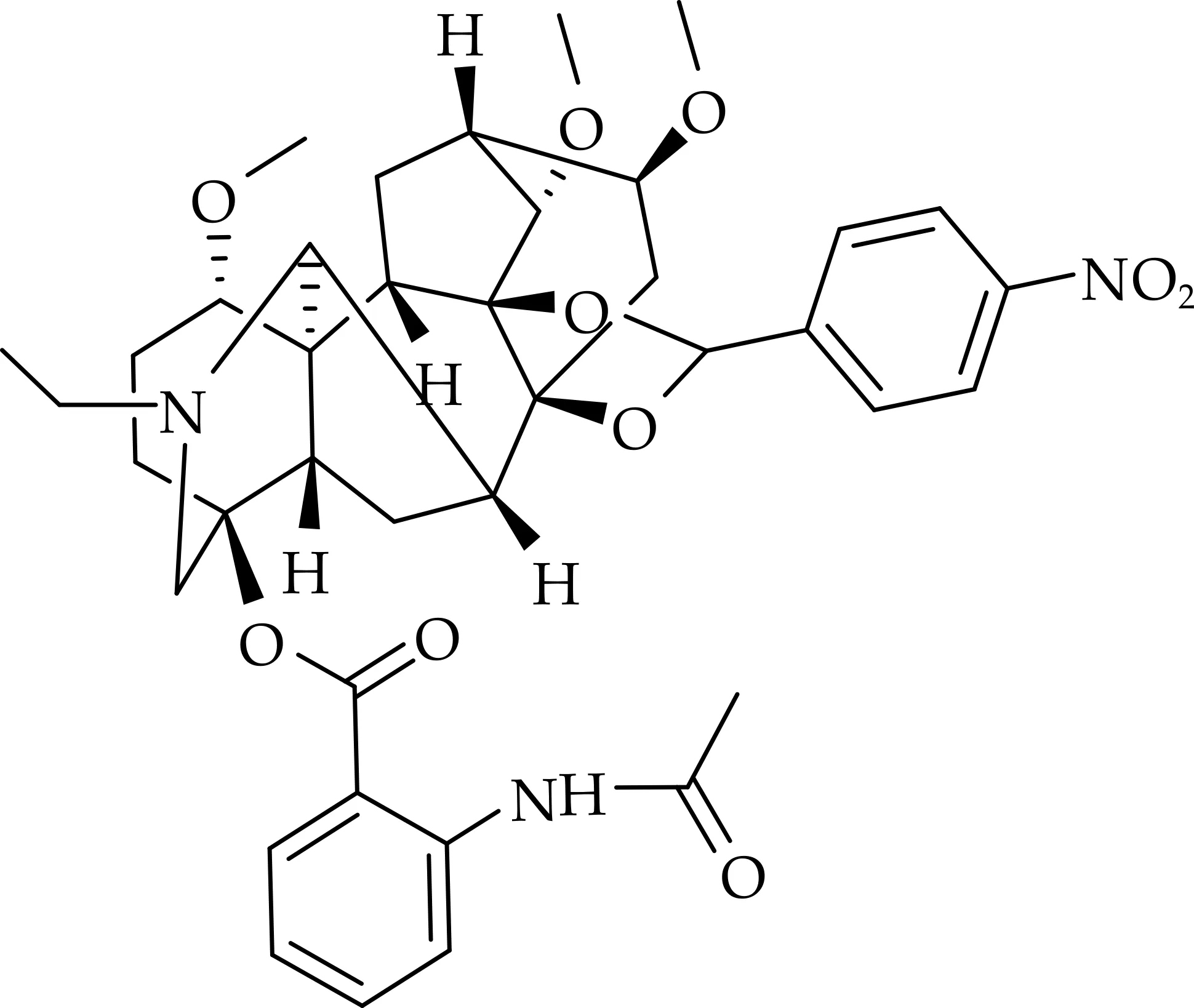
图4 化合物(3)的化学结构
白色无定型粉末,产率为60.2%,M.P.208~210 ℃.1H NMR(400 MHz,DMSO-d6)δ(ppm):10.81(1 H,s),8.44(2 H,s,J=7.2 Hz),8.27(1 H,d,J=8.0 Hz),8.17(2 H,d,J=6.8 Hz),7.84(1 H,d,J=9.5 Hz),7.57(1 H,t,J=7.8 Hz),7.17(1 H,t,J=8.2 Hz),5.83(1 H,s),3.41(1 H,d,J=11.3 Hz),3.30(9 H,s),3.19(8 H,m),2.88(1 H,s),2.68(2 H,q),2.42(1 H,m),2.35(1 H,d,J=10.6 Hz),2.25(3 H,m),2.12(3 H,s),1.91(3 H,m),1.39(2 H,q),1.03(3 H,t,J=7.1 Hz).13C NMR(100 MHz,DMSO-d6)δ(ppm):168.41,166.11,149.11,139.95,134.22,134.15,133.80,130.60,130.51,129.80,124.28,122.98,120.60,117.88,89.22,84.33,83.43,82.83,78.13,73.40,60.31,57.04,55.87,55.36,55.19,50.69,50.56,48.22,48.14,47.47,42.77,35.58,31.40,26.40,25.94,24.72,23.76,13.26.HRMS(ESI) calcd.for C39H47N3O10[M+H]+718.336 4,found:718.349 3.
2.2.4 化合物(4)
名称:(2R,3S,3aS,6aS,7R,7aR,10S,13S,13aR,13bS,14S,17S)-8-ethyl-3,13,17-trimethoxy-13b,14-dimethyl-5-(3-nitrophenyl)dodecahydro-10,13a,7-(epiethane[1,1,2]triyl)-2,6a-ethano[1,3]dioxolo[4′,5′:7,7a]indeno[5,4-b]azocin-10-yl-2-acetamidobenzoate.
化合物(4)的结构如图5所示.
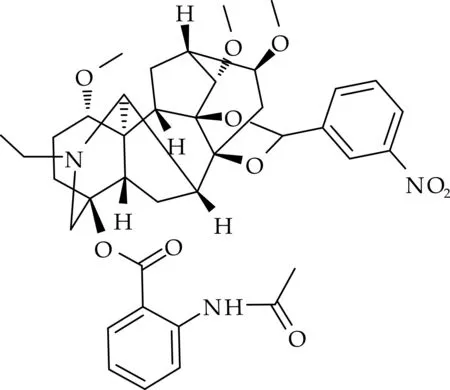
图5 化合物(4)的化学结构
白色无定型粉末,产率为72.5%,M.P.241 ~243 ℃.1H NMR(400 MHz,DMSO-d6)δ(ppm):10.95(1 H,s),8.71(1 H,t,J=1.9 Hz),8.55(1 H,d),8.35(1 H,d,J=7.6 Hz),8.27(1 H,d,J=8.3 Hz),7.91(1 H,t,J=8.5 Hz),7.84(1 H,d,J=8.0 Hz),7.57(1 H,t,J=7.9 Hz),7.17(1 H,t,J=7.2 Hz),5.83(1 H,s),3.41(1 H,d,J=11.3 Hz),3.29(9 H,m),3.18(8 H,m),2.88(1 H,s),2.68(2 H,q),2.42(1 H,m),2.35(1 H,d,J=10.7 Hz),2.25(2 H,t,J=7.3 Hz),2.12(3 H,s),2.06(2 H,m),1.91(3 H,m),1.39(2 H,q),1.03(3 H,t,J=7.1 Hz).13C NMR(100 MHz,DMSO-d6)δ(ppm):167.83,165.91,148.16,139.95,137.14,134.87,133.65,130.93,128.53,124.05,120.64,111.76,89.02,84.26,83.91,83.35,82.10,77.95,73.40,60.31,57.04,55.69,55.33,50.51,48.07,47.27,42.44,35.59,31.26,25.91,24.74,23.60,13.26.HRMS(ESI) calcd.for C39H47N3O10[M+H]+:718.336 4,found:718.349 3.
2.2.5 化合物(5)
名称:(2R,3S,3aS,6aS,7R,7aR,10S,13S,13aR,13bS,14S,17S)-8-ethyl-5-(4-hydroxy-3-methoxyphenyl)-3,13,17-trimethoxy-13b,14-dimethyldodecahydro-10,13a,7-(epiethane[1,1,2]triyl)-2,6a-ethano[1,3]dioxolo[4′,5′:7,7a]indeno[5,4-b]azocin-10-yl-2-acetamidobenzoate.
化合物(5)的结构如图6所示.
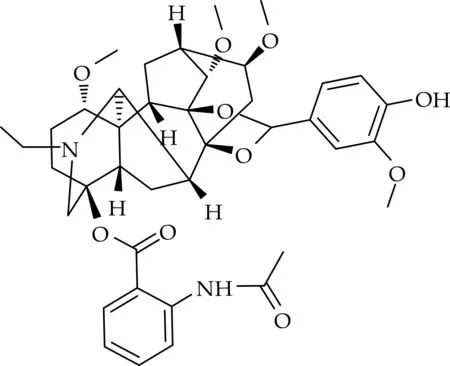
图6 化合物(5)的化学结构
白色无定型粉末,产率为73.4%,M.P.244~246 ℃.1H NMR(400 MHz,DMSO-d6)δ(ppm):10.61(1 H,s),8.27(1 H,d,J=8.2 Hz),7.85(1 H,d,J=8.0 Hz),7.58(1 H,d,J=1.9 Hz),7.56(1 H,d,J=2.1 Hz),7.40(2 H,d,J=4.5 Hz),7.17(1 H,d,J=7.6 Hz),5.79(1 H,s),3.88(3 H,s),3.84(3 H,s),3.41(1 H,d,J=11.3 Hz),3.35(3 H,s),3.27(6 H,m),3.20(8 H,m),2.89(1 H,s),2.68(2 H,q),2.34(1 H,d,J=10.8 Hz),2.26(3 H,m),2.12(3 H,s),1.95(3 H,m),1.38(2 H,q),1.03(3 H,t,J=7.1 Hz).13C NMR(100 MHz,DMSO-d6)δ(ppm):168.40,165.60,154.16,149.14,139.95,129.61,126.10,122.85,120.63,117.83,111.24,109.36,89.02,83.94,82.68,77.93,73.49,59.93,56.78,55.85,55.47,55.36,47.90,47.24,42.82,35.25,25.73,24.45,23.51,22.22,13.25.HRMS(ESI) calcd.for C40H50N2O10[M+H]+:719.346 4,found:719.359 2.
2.2.6 化合物(6)
名称:(2R,3S,3aS,6aS,7R,7aR,10S,13S,13aR,13bS,14S,17S)-5-(3,4-dimethoxyphenyl)-8-ethyl-3,13,17-trimethoxy-13b,14-dimethyldodecahydro-10,13a,7-(epiethane[1,1,2]triyl)-2,6a-ethano[1,3]dioxolo[4′,5′:7,7a]indeno[5,4-b]azocin-10-yl-2-acetamidobenzoate.
化合物(6)的结构如图7所示.
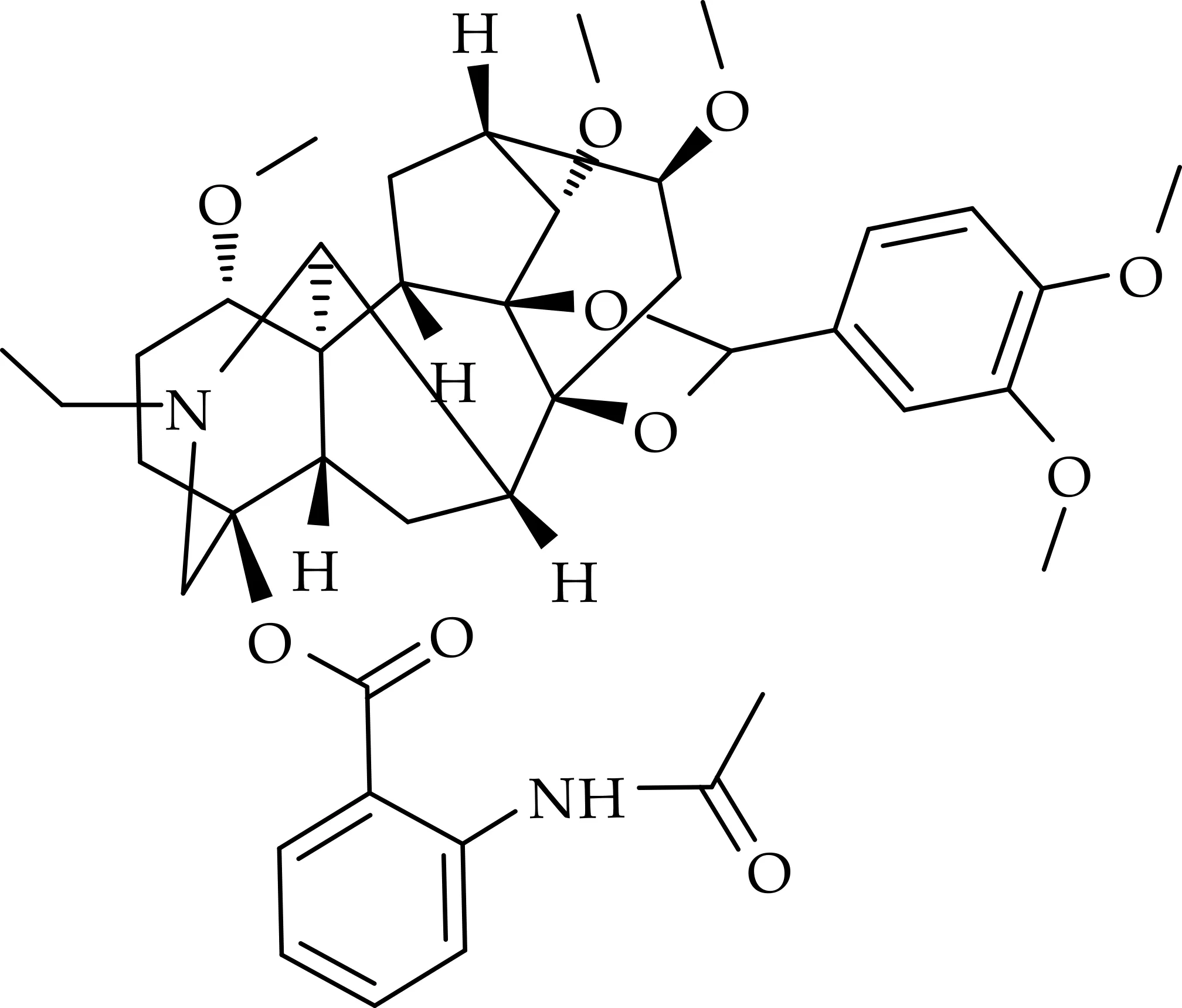
图7 化合物(6)的化学结构
白色无定型粉末,产率为68.5%,M.P.245~ 247 ℃.1H NMR(400 MHz,DMSO-d6)δ(ppm):10.61(1 H,s),8.27(1 H,d,J=8.2 Hz),7.85(1 H,d,J=8.0 Hz),7.58(1 H,d,J=1.9 Hz),7.56(1 H,d,J=2.1 Hz),7.40(2 H,d,J=4.5 Hz),7.17(1 H,d,J=7.6 Hz),5.79(1 H,s),3.88(3 H,s),3.84(3 H,s),3.41(1 H,d,J=11.3 Hz),3.35(3 H,s),3.27(6 H,m),3.20(8 H,m),2.89(1 H,s),2.68(2 H,q),2.34(1 H,d,J=10.8 Hz),2.26(3 H,m),2.12(3 H,s),1.95(3 H,m),1.38(2 H,q),1.03(3 H,t,J=7.1 Hz).13C NMR(100 MHz,DMSO-d6)δ(ppm):168.40,165.60,154.16,149.14,139.95,129.61,126.10,122.85,120.63,117.83,111.24,109.36,89.02,83.94,82.68,77.93,73.49,59.93,56.78,55.85,55.47,55.36,47.90,47.24,42.82,35.25,25.73,24.45,23.51,22.22,13.25.HRMS(ESI) calcd.for C41H52N2O10[M+H]+:733.256 4,found:733.269 3.
2.2.7 化合物(7)
名称:(2R,3S,3aS,6aS,7R,7aR,10S,13S,13aR,13bS,14S,17S)-8-ethyl-5-(4-hydroxy-3-methoxyphenyl)-3,13,17-trimethoxy-13b,14-dimethyldodecahydro-10,13a,7-(epiethane[1,1,2]triyl)-2,6a-ethano[1,3]dioxolo[4′,5′:7,7a]indeno[5,4-b]azocin-10-yl-2-acetamidobenzoate.
化合物(7)的结构如图8所示.
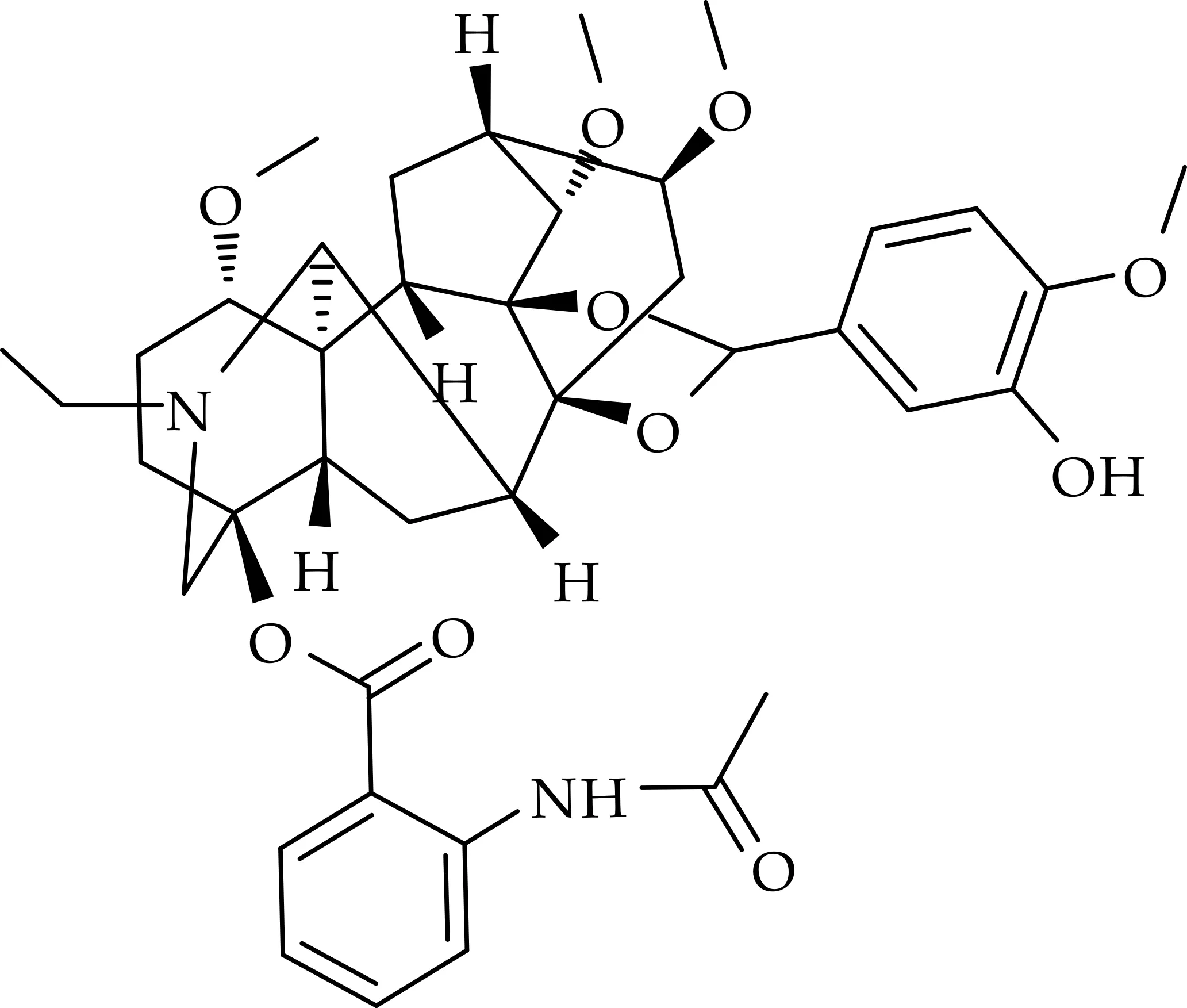
图8 化合物(7)的化学结构
白色无定型粉末,产率为62.3%,M.P.188~190 ℃.1H NMR(400 MHz,DMSO-d6)δ(ppm):1H NMR(400 MHz,DMSO-d6)δ(ppm):10.87(1 H,s),8.27(1 H,d,J =8.2 Hz),7.85(1 H,d,J=8.0 Hz),7.57(1 H,t,J=7.8 Hz),7.42(1 H,d,J=2.0 Hz),7.40(1 H,d,J=2.0 Hz),7.25(1 H,d,J=1.9 Hz),7.12(1 H,d,J=8.0 Hz),5.82(1 H,s),5.27(1 H,s),3.87(3 H,s),3.41(1 H,d,J=11.3 Hz),3.35(3 H,s),3.26(3 H,s),3.19(9 H,m),2.89(1 H,s),2.68(2 H,dd,J=14.6,7.5 Hz),2.44(2 H,m),2.36(1 H,m),2.27(2 H,m),2.12(3 H,s),2.04(1 H,m),1.95(4 H,m),1.39(2 H,q),1.03(3 H,t,J=7.1 Hz).13C NMR(100 MHz,DMSO-d6)δ(ppm):168.40,165.89,153.32,146.99,139.63,133.93,129.81,124.36,120.62,113.44,111.57,89.03,84.58,83.94,83.65,82.65,82.08,78.13,73.40,60.19,57.04,55.87,55.76,55.37,50.56,48.48,48.23,47.89,47.54,46.60,42.46,35.53,25.37,24.15,23.50,12.72.HRMS(ESI) calcd.for C40H50N2O10[M+H]+:719.336 1,found:719.347 2.
2.2.8 化合物(8)
名称:(2R,3S,3aS,6aS,7R,7aR,10S,13S,13aR,13bS,14S,17S)-8-ethyl-3,13,17-trimethoxy-13b,14-dimethyl-5-(3,4,5-trimethoxyphenyl)dodecahydro-10,13a,7-(epiethane[1,1,2]triyl)-2,6a-ethano[1,3]dioxolo[4′,5′:7,7a]indeno[5,4-b]azocin-10-yl-2-acetamidobenzoate.
化合物(8)的结构如图9所示.

图9 化合物(8)的化学结构
淡黄色无定型粉末,产率为62.7%.M.P.248~250 ℃.1H NMR(400 MHz,DMSO-d6)δ(ppm):10.76(1 H,s),8.27(1 H,d,J=8.3 Hz),7.85(1 H,d,J=6.4 Hz),7.57(1 H,t,J=7.1 Hz),7.27(2 H,s),7.17(1 H,t,J=8.1 Hz),5.80(1 H,s),3.87(12 H,s),3.77(3 H,s),3.41(1 H,d,J=11.3 Hz),3.35(3 H,s),3.26(3 H,m),3.19-3.21(8 H,m),2.89(1 H,s),2.68(2 H,dd,J=14.5,7.4 Hz),2.35(1 H,d,J=10.7 Hz),2.25(2 H,m),2.12(3 H,s),1.92-1.94(3 H,m),1.38(2 H,q),1.03(3 H,t,J=7.1 Hz).13C NMR(100 MHz,DMSO-d6)δ(ppm):168.40,165.90,153.30,142.78,139.95,133.29,131.62,124.13,122.85,120.63,106.69,101.67,89.00,84.23,82.66,78.13,73.19,60.18,59.91,57.04,56.02,55.87,55.36,48.17,47.25,42.18,36.17,35.79,31.09,25.37,24.72,24.43,13.25.HRMS(ESI) calcd.for C42H54N2O11[M+H]+:763.372 8,found:763.376 0.
2.3 高乌甲素缩醛类化合物的抗肿瘤活性
经MTT法对化合物1-8 进行初步的抗肿瘤活性测试,使用高乌甲素[17-20]和抗肿瘤药物5-氟脲嘧啶作为阳性对照,通过软件SPSS 20计算,得到半数抑制浓度IC50,如表 3所示.

表3 高乌甲素及其衍生物对细胞株HepG2、
注:-表示IC50值>100μmol/mL.
表3显示,高乌甲素及大部分衍生物对三种肿瘤细胞的增殖均有较好的抑制作用,尤其是高乌甲素与异香草醛的衍生物7对HepG2、A549、HeLa三种肿瘤细胞的半数抑制浓度IC50值分别为4.86、6.45、3.29μmol/mL,接近于对照药物5-FU的抑制效果,且高于高乌甲素的抑制作用.高乌甲素与甲基香兰素的衍生物6的对肿瘤细胞的抑制效果次之.提示高乌甲素及其衍生多种肿瘤细胞有较强的细胞毒作用,尤其是对人宫颈癌细胞株 HeLa的抑制效果最好.衍生物4、5对细胞的抑制率随着浓度的增加变化不明显,且对不同肿瘤细胞株的抑制效果不同.
分析其原因,香兰醛和胡椒醛基团在不改变高乌甲素药效团与乌头烷优势结构的基础上,提高高乌甲素衍生物的溶解性与渗透性,使高乌甲素衍生物的抗肿瘤活性提高.
3 结论
本文以高乌甲素与芳香醛杂合化合物为原料,成功合成了一系列高乌甲素缩醛类化合物,采用1H NMR、13C NMR与HRMS对所合成的化合物进行了结构表征,并使用HepG2、A-549与HCT-8三种细胞株进行了初步的抗肿瘤活性测试,合成的化合物对三个细胞株呈现出不同程度的抑制作用,抑制活性都强于高乌甲素.经初步活性测试,上述合成的一系列高乌甲素缩醛类化合物均具有抗肿瘤活性,为进一步作用机制与临床前研究提供可靠依据.
[1] 谢海辉,韦璧瑜.高乌头的化学成分及其药理作用研究进展[J].天然产物研究与开发,2010,22:232-235,154.
[2] 高稚淇,谢 红,陈 玲.高乌头生物碱高乌甲素对大鼠心肌缺血/再灌注损伤的保护作用研究[J].江苏中医药,2015,47(6):79-81.
[3] 林密迦,杨锡馨.高乌甲素对手术致痛大鼠的镇痛及局麻作用的研究[J].海峡药学,2011,23(4):29-31.
[4] 汪 芳,赵 军,赵翡翠,等.白喉乌头的化学成分研究[J].中国药房,2015(9):1 233-1 235.
[5] W Sun,S Zhang,Y Zhao,et al.Optimization and comparison of extraction methods of lappaconitine from aconitum sinomontanum nakai[J].Asian Journal of Chemistry,2016,28(2):435-440.
[6] 饶 冉.乌头属药用植物研究进展[J].安徽农业科学,2012,40(29):14 227-14 230.
[7] 苏 帆.高乌甲素的临床应用及研究进展[J].实用疼痛学杂志,2009,5(1):50-54.
[8] 陈福军,杨 帆,付 岩,等.高乌甲素在临床肛肠病术后镇痛效果的研究[J].齐齐哈尔医学院学报,2016,37(14):1 838-1 839.
[9] 刘铭佩,鞠 洋,党月兰.高乌甲素的抗炎作用[J].中药药理与临床,2004,20(4):13-15.
[10] Wang Y Z,Xiao Y Q,Zhang C,et al.Study of analgesic and anti-inflammatory effects of lappaconitine gelata[J].Journal of Traditional Chinese Medicine,2009,29(2):141-145.
[11] 胡金芳,刘 静,冯 玥,等.正交设计筛选独一味和高乌甲素抗炎镇痛作用的最佳配比[J].中药药理与临床,2012(5):53-55.
[12] 赖谷仙,戴日强.螺环化合物的合成研究[J].化工技术与开发,2012,41(5):6-7.
[13] Pankrushina N A,Nikitina I A,Anferova N V,et al.Study of alkaloids of the siberian and altai flora.10.synthesis of N(20)-deethyllappaconitine derivatives[J].Russian Chemical Bulletin,2003,52(11):2 490-2 499.
[14] 王建莉.镇痛药高乌甲素和草乌甲素的结构修饰以及脂肪环醚氧化成内酯反应的研究[D].成都:四川大学,2004.
[15] Osadchii S,Shul′Ts E,Polukhina E,et al.Study of alkaloids of the siberian and altai flora:12.synthesis of new lappaconitine derivatives containing olefinic substituents[J].Russian Chemical Bulletin,2006,55(6):1 077-1 084.
[16] 李 智.C_(18)二萜生物碱结构改造与不对称催化活性研究[D].大连:大连理工大学,2014.
[17] 林 妮,肖柳英,林培英,等.氢溴酸高乌甲素抗肿瘤的实验研究[J].中医研究,2005,18(10):16-18.
[18] 盛良翮,徐 萌,徐立群,等.高乌甲素对非小细胞肺癌体外杀伤作用及其分子机制[J].中药材,2014(5):840-843.
[19] 伍耀衡,宁异真,许建邦,等.参附注射液、高乌甲素注射液诱导白血病细胞株HL-60分化、凋亡的研究[J].广州中医药大学学报,2008,25(2):131-137.
[20] 孔古娅,卿德华,楚 延.氢溴酸高乌甲素的抗心律失常作用[J].四川生理科学杂志,2002,24(4):175-177.
【责任编辑:陈 佳】
Synthesis and antitumor activity of lappaconitine acetal compounds derivatives
YANG Wen-yan1, FENG Guo-zhong1*, LIANG Cheng-yuan2, PEI Shao-meng2, SONG Hui-hui2, JU Wei-hui2, FENG Zhuang-zhuang2
(1.School of International Pharmaceutical Business, China Pharmaceutical University, Nanjing 211198, China; 2.School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
To discover novel compounds with better antitumor activities and less toxicities,in the present work,a series of compounds of lappaconitine acetal have been synthesized from the hybrids of lappaconitine and aromatic aldehydes,which have not been reported in other literature before.The structure of the synthesized compounds were characterized by1H NMR,13C NMR and HRMS.Additionally,the cytotoxicity of the synthesized compounds on human hepatocarcinoma cells (HepG2),human lung cancer cells (A-549) and human colon cancer cells (HCT-8) have further been detected by MTT method.The results revealed that these compounds have potent inhibition on different cell lines in various degrees,specifically,the most potent compound 6 and 7 are worth further studying owing to their satisfactory cytotoxic activities.
lappaconitine; aromatic aldehyde hybrid compounds; acetal compounds; antitumor activity; drug synthesis
2016-10-28 基金项目:国家自然科学基金项目(81602967); 中国博士后科学基金项目(2016M592898XB); 陕西省科技厅自然科学基金项目(2014JQ4154); 陕西省教育厅专项科学研究计划项目(15JK1076); 陕西省人力资源与社会保障厅博士后基金资助项目(2015); 国家级大学生创新创业训练计划项目(201510708172,201610708019)
杨文艳(1989-),女,江苏南京人,在读硕士研究生,研究方向:医药产业技术与经济
冯国忠(1961-),男,江苏南京人,教授,研究方向:药学、医药产业经济与诊断咨询,fen-zhongcpu@126.com
1000-5811(2017)02-0135-07
R914.5
A

