女性人乳头瘤病毒感染的基因型分布及临床意义
陈静 徐晶晶 何淑珍 秘相平 王文河
·论著·
女性人乳头瘤病毒感染的基因型分布及临床意义
陈静 徐晶晶 何淑珍 秘相平 王文河
目的 探讨人乳头瘤病毒(HPV)感染的基因型分布情况及临床意义。方法 采用基因芯片技术对134例患者宫颈上皮细胞标本进行23种基因型别的检测,并对受检者进行相关资料分析。结果 134例患者进行23种HPV基因分型检测,HPV感染阳性患者60例,感染率44.78%(60/134),其中单一型HPV感染率为30.60%(41/134);多型HPV感染率为14.18%(19/134);除HPV73型没有感染外,其余22种型别均有感染。结论 单一型HPV16型和单一型HPV58型是HPV感染的主要基因型别。基因扩增芯片技术一次可检测23种基因型,特异性强,敏感性高,对女性HPV感染基因型分布的病因学研究具有重要意义。
人乳头瘤病毒(HPV);基因分型;基因芯片技术
宫颈癌是目前人类所有癌症中唯一病因明确的癌症,也是第一个可防、可控、可干预治疗的癌症[1-3]。宫颈癌的发生与HPV感染的关系十分密切,HPV是一种专门感染人表皮和黏膜鳞状上皮的病毒,传播途径以性行为为主,其次是唾液和皮肤接触[4]。现研究已证实,高危型人乳头瘤病毒(human papillomavirus,HPV)感染是诱发宫颈癌的主要因素[5-8]。现采用基因扩增及基因芯片检测技术,对宫颈上皮细胞标本进行23种常见的HPV基因型检测,以了解HPV感染和基因型分布的情况,以此分析HPV与宫颈癌发生发展关系,为宫颈癌的干预治疗,HPV疫苗及试剂的研发提供数据资料和参考[9]。
1 资料与方法
1.1 一般资料 2012年9月30日至2015年9月30日,因阴道分泌物异常或接触性出血在我院自愿进行HPV基因分型筛查的患者134例,年龄21~64岁,平均年龄(40±4)岁。均已婚,72 h内无阴道用药及性生活,对其基因分型结果进行分析。
1.2 仪器与试剂 核酸扩增实时荧光检测系统Applied Biosystems Step One Plus 基因扩增仪由杭州辉图生物科技有限公司提供;分子杂交仪由杭州奥盛仪器有限公司提供;TGL-16台式高速冷冻离心机购自湖南湘仪实验仪器开发有限公司;干式恒温器由杭州奥盛仪器有限公司提供;试剂储存冰箱购自青岛海尔特种电器有限公司;微型混合器由海门市其林贝尔仪器制造有限公司提供;微型离心机由海门市其林贝尔仪器制造有限公司提供,移液器由赛默飞世尔(上海)仪器有限公司提供。HPV分型基因测试盒购自珠海赛乐奇生物技术有限公司。每次试验时需当时配制洗脱液,所需要的浓度均使用蒸馏水调配。
1.3 方法
1.3.1 标本的采集及保存:月经正常女性,月经来潮后10~18 d为最佳检查时间;检查前48 h内不要作阴道冲洗,不要用避孕药膏等阴道内用药物;检查前48 h最好不应有性生活;检查前不进行醋酸或碘液涂抹。由医生以扩阴器暴露宫颈口,用棉拭子将宫颈口过多的分泌物擦去。将宫颈刷伸入宫颈口处,轻轻搓动宫颈刷使其顺时针旋转3~5圈。慢慢取出宫颈刷,将其放入装有细胞保存液的样本管中。在管口处将多余的刷柄折断,将刷头留在样本管中。旋紧管盖,并注明编号和日期。样本保存后,如若不能马上检测,应将样本置于4℃存放,并在2周内完成检测。应避免保存细胞样本反复冻融。
1.3.2 DNA的提取:震荡混匀临床标本,使宫颈刷上的宫颈脱落细胞尽量多的溶解在保存液中,取1 ml转移至1.5 ml离心管中(如果发现样本有渗漏,要先用卫生纸擦干)(转管后换手套);12 000 r/min,离心10 min,弃上清,留沉淀(宫颈脱落细胞比重大,获取宫颈脱落细胞,HPVDNA存在于脱落细胞中。上清液使用1 ml移液枪移除;加50 μl样本处理液(如果能固定样本处理液,开一个加一个。如果不能固定,3个3个的加,不要一次性全部开盖,然后一次性加完)震荡混匀,在金属浴中100℃加热10 min(裂解脱落细胞的蛋白质外壳,便于HPVDNA能游离出细胞;样本处理液每次加样时要充分混匀,保证取样中含有均匀的树脂颗粒);加热后12 000 r/min,离心10 min,目标DNA片段在上清,备用;阳性对照、阴性对照融化后可直接使用。由于不同原因,有些临床样本中含有太多的血液,因为血红蛋白的存在对PCR系统,特别是对Taq酶的催化效率有影响,所以如果不加以控制,可能对后面的诊断结果有影响,出现这种情况的处理方法是将细胞保存管在震荡器上震荡时间长些,吸取1 ml临床样本,离心收集细胞后,再用灭菌的0.9%氯化钠溶液漂洗1次。由于患者有不同程度的妇科炎症,加上部分医生取样不规范,可能会导致提取前的临床样本黏度太大,影响操作。处理方法是将细胞保存管在震荡器上震荡时间长些,不要取黏液,将取样刷头去除,吸取瓶底部液体,另要求医生在取样时尽量规范。
1.3.3 PCR扩增:取出直用型PCR反应液,在室温下融化并2 000 r/min离心10 s备用。按顺序放置,取上述制备的样本上清液10 μl,按顺序加入上述PCR管中;取10 μl模板之前,更换手套。取10 μl DNA模板,获取有效的DNA,便于扩增到有效的DNA产物。操作过程尽量迅速,能更有效的避免气溶胶污染。将上述PCR扩增管2 000 r/min离心10 s,避免管壁挂珠;按照以下条件进行扩增:50℃ 2 min,95℃ 15 min,94℃ 30 s,45℃ 1 min,72℃ 30 s,进行50个循环;72℃延伸10 min后,4℃密封保存备用。
1.3.4 杂交、孵育和显色:将杂交液,BW反应液取出,融化;将100×洗涤液A和200×洗涤液B稀释成1×工作液,全自动基因芯片检测系统使用前调试。揭开芯片保护膜,取 20 μl PCR 扩增产物加入至芯片表面,然后取100 μl直用型杂交液(提前10 min左右从冰箱拿出,室温融化)加入芯片表面,混匀;覆盖芯片表面;加样后的芯片在45℃杂交仪上杂交45 min,然后在室温下放置5 min,使其冷却至室温(能确保HPVDNA分子能够有效的与探针结合);用预热至(50±1.5)℃的1×洗涤液A在自动洗脱仪内进行洗脱,浸泡洗脱2 min;用离心机将芯片表面液滴吹干。取直用型BW反应液适量(100~110 μl)覆盖于芯片表面,并在35℃下反应15 min(BW反应液中的亲和素一端与结合好HPVDNA分子的探针上的生物素进行有效的结合);用预稀释的1×洗涤液B(室温),洗涤芯片3次;用离心机吹干芯片表面;将直用型显色液2~3滴(100~110 μl)滴加在干燥的芯片表面,并使其覆盖全片,避光35℃下反应10 min;用预稀释的1×洗涤液B迅速冲洗芯片3次,离心机吹干芯片表面后即可观察结果。
2 结果
2.1 HPV基因分型检测结果 134例患者进行23种HPV基因分型检测,阳性60例,阴性74例,HPV感染率44.78%(60/134),其中单一型HPV感染41例,占总感染率的30.60%(41/134);多型HPV感染19例,占总感染率的14.18%(19/134),提示以单一型HPV感染为主。除HPV73型没有感染外,其余22种型别均有感染。单一型感染中HPV16型和HPV58型均有5例,是主要的感染型别;其次是HPV51型4例;再次HPV33、HPV52、HPV53、HPV56各3例;HPV6、HPV11、HPV18、HPV68各2例;二型感染8例:HPV53、6,HPV6、43,HPV45、58,HPV52、59,HPV6、58,HPV16、81,HPV16、58,HPV16、6;三型感染7例:HPV52、11、42,HPV31、51、53,HPV33、52、56,HPV53、66、6,HPV35、52、53,HPV11、51、56,HPV6、16、35,四型感染1例:HPV31、33、59、83,五型感染2例:HPV33、51、52、6、43,HPV52、53、56、58、6;还出现了1例罕见的八型感染:16、31、33、35、59、68、82、83。其中HPV35、82、83型只出现在多型感染中。60例HPV阳性患者检出不同型别数合计88次,对多重感染者,各型别的阳性率重复计算[5]。
2.2 不同年龄HPV型别感染情况 20~29岁、30~39岁、40~49岁和50~60岁4组HPV阳性患者数比较,40~49岁最多46例,20~29岁最少只有6例,由此可见40~49岁是HPV易感年龄段,60例患者不同年龄段HPV型别感染情况。见表1。
3 讨论
有研究显示,宫颈癌及其癌前病变主要是HPV感染引起的,宫颈癌患者中99.7%的人均能检测到HPV DNA,全球超过2/3的宫颈癌病例是由高危型HPV感染引起[10-13]。另有报道表明约80%以上有性行为的女性在其一生的某个阶段都曾感染过HPV,绝大数的感染者在感染后1~2年均能自行消退,只有极少数持续HPV感染,从而诱发宫颈上皮恶性转化导致宫颈癌的发生[7,14]。
本研究表明:(1)134例患者进行23种HPV基因分型检测,HPV感染率为44.78%(60/134),其中单一型HPV感染率的30.60%(41/134);多型HPV感染率为14.18%(19/134);提示以单一型HPV感染为主。单一型中HPV16型和HPV58型感染为主;其次是HPV51型,多型感染以二型感染为主,且除HPV73型没有感染外,其余22种型别均有感染。所有88人次HPV感染的患者中有83例都伴有高危型HPV感染,感染率94.32%(83/88)。(2)女性生殖道存在着一条HPV感染通道,宫颈是其通道中HPV感染最高的部位,也是最易感部位[15]。(3)88次不同型别HPV感染的患者中,除一位感染HPV11型的患者是64岁以外其他患者均≤60岁。20~29岁占6.8%(6/88)、30~39岁占22.7%(20/88)、40~49岁占53.4%(47/88)、50~60岁占17.1%(15/88)。提示HPV感染主要集中在40~50年龄段[16]。此年龄段女性开始进入围绝经期,是正常的生理变化时期,泌尿生殖系也发生改变,生殖器官开始萎缩,黏膜变薄,此时的宫颈比较容易被感染,处于这个年龄段的女性应定期筛查HPV。(4)本研究为HPV感染的预防、治疗,疫苗和诊断试剂的研发以及分子流行病学调查提供理论依据。目前与宫颈癌相关的其它高危因素也比较明确,主要有过早或不洁的性行为,分娩因素及性传播疾病导致的宫颈炎对宫颈的长期刺激等,对于有上述高危因素的女性,应尽量进行HPV分型检测[17]。
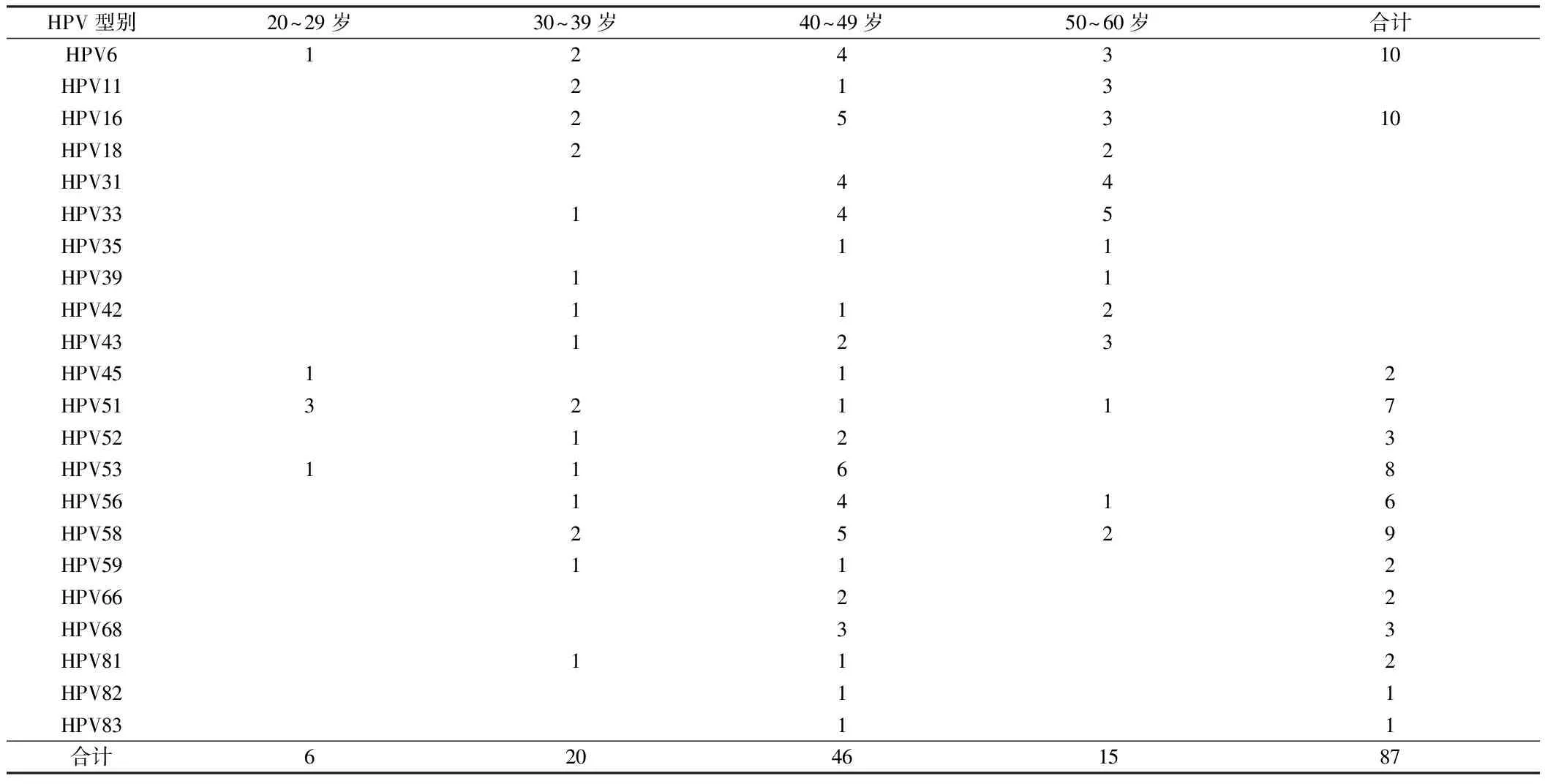
表1 60例患者不同年龄段HPV型别感染情况 例
注:1例64岁患者仅感染HPV11型
综上所述,HPV检测技术可了解患者是否存在与宫颈癌关系密切的HPV感染[18]。通过宫颈上皮细胞HPV基因型检测,宫颈细胞学检查及宫颈活组织检查等,已使很多国家的女性宫颈癌的发病率呈下降趋势。总之,在宫颈癌及癌前病变的筛查中,HPV分型检测发挥了重要的意义[19,20]。
1 董云灿,耿建祥,张劲松,等.1722例已婚女性宫颈细胞中人乳头瘤病毒基因的分布.国际检验医学杂志,2012,33:817-820.
2 李清.宫颈癌的研究进展.国际妇产科学杂志,2012,39:330-333.
3 魏谨,耿建祥,朴正爱,等.已婚女性宫颈细胞中人乳头瘤病毒感染的基因分型研究.中华医院感染学杂志,2012,22:5202-5205.
4 张桂立,郜红艺,张江宇,等.HPV多重感染与宫颈癌及癌前病变发生,发展的关系研究.中国妇幼保健,2010,25:3270-3274.
5 兰建云,邵伟伟,袁苏娟,等.外耳道乳头瘤中的人乳头瘤病毒检测及其临床意义.医学研究生学报,2010,23:391-393.
6 张金浩,耿建祥,吴篦岚,等.结直肠肿瘤中人乳头瘤病毒感染的基因分析.医学研究生学报,2011,24:154-157.
7 李海,邓志勇,张阳,等.人乳头瘤病毒在阴茎鳞癌组织中的表达及意义.现代实用医学,2010,22:1037-1038.
8 Fernandes JV,Meissner RV,Carvalho MG,et al.Prevalence of human papillomavirus in archival samples obtained from patients with cervical pre-malignant and malignant lesions from Northeast Brazil.BMC Res Notes,2010,3:96-98.
9 夏林,王宏景,耿建祥,等.131例女性宫颈癌HPV感染基因型分布.国际检验医学杂志,2015,36:1188-1190.
10 杨滨,娄晓明,姜囡,萍.子宫颈癌患者血清中HPV检测的临床意义.广东医学,2011,32:1002-1003.
11 蒋学峰,杨洁,阚淳一,等.高危HPV检测在预测宫颈上皮内瘤变锥切后残存病变或复发中的意义.中国妇幼保健,2010,25:745.
12 张桂香,周自秀,崔彭华,等.高危HPV检测及随访对宫颈癌预防的临床意义.中国妇幼保健,2013,28:3264-3267.
13 张向楠,王英红,张文杰.新疆维吾尔族及汉族宫颈癌及高危癌前病变与HPV感染亚型关系研究.中华实用诊断与治疗杂志,2012,26:321-323.
14 Schiffman M,Wentzensent N,Wacholder S,et al.Human papillomavirus testing in the prevention of cervical cancer.Natl Cancer Inst,2011,5:368-383.
15 张元,钱小华,柴丽.295例宫颈病变患者HPV亚型多重感染与宫颈病变的关系.中国医药科学,2013,3:7-8.
16 刘惠敏.TCT联合HPV在子宫颈病变中的诊断价值.中国妇幼保健,2011,26:5202-5205.
17 何金凤.HPV-DNA的检测及分型诊断在宫颈癌筛查中的应用.中国医药导刊,2013,15:1703-1704.
18 余玲玲,何莲芝.HPV分型与HPVL1蛋白联合检测在判断宫颈疾病预后中的意义.国际妇产科学杂志,2014,6:667-669.
19 林秋兰,林克,赵丽华,等.HPV分型检测及其在宫颈病变中的意义.现代中西医结合杂志,2013,22:3585-3586.
20 童红莉,田亚平,温新宇,等.宫颈脱落细胞HPV-DNA分型检测的临床意义.军医进修学院学报,2010,31:1184-1185.
10.3969/j.issn.1002-7386.2017.07.019
253800 河北省故城县医院
R 711.74
A
1002-7386(2017)07-1026-03
2016-04-12)

