子宫内膜癌中淀粉样肽前体样蛋白2表达变化及对预后的影响分析
吴媛
·论著·
子宫内膜癌中淀粉样肽前体样蛋白2表达变化及对预后的影响分析
吴媛
目的 探讨子宫内膜癌中淀粉样肽前体样蛋白2(APLP2)的表达变化及对预后影响,为改善患者预后提供参考依据。方法 通过免疫组织化学法对38例子宫内膜癌和42例正常子宫内膜石蜡切片的APLP2表达情况,并收集患者的临床资料和随访结果,分析APLP2的表达与患者临床资料关系,根据患者APLP2表达情况分为阳性组和阴性组,比较2组患者生存情况。结果 子宫内膜癌组织中APLP2的阳性表达率为28.95%,明显低于正常子宫内膜组织的85.71%(P<0.05);APLP2阳性表达与肌层浸润、雌激素受体表达、分化程度相关(P<0.05),与年龄、FIGO分期、病理类型、淋巴结转移无关(P>0.05);随访时间6~36个月,阳性组生存率为81.48%,明显高于阴性组的55.45%(P<0.05)。结论 子宫内膜癌患者中APLP2呈低表达,其低表达与肌层浸润和分化程度有关,并可作为患者预后的重要评估指标。
子宫内膜癌;淀粉样肽前体样蛋白2;免疫组化;雌激素受体;预后
子宫内膜癌是对女性群体身心健康和生命威胁极大的恶性肿瘤之一,其病死率及发病率呈现出逐年上升,且有趋向年轻化的趋势[1]。目前,在临床中对于子宫内膜癌的治疗方法主要有化疗、放疗、激素治疗、手术等,对于早期子宫内膜癌患者疗效满意,但由于子宫内膜癌患者早期临床症状不典型,患者难以自觉,多数患者确诊时已处于中晚期,此时可能已经出现转移,且在手术、化疗等治疗后容易复发,使得患者整体预后较差,其生存期中位数在6~15个月内[2]。近几年,分子生物学标记物在恶性肿瘤患者的诊断及预后评估中得到了相当广泛地应用。国外研究显示,在恶性肿瘤的发生发展过程中淀粉样肽前体样蛋白2(APLP2)起到了重要作用,具有调节癌细胞增殖、诱导癌细胞凋亡以及重构癌细胞骨架等作用[3]。基于此,本研究分析了子宫内膜癌患者中APLP2的表达变化及对预后的影响,我们的试验旨在为改善患者预后提供临床依据,报道如下。
1 资料与方法
1.1 一般资料 收集2013年6月至2015年6月我院收治的子宫内膜癌患者的资料,病历资料完整且取得子宫内膜癌石蜡切片的患者纳入本研究,共纳入38例患者。年龄46~71岁,平均年龄(56.1±6.9)岁;国际妇产科联盟(FIGO)制定的分期[4]:Ⅰ期10例,Ⅱ期18例,Ⅲ期7例,Ⅳ期3例;分化程度:G1者21例,G2者9例,G3者8例;病理类型:子宫内膜样内膜癌34例,浆乳癌或透明细胞癌4例;肌层浸润深度:≤1/2者26例,>1/2者12例;有淋巴结转移5例,无淋巴结转移33例;雌激素受体:阳性31例,阴性7例。选取同时期存档的42例正常子宫内膜石蜡切片作为对照,均来自子宫肌瘤或者子宫肌腺病患者,患者年龄45~70岁,平均年龄(55.4±7.2)岁。
1.2 入选与排除标准
1.2.1 入选标准:①均行手术治疗;②行手术治疗前均未进行放化疗或者其他辅助治疗;③病历资料及随访结果保存完整者。
1.2.2 排除标准:①伴有远处转移者;②复发患者;③资料不完整者。
1.3 方法
1.3.1 检测方法:子宫内膜癌与正常子宫内膜石蜡标本均行免疫组织化学法检测APLP2表达水平,操作流程均严格参照说明书进行;所有石蜡标本切片均有阳性对照与阴性对照,其中阴性对照通过PBS代替一抗;显色试剂盒与免疫组化试剂盒由美国GIBCO公司生产,兔抗人APLP2多克隆抗体由北京中杉金桥生物技术有限公司生产。
1.3.2 结果判定:通过半定量积分法对阳性细胞着色强度与阳性细胞率分别进行分级记分[5],然后根据二者得分乘积确定APLP2阳性表达;其中染色面积分级记分:0分:0%~5%,1分:6%~25%,2分:26%~50%,3分:51%~75%,4分:76%~100%。染色强度分级记分:0分:阴性,1分:弱阳性,2分:中阳性,3分:强阳性;APLP2表达=染色强度×染色面积,总分为12分,其中阴性:0~2分,阳性:3~12分。
1.4 观察指标 观察子宫内膜癌和正常子宫内膜石蜡切片的APLP2表达情况,并对不同临床病理指标间APLP2阳性表达率进行比较;出院后进行随访,随访时间截止至2016年6月,比较APLP2阳性与阴性患者生存情况。
1.5 统计学分析 应用SPSS 20.0统计软件,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1APLP2表达情况比较APLP2阳性表达呈现棕黄色染色,主要集中在子宫内膜组织的腺上皮细胞细胞质内;在子宫内膜癌组织中APLP2的阳性表达率为28.95%,明显低于正常子宫内膜组织(P<0.05)。见表1,图1。

表1 子宫内膜癌与正常子宫内膜组织APLP2表达情况比较 例(%)
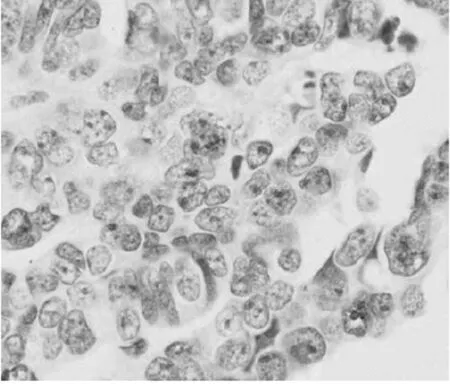
图1A APLP2在正常子宫内膜组织中表达情况(×400)

图1B APLP2在子宫内膜癌组织中表达情况(×400)
2.2 不同临床病理指标间APLP2阳性表达率比较APLP2阳性表达与肌层浸润、雌激素受体表达、分化程度相关(P<0.05),与年龄、FIGO分期、病理类型、淋巴结转移无关(P>0.05)。见表2。
2.3 生存分析 对患者的随访时间为6~36个月,中位随访时间为23个月;根据患者APLP2的表达情况分为阳性组和阴性组。截至随访结束时间,38例患者中死亡11例;其中APLP2阳性组患者存活5例(55.45%),死亡6例(54.55%);APLP2阴性组患者存活22例(81.48%),死亡5例(18.52%);阳性组生存率明显高于阴性组,差异有统计学意义(χ2=4.932,P<0.05)。

表2 不同临床病理指标间APLP2阳性表达率比较 例(%)
3 讨论
APLP2为Ⅰ型跨膜蛋白,位于11q24-25上,mRNA长度约为3 289bp,其氨基酸序列和APLP1、淀粉样蛋白前体存在广泛同源性与区域保守性,均同属于一个家族,其结构特点为单次跨膜结构[6]。在近年来的相关发现指出,APLP2和人胎盘中所发现的人CDEBP、精子膜蛋白抗体YWK-Ⅱ以及淀粉样前体蛋白同源性同属一种蛋白质[7]。国内外多项研究显示,APLP2蛋白基因在机体各个组织中均存在表达,Weyer等[8,9]的研究结果表明,APLP2参与了机体神经细胞分化和成熟的生理过程。早期亦有相关研究显示,在生殖系统中APLP2发挥着重要作用,如Vanage等[10]的动物试验指出,使用APLP2 抗体后可有效降低雄性小鼠与雌性小鼠的生育能力;同时敲除APLP2与淀粉样蛋白前后可诱导不育。随着对APLP2研究的逐步深入发现,在恶性肿瘤发生发展过程中APLP2发挥着一定作用,具有调节癌细胞分化、诱导癌细胞凋亡等作用。Pandey等[11]学者在胰腺癌患者中的发现,APLP2能够对通过细胞骨架蛋白actin造成影响,从而促进癌细胞侵袭和迁移。
本研究中发现,在子宫内膜癌组织中APLP2的阳性表达率为28.95%,明显低于正常子宫内膜组织的85.71%。研究结果提示,在子宫内膜癌中APLP2存在者低表达现象。杨思勤等[12]的相关研究中亦指出,在子宫内膜癌组织中APLP2mRNA水平显著低于正常的内膜组织,这与本研究结果相近。进一步分析不同临床病理指标间APLP2阳性表达率发现,APLP2阳性表达与肌层浸润、雌激素受体表达、分化程度相关。研究结果提示,在子宫内膜癌中APLP2阳性表达与患者的肌层浸润和分化程度有关,随着肌层浸润程度和分化程度的增加,APLP2阳性表达逐渐降低。同时,本研究亦发现,APLP2阳性表达与子宫内膜癌患者有无淋巴结转移、年龄、FIGO分期、病理类型并无明显关系,这提示APLP2可能与子宫内膜癌的淋巴结转移并无密切关系,不过本研究例数偏少,尚需要进一步研究证实。
目前,在子宫内膜癌患者中以药物联合手术的综合治疗方案取得了显著效果,尤其是一些早期患者的预后得到明显改善。不过临床显示,17%~51%的子宫内膜癌患者会发生远处转移,6%~21%出现局部复发,而复发患者转移是导致子宫内膜癌患者死亡的主要因素[13]。因此,积极探寻反映子宫内膜癌患者病理过程的相关分子标志物,对降低病死率具有重要意义。为了更深入分析APLP2低表达对子宫内膜癌患者术后生存状况的影响,本研究结合随访资料对患者生存率进行了分析。本研究发现,经过6~36个月的随访,38例患者共死亡11例,其中APLP2阳性患者存活5例,死亡6例;而阴性患者存活22例,死亡5例;APLP2阴性患者的存活率明显低于阳性患者。研究结果提示,APLP2低表达的患者其预后较差。不过这一研究结果与既往APLP2在神经肿瘤、胰腺癌等的研究中结论[14]并不一致。其作用机制可能为APLP2存在着多个选择性的剪切位点,能够产生多个相关的转录本,从而出现了APLP2在不同组织中具有不同的功能与表达形式[15,16]。
综上所述,在子宫内膜癌患者中APLP2呈低表达,其低表达与肌层浸润深度和分化程度有关,并可作为患者预后的重要评估指标。不过本研究样本量偏少,在随后的研究中可扩大样本量进一步研究证实,并对其调控机制进行深入分析。
1 曹桂英,朱滔,沈彩糯,等.子宫内膜癌患者的COX-2蛋白及VEGF的表达情况分析.中华全科医学,2015,13:1298-1300.
2 李耀,王兴红.化疗对高危因素子宫内膜癌患者预后及生活质量的影响.中国性科学,2014,23:32-34.
3MaW,ZhangTF,LuP,etal.Partialleastsquaresbasedgeneexpressionanalysisinestrogenreceptorpositiveandnegativebreasttumors.EurRevMedPharmacolSci,2014,18:212-216.
4MilgromSA,KollmeierMA,Abu-RustumNR,etal.PositiveperitonealcytologyishighlypredictiveofprognosisandrelapsepatternsinstageIII(FIGO2009)endometrialcancer.GynecolOnc,2013,130:49-53.
5 肖波,余桂梅.GPR30阳性表达对子宫内膜癌患者预后的影响及其与雌、孕激素受体表达的相关性.安徽医药,2016,20:538-540.
6CousinsSL,DaiW,StephensonFA.APLP1andAPLP2,membersofthe
APPfamilyofproteins,behavesimilarlytoAPPinthattheyassociatewithNMDAreceptorsandenhanceNMDAreceptorsurfaceexpression.JNeurochem,2015,133:879-885.
7MidthuneB,TyanSH,WalshJJ,etal.Deletionoftheamyloidprecursor-likeprotein2 (APLP2)doesnotaffecthippocampalneuronmorphologyorfunction.MolCellNeurosci,2012,49:448-455.
8WeyerSW,KlevanskiM,DelekateA,etal.APPandAPLP2areessentialatPNSandCNSsynapsesfortransmission,spatiallearningandLTP.EMBOJ,2011,30:2266-2280.
9ShariatiSA,LauP,HassanBA,etal.APLP2regulatesneuronalstemcelldifferentiationduringcorticaldevelopment.JCellSci,2013,126:1268-1277.
10VanageG,LuYA,TamJP,etal.Infertilityinducedinratsbyimmunizationwithsyntheticpeptidesegmentsofaspermprotein.BiochemBiophysResCommun,1992,183:538-543.
11PandeyP,RachaganiS,DasS,etal.Amgloidprecuesor-likeprotein(APLP2)offeotsactincytoskeletonandincreasespancreaticcancergrouthandmetastasis.Oncotarget,2015,6:2064-2075.
12 杨思勤,何晓英,田福举,等.APLP2在子宫内膜癌中的表达及其对预后的预测价值.上海交通大学学报医学版.2016,36:38-42,48.
13 徐珍,彭芝兰,曾俐琴,等.358例子宫内膜癌手术方式及影响预后的危险因素分析.实用妇产科杂志,2015,31:274-277.
14PyrzynskaB,Banach-orlowskaM,Teperek-TkaczM,etal.Multifunctimal.ProtinAPPL2contributestosurvivalofhumangliomacells.MolOncol,2013,7:67-84.
15YeoJC,WauAA,LuoL,etal.DistinctrolesforAPPL1andAPPL2inregulatingtoll-likereceptor4singnalinges.Traffic,2016,17:1014-1026.
16 康彩梅,王振芬,杨改中,等.VEGF和Ki-67在子宫内膜癌中的表达及临床意义.河北医药,2015,37:2607-2609.
The changes of expression levels of amyloid precursor-like protein 2 in endometrial carcinoma and its effects on patient’s prognosis
WUYuan.
GeneralHospitalofShandongProvincialYankuangGroup,Shandong,Zoucheng273500,China
Objective To investigate the expression of amyloid precursor-like protein 2(APLP2) in endometrial carcinoma, and to explore its effects on patient’s prognosis in order to provide reference for improving the prognosis of patients.Methods The xpression levels of APLP2 were detected by immunohistochemistry in 38 cases of endometrial carcinoma tissues and 42 cases of normal endometrium tissues.Moreover the clinical data and follow-up results were collected to analyze the correlation between expression of APLP2 and clinical data.Besides these patients were divided into APLP2 positive expression group and APLP2 negative expression group,and the survival status of patients was observed and compared between two groups.Results The positive expression rate of APLP2 in endometrial carcinoma tissues was 28.95%,which was significantly lower than that (85.71%) in normal endometrial tissues (P<0.05).ThepositiveexpressionofAPLP2wascorrelatedwithmuscularlayerinfiltration,estrogenreceptorexpressionanddifferentiationdegreeofendometrialcarcinoma(P<0.05),however,which was not correlated to patien’s age,FIGO staging,pathological type,lymph node metastasis (P>0.05).After6~36monthfollow-up,thesurvivalrateinAPLP2positiveexpressiongroupwas81.48%,whichwassignificantlyhigherthanthat(55.45%)inAPLP2negativeexpressiongroup(P<0.05).Conclusion The low-expression of APLP2 exists in patients with endometrial cancer,which is correlated to muscular layer infiltration and differentiation degree of tumor,moreover,which can be regarded as as an important index to evaluate patient’s prognosis.
endometrial carcinoma;amyloid precursor-like protein 2;immunohistochemistry;estrogen receptor;prognosis
10.3969/j.issn.1002-7386.2017.07.009
273500 山东省邹城市,山东省兖矿集团总医院
R
A
1002-7386(2017)07-0995-04
2016-10-22)

