免疫球蛋白轻链在糖尿病肾病中的变化及意义
崔 雪,杨 林,李 娟,马利霞
(河北医科大学第二医院 肾内科,河北 石家庄 050000)
·论著·
免疫球蛋白轻链在糖尿病肾病中的变化及意义
崔 雪,杨 林,李 娟,马利霞
(河北医科大学第二医院 肾内科,河北 石家庄 050000)
目的 探讨血清游离轻链 (freelightchains,FLCs)与糖尿病肾病(DN)患者的临床指标及肾病理病变的关系。方法 选取肾内科住院,并经肾活检诊断的DN患者40例为试验组,非DN患者40例为对照组,两组患者均除外慢性炎症性疾病。记录患者血肌酐、尿蛋白、超敏C反应蛋白(hs-CRP)、同型半胱氨酸(homocysteine,Hcy)等临床指标。应用间接免疫荧光法检测各肾标本中λFLC及κFLC的表达情况,并记录其光镜下肾脏病变情况。测定各患者λFLC及κFLC浓度。探讨FLCs与DN患者临床指标及肾病理病变的关系。 结果 试验组入院时hs-CRP及Hcy均高于对照组(P<0.05)。与对照组相比,试验组血清cFLC(combinedfreelightchain,cFLC)(κFLC与λFLC之和)水平明显升高(P<0.05)。临床指标与cFLC进行相关性分析,结果显示Hcy、hs-CRP与cFLC呈正相关(P<0.05),病理学指标与cFLC进行相关性分析,DN肾间质小管病变评分与cFLC水平呈正相关(P<0.05),与eGFR呈负相关(P<0.05)。结论FLCs可能可以作为预测DN患者死亡风险,尤其是预测心血管疾病风险的指标,并可以作为DN患者疾病进展的评估指标。
糖尿病肾病;免疫球蛋白轻链;心血管疾病;死亡;危险因素
糖尿病肾病(diabeticnephropathy,DN)已逐渐成为发达国家及发展中国家慢性肾衰竭的最常见病因之一,且发生率呈逐年上升趋势[1-2]。患者的死亡(尤其是心血管病变引起)及进展至终末期肾病(end-stagerenaldisease,ESRD)的风险比非慢性肾脏病(chronickidneydisease,CKD)患者明显增大,并且DN的严重程度与其心血管事件概率是呈正相关[3]。血清游离轻链(freelightchains,FLCs)是由B细胞产生的免疫球蛋白的组成部分,最近几年越来越多的研究发现其在炎症反应中的作用,并推测其可能成为免疫性疾病中炎症反应的预测性指标[4]。cFLC(combinedfreelightchain,cFLC)水平在慢性炎症及肾功能不全状态下会升高[5],而这两种状态正是2型糖尿病所具有的重要病生理状态及其可能造成的主要靶器官损害之一。有研究发现cFLC水平也许可以预测糖尿病患者心血管疾病(CVD)风险,本研究旨在观察cFLC与DN患者的临床指标及肾病理病变的关系及其意义。
1 资料与方法
1.1 病例选择 选取2014年2月至2015年7月在河北医科大学第二医院肾内科住院,并经肾活检诊断的DN患者40例为试验组,非DN患者40例为对照组,留取肾组织冰冻切片备用。入选标准:①年龄>18周岁;②肾病理诊断为DN。排除标准:系统性红斑狼疮、类风湿性关节炎、过敏性皮肤炎、哮喘、鼻炎、食物过敏、特发性肺间质纤维化、过敏性肺炎、慢性阻塞性肺疾病、炎症性肠病、多发性硬化、结核、骨髓炎。
1.2 方法
1.2.1 光镜观察 根据DN的病理诊断标准[6]对经过碘酸-银-乌洛托品(periodicacid-silver-meth-enamine,PASM) +Masson染色的标本进行光镜病理学诊断。
1.2.2 间接免疫荧光法观察λFLC、κFLC的表达及分布 4μm厚的肾组织冰冻切片,经10%正常牛血清白蛋白室温封闭20分钟,λFLC抗体、κFLC抗体(1:200,北京中杉金桥生物制剂公司)恒温水浴箱(37 ℃)孵育60分钟。异硫氰酸荧光素(FITC) 标记山羊抗小鼠IgG(北京中杉金桥生物制剂公司) 37 ℃孵育60分钟。荧光显微镜下观察并记录结果,用数码相机拍照。
1.2.3 肾组织病理学检查 肾活检组织用福尔马林-醋酸-酒精固定液(FAA)固定过夜,常规脱水、浸蜡、包埋、切片(2μm),作PASM+Masson染色。显微镜下观察并记录病变情况。
1.2.4 患者血清标本收集 获得所有受试者知情同意,嘱其采血前日19:00以后禁食水,并于次日清晨7:00用促凝管采取肘静脉血8ml,在离心机中以4 000r/min速度离心15分钟后,分离血清,置于-70 ℃冰箱内保存备用。待所有受试对象血清收集完全,应用酶联免疫试剂盒(ELISA)试剂盒测定其λFLC及κFLC浓度。
1.2.5 临床指标检测 记录患者年龄、性别、吸烟史及血压最高值,采用患者入院后首次检测结果,记录血红蛋白、糖化血红蛋白、血电解质、血肌酐、血脂、血白蛋白、尿蛋白、超敏C反应蛋白(hs-CRP)、同型半胱氨酸(homocysteine,Hcy)等临床指标,并根据患者血肌酐值应用CKD-EPI公式计算患者肾小球滤过率估计值(eGFR)。
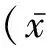
2 结 果
2.1 临床资料结果 试验组收缩压显著高于对照组,两组舒张压比较差异无统计学意义。试验组肾功能平水平较对照组差,eGFR明显低于对照组。两组血脂、电解质指标比较差异无统计学意义。两组近期均无感染情况,入院时测hs-CRP均在我院标准正常范围内(0~8mg/L),试验组显著高于对照组。试验组Hcy高于对照组。试验组糖尿病病史平均7.5年,入院后查糖化血红蛋白>7%的比例为53%,眼底情况检查率为70%,其中存在糖尿病视网膜病变的比例为59%。见表1。
2.2ELISA检测结果 血清游离轻链的正常值[7]:血清κFLC3.3~19.4mg/L;λFLC5.7~26.3mg/L;κ/λ比值0.26~1.65,cFLC水平为κFLC与λFLC之和,试验组水平与对照组相比明显升高。见表1。
2.3 肾组织病理情况
2.3.1 冰冻切片免疫荧光结果DN标本中,表达位置主要位于肾小球系膜区(图1、2);膜性肾病标本中,表达位置主要位于肾小球血管壁;IgA肾病标本中,表达位置主要位于肾小球系膜区,两种轻链的表达位置无差异。
2.3.2 石蜡切片光镜结果 试验组按DN病理诊断分型标准,Ⅰ级DN4例,Ⅱ级DN16例,Ⅲ级DN16例,Ⅳ级DN4例,对照组膜性肾病10例,IgA肾病10例,肾小球微小病变及局灶节段性肾小球硬化各10例。试验组肾小球硬化率比例明显高于对照组。在试验组中,不同DN级别间的肾小球硬化率相互比较,Ⅳ级与Ⅰ、Ⅱ、Ⅲ级DN之间的差别有统计学意义,Ⅰ、Ⅱ、Ⅲ级这3组之间差异无统计学意义。试验组肾小管萎缩程度及动脉硬化比例较对照组严重,根据DN肾间质小管病变评分标准,Ⅰ级DN评分2~4分,Ⅱ级DN评分2~5分,Ⅲ级DN评分4~6分,Ⅳ级DN评分5~7分,DN4个分级间间质小管病变评分、cFLC差异无统计学意义。
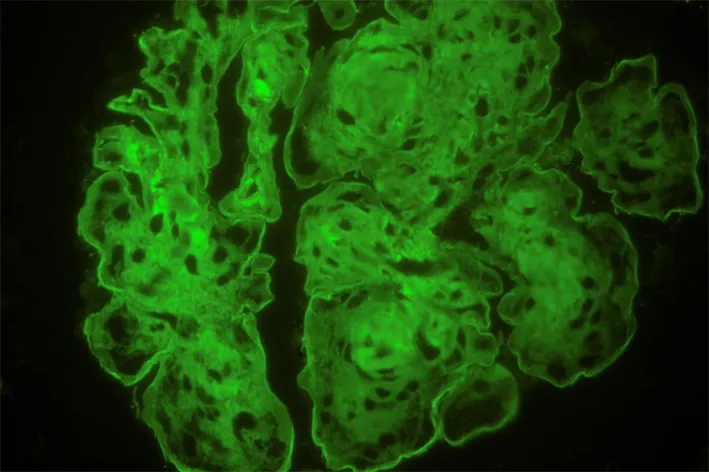
图1 DN患者κFLC荧光图像 (免疫荧光×400)
图2 DN患者λFLC荧光图像 (免疫荧光×400)
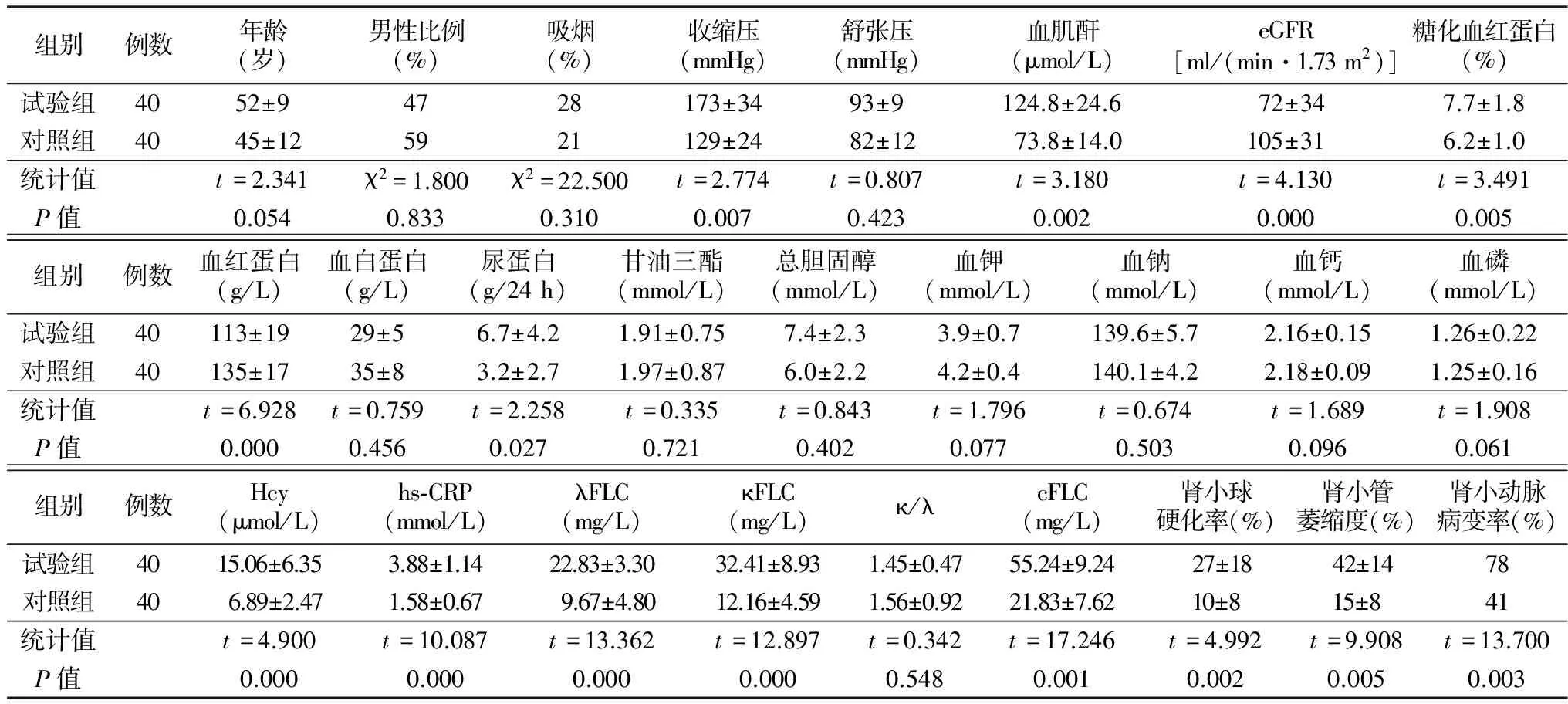
组别例数年龄(岁)男性比例(%)吸烟(%)收缩压(mmHg)舒张压(mmHg)血肌酐(μmol/L)eGFR[ml/(min·1.73m2)]糖化血红蛋白(%)试验组4052±94728173±3493±9124.8±24.672±347.7±1.8对照组4045±125921129±2482±1273.8±14.0105±316.2±1.0统计值t=2.341χ2=1.800χ2=22.500t=2.774t=0.807t=3.180t=4.130t=3.491P值0.0540.8330.3100.0070.4230.0020.0000.005组别例数血红蛋白(g/L)血白蛋白(g/L)尿蛋白(g/24h)甘油三酯(mmol/L)总胆固醇(mmol/L)血钾(mmol/L)血钠(mmol/L)血钙(mmol/L)血磷(mmol/L)试验组40113±1929±56.7±4.21.91±0.757.4±2.33.9±0.7139.6±5.72.16±0.151.26±0.22对照组40135±1735±83.2±2.71.97±0.876.0±2.24.2±0.4140.1±4.22.18±0.091.25±0.16统计值t=6.928t=0.759t=2.258t=0.335t=0.843t=1.796t=0.674t=1.689t=1.908P值0.0000.4560.0270.7210.4020.0770.5030.0960.061组别例数Hcy(μmol/L)hs⁃CRP(mmol/L)λFLC(mg/L)κFLC(mg/L)κ/λcFLC(mg/L)肾小球硬化率(%)肾小管萎缩度(%)肾小动脉病变率(%)试验组4015.06±6.353.88±1.1422.83±3.3032.41±8.931.45±0.4755.24±9.2427±1842±1478对照组406.89±2.471.58±0.679.67±4.8012.16±4.591.56±0.9221.83±7.6210±815±841统计值t=4.900t=10.087t=13.362t=12.897t=0.342t=17.246t=4.992t=9.908t=13.700P值0.0000.0000.0000.0000.5480.0010.0020.0050.003
2.4 各组指标间相关性分析 临床指标与cFLC进行相关性分析,收缩压、血肌酐、糖化血红蛋白、Hcy、hs-CRP与cFLC呈正相关,eGFR、血红蛋白与cFLC呈负相关(表2)。病理学指标与cFLC进行相关性分析,随着肾小球硬化比例及肾小管萎缩程度的加重,cFLC水平逐渐升高。DN肾间质小管病变评分与cFLC水平呈正相关,肾间质小管病变较重时,cFLC水平相对较高,见表3。
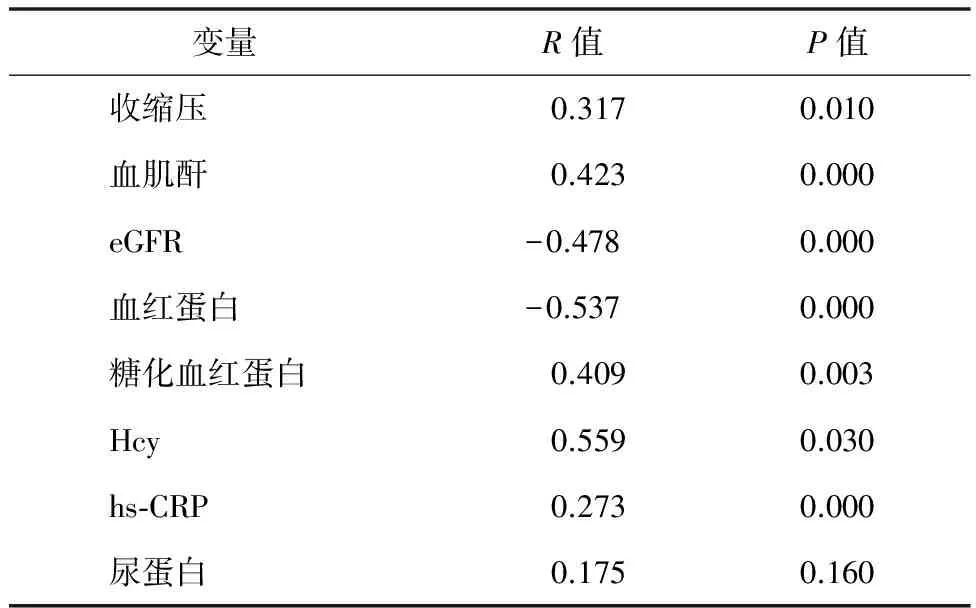
表2 临床指标与cFLC的相关性分析
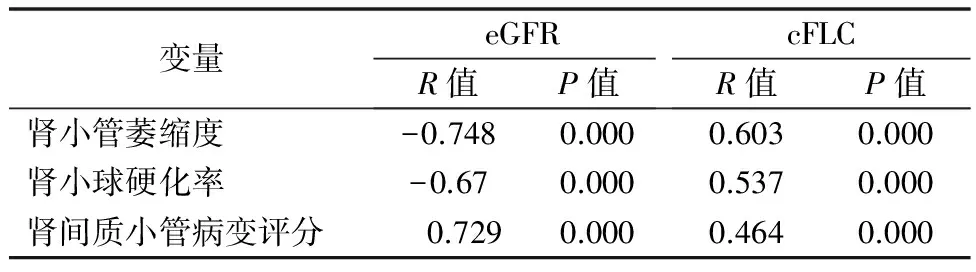
表3 试验组肾脏病理数据与其eGFR及cFLC的相关性分析
3 讨 论
CKD是人类死亡的重要危险因素之一,人们一直在研究是否存在一些生物标志物可以预测普通人群及CKD人群心血管事件的发生风险[8]。人们一直致力于找到一种能在疾病早期即可预测CVD风险的指标,从而采取更积极的措施来降低事件的发生率,从而降低人群病死率。C反应蛋白(CRP)是在检测中较为常用的指标,作为机体急性反应时相的标志物,是评价普通人群及CKD患者炎症反应的一个可靠指标[9-11]。现有的超敏检测技术可以检测人体内低浓度的CRP,即hs-CRP,它可以作为冠脉事件的预测指标[12],当血浓度hs-CRP>3mg/L时,其可以作为其冠脉事件风险的标志[13]。一项研究2型糖尿病患者FLC与其CVD风险的相关研究指出[14],FLC在预测CVD风险方面比CPR更可靠,且在经胰岛素应用史、他汀类及血管紧张素转化酶抑制剂(ACEI)类药物应用史矫正后,cFLC仍有统计学意义。其他涉及CRP及FLC的研究显示,FLC比CRP的关联性更强。研究发现可以将FLC作为一系列死亡危险因素的生物标志物[15]。本研究证实DN患者比其他类型CKD患者的cFLC和收缩压水平高,cFLC与hs-CRP、收缩压之间存在线性相关,FLC可能可以作为DN患者CVD风险的预测指标。
Hcy是甲硫氨酸代谢过程中产生的一种含硫氨基酸,目前被认为是动脉粥样硬化及血栓性疾病等心脑血管疾病的独立危险因素[16]。作为心血管病变的独立危险因素,Hcy可能也参与了CKD患者的心血管病变[17-18]。肾脏是Hcy合成及代谢的一个主要场所。肾小球滤过率减少或者肾小管上皮细胞代谢障碍会对血液中的Hcy的浓度会产生一定影响。研究表明,Hcy水平的升高和eGFR下降密切相关, 因此Hcy被认为是CKD患者病情进展的独立危险因素[19]。过高的hs-CRP及Hcy均与CKD的高风险相关,有可能成为成年CKD患者风险的有效评估指标[20]。本研究结果显示,随着Hcy水平的升高,cFLC水平升高,eGFR水平下降。
CKD患者肾功能损伤的程度与肾小球病变程度有关,但是与间质小管损伤程度相关性更好[21]。这是因为间质小管损伤的程度与蛋白尿的水平是相关的。在超负荷蛋白的肾病综合征状态下,间质小管病变是标志性损伤[22]。Zoja等[23]研究发现,蛋白尿对近端肾小管上皮细胞(proximaltubularepithelialcell,PTEC)有促炎及促纤维化的作用。当FLC不能完全被肾小管重吸收时,长时间则会造成小管间质的损伤。FLCs在PTEC内吞后,经一系列作用,再次进入血液循环,诱导白细胞介素(IL)6、IL-8及单核细胞趋化因子1(MCP-1)等炎症因子的释放,促进间质纤维化。FLCs还可促进上皮细胞表型转换为肌成纤维细胞。FLCs进入上皮细胞的同时,会促进细胞内过氧化氢(hydrogenperoxide,H2O2)的生成及靶向攻击,进一步诱导核因子(NF)κB成为激活状态,促进炎症因子的表达,进而释放入血。炎症细胞的聚集,促进了间质纤维化的进展。同时当小管上皮细胞暴露于一定浓度的轻链环境中时,某些炎症因子,如MCP、IL、α平滑肌肌动蛋白(α-SMA)、转化生长因子(TGF)等会促进上皮细胞间充质转化,促进间质纤维化的发生[24]。这些反应是蛋白尿(包括DN)患者间质小管损伤及肾脏功能衰竭的关键因素。
肾小球病变一直被认为是DN最主要的特征,但肾小管萎缩与间质纤维化也参与了疾病的进展, 且与肾功能下降密切相关[25]。多项研究结果表明,间质纤维化的程度与肾小球球性废弃比例一样, 均与高血压、蛋白尿相关,并与GFR呈负相关。本研究的结果也支持上述观点。小管间质损伤主要是通过其炎症因子的分泌及细胞骨架蛋白的改变造成肾脏损伤[26]。DN的肾间质组织中主要是单核细胞、巨噬细胞、肥大细胞及T细胞浸润。这些细胞与作用于血管的肽类物质及生长因子紧密结合,造成局部组织损伤。肾小管间质的病变可能在肾功能不全患者进展至ESRD中占据更主要的决定作用。本研究结果提示cFLC与间质小管病变及小球硬化比例之间存在相关性,故推测其可以用于评价DN肾脏病情,对于DN预后的评估提供更可靠地依据。
综上所述,DN血清游离轻链与hs-CRP、Hcy呈正相关,与eGFR呈负相关,可能可以作为预测DN患者死亡风险,尤其是预测CVD风险的指标。血清游离轻链与其肾间质小管病变程度呈正相关,可以作为DN患者疾病进展的评估指标。本试验为横断面研究且样本量较小,需要进一步随访,前瞻观察患者病情进展及并发症情况来支持实验结论。
[1]VasavadaN,AgarwalR.Roleofoxidativestressindiabeticnephropathy[J].AdvChronicKidneyDis, 2005, 12(2):146-154.
[2]deBoerIH,RueTC,HallYN,etal.TemporaltrendsintheprevalenceofdiabetickidneydiseaseintheUnitedStates[J].JAMA, 2011, 305 (24):2532-2539.
[3]DineenSF,GersteinHC.Theassociationofmicroalbuminuriaandmortalityinnon-insulin-dependentdiabetesmellitus.Asystematicoverviewoftheliterature[J].ArchInternMed, 1997,157(13):1413-1418.
[4]RitchieJ,AssiLK,BurmeisterA,etal.AssociationofserumIgfreelightchainswithmortalityandESRDamongpatientswithnondialysis-dependentCKD[J].ClinJAmSocNephrol, 2015,10(5): 740-749.
[5]HutchisonCA,HardingS,HewinsP,etal.Quantitativeassessmentofserumandurinarypolyclonalfreelightchainsinpatientswithchronickidneydisease[J].ClinJAmSocNephrol, 2008,3(6):1684-1690.
[6]TervaertTW,MooyaartAL,AmannK,etal.Pathologicclassificationofdiabeticnephropathy[J].AmSocNephrol,2010,21(4):556-563.
[7]KatzmannJA,ClarkRJ,AbrahamRS,etal.Serumreferenceintervalsanddiagnosticrangesforfreekappaandfreelambdaimmunoglobulinlightchains:relativesensitivityfordetectionofmonoclonallightchains[J].ClinChem,2002,48(9): 1437-1444.
[8]VickeryS,WebbMC,PriceCP,etal.Prognosticvalueofcardiacbiomarkersfordeathinanon-dialysischronickidneydiseasepopulation[J].NephrolDialTransplant, 2008,23(11): 3546-3553.
[9]GargAX,BlakePG,ClarkWF,etal.Associationbetweenrenalinsufficiencyandmalnutritioninolderadults:resultsfromtheNHANESIII[J].KidneyInt,2001,60(5):1867-1874.
[10]ShlipakMG,FriedLF,CrumpC,etal.Elevationsofinflammatoryandprocoagulantbiomarkersinelderlypersonswithrenalinsufficiency[J].Circulation,2003,107(1):87-92.
[11]HsuHJ,YenCH,HsuKH,etal.Chronickidneydiseasestageisamodulatorontheassociationbetweenhigh-sensitivityC-reactiveproteinandcoronaryvasospasticangina[J].ScientificWorldJournal, 2014,2014:852507.
[12]RidkerPM.ClinicalapplicationofC-reactiveproteinforcardiovasculardiseasedetectionandprevention[J].Circulation, 2003,107(3):363-369.
[13]PearsonTA,MensahGA,AlexanderRW,etal.Markersofinflammationandcardiovasculardisease:applicationtoclinicalandpublichealthpractice:astatementforhealthcareprofessionalsfromthecentersfordiseasecontrolandpreventionandtheAmericanHeartAssociation[J].Circulation, 2003,107(3):499-511.
[14]AnandramS,AssiLK,LovattT,etal.Elevated,combinedserumfreelightchainlevelsandincreasedmortality:A5-yearfollow-up,UKstudy[J].JClinPathol, 2012,65(11): 1036-1042.
[15]BellaryS,FaintJM,AssiLK,etal.Elevatedserumfreelightchainspredictcardio-vasculareventsintype2diabetes[J].DiabetesCare,2014,37(7): 2028-2030.
[16]ClarkeR,DalyL,RobinsonK,etal.Hyperhomocysteinemia:anindependentriskfactorforvasculardisease[J].NEnglJMed,1991, 324(17): 1149-1155.
[17]LeviA,CohenE,LeviM,etal.Elevatedserumhomocysteineisapredictorofaccelerateddeclineinrenalfunctionandchronickidneydisease:ahistoricalprospectivestudy[J].EurJInternMed,2014,25(10):951-955.
[18]PotterK,HankeynGJ,GreenDJ,etal.Homocysteineorrenalimpairment:whichistherealcardiovascularriskfactor[J].ArteriosclerThrombVascBiol,2008,28(6):1158-1164.
[19]ChuangCH,LeeYY,SheuBF,etal.HomocysteineandC-reactiveproteinasusefulsurrogatemarkersforevaluatingCKDriskinadults[J].KidneyBloodPressRes,2013,37(4-5):402-413.
[20] 程清.脂蛋白相关磷脂酶A2和同型半胱氨酸水平与动脉粥样硬化性心脑血管疾病关系的研究[J].检验医学,2015,30(1): 40-43.
[21]NathKA.Tubulointerstitialchangesasamajordeterminantintheprogressionofrenaldamage[J].AmJKidneyDis, 1992,20(1):1-17.
[22]EddyAA,McCullochL,LiuE,etal.Arelationshipbetweenproteinuriaandacutetubulointerstitialdiseaseinratswithexperimentalnephroticsyndrome[J].AmJPathol, 1991,138(5):1111-1123.
[23]ZojaC,MorigiM,FigliuzziM,etal.Proximaltubularcellsynthesisandsecretionofendothelin-1onchallengewithalbuminandotherproteins[J].AmJKidneyDis, 1995,26(6):934-941.
[24]BasnayakeK,StringerSJS,HutchisonCAC,etal.Thebiologyofimmunoglobulinfreelightchainsandkidneyinjury[J].KidneyInt, 2011,79(12): 1289-1301.
[25]TangSC,LeungJC,LaiKN.Diabetictubulopathy:anemergingentity[J].ContribNephrol,2011,170:124-134.
[26]SanaiT,SobkaT,JohnsonT,etal.Expressionofcytoskeletalproteinsduringthecourseofexperimentaldiabeticnephropathy[J].Diabetologia, 2000,43(1):91-100.
Changesandsignificanceofimmunoglobulinlightchainindiabeticnephropathy
CuiXue,YangLin,LiJuan,MaLixia
DepartmentofNephrology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
Correspondingauthor:YangLin,Email:yanglin2943@163.com
ObjectiveToinvestigatetherelationshipsamongserumfreelightchains(FLCs)andclinicalindicatorsandrenalpathologicalchangesofdiabeticnephropathy(DN).MethodsFortyDNpatientsand40non-DNpatientswereenrolled.Theparticipantsweredividedintoexperimentandcontrolgroup,butchronicinflammatorydiseasewasexclued.Serumcreatinine,urinaryprotein,hs-CRPandHcywereobserved.TheλFLCandκFLCweredetectedbyindirectimmunofluorescence.Furthermore,weobservedtherenalpathologicalchangesbylightmicroscope.TheλFLCandκFLCweredeterminedthroughELISA.UnivariateanalysiswasusedtoexaminetherelationshipsbetweenFLCsandclinicalindicatorsandrenalpathologicalchangesofDN.ResultsTheexperimentgrouphadhigherhsCPRandHcylevelthanthecontrolgroup(P<0.05).ThelevelsofcFLC(ThesumofλFLCandκFLC)intheexperimentgroupwerehighercomparedwiththecontrolgroup(P<0.05).TheHcyandhs-CRPwerepositivelycorrelatedwithcombinedfreelightchain(cFLC) (P<0.05).Thescoresoftubulointerstitiallesionsshowedpositivecorrelations(P<0.05)withcFLC,butnegativelycorrelatedwitheGFR(P<0.05).ConclusionThelevelofcFLCcouldbeapredictoroftheriskofmortality(especiallycardiovasculardiseasecaused)ofDNpatientsandtheprogressionofDN.
diabeticnephropathies;immunoglobulinlightchains;cardiovasculardiseases;death;riskfactors
杨林,Email:yanglin2943@163.com
R
A
1004-583X(2017)04-0305-05
10.3969/j.issn.1004-583X.2017.04.008
2016-10-26 编辑:张卫国

