4种常用抗生素对莱茵衣藻生长及光化学活性的影响
姜 思,刘莹莹,佟少明
(1.辽宁师范大学生命科学学院,辽宁大连116081;2.辽宁省植物生物工程重点实验室,辽宁大连116081)
4种常用抗生素对莱茵衣藻生长及光化学活性的影响
姜 思1,2,刘莹莹1,2,佟少明1,2
(1.辽宁师范大学生命科学学院,辽宁大连116081;2.辽宁省植物生物工程重点实验室,辽宁大连116081)
采用4种不同浓度的抗生素对(氨苄青霉素(Amp)、卡那霉素(Kan)、氯霉素(Cmp)及四环素(Tet))莱茵衣藻(Chlamydomonasreinhardtii)进行无菌化处理,研究抗生素种类及浓度对莱茵衣藻的细胞密度、叶绿素a含量及光化学活性的影响,以确定对莱茵衣藻细胞无害并能抑制伴杂菌生长的抗生素种类及使用浓度。结果表明:低于100 μg/mL的氨苄青霉素(Amp)及20 μg/mL的氯霉素(Cmp)处理,会使莱茵衣藻的细胞密度及叶绿素a的含量增加,卡那霉素(Kan)及四环素(Tet)各浓度的处理都会使细胞密度及叶绿素a的含量下降,并呈现抗生素的剂量依赖效应;50 μg/mL的Amp及10 μg/mL的Cmp在处理3 d后会增加莱茵衣藻的实际光合效率(YII)及相对电子传递效率(rETR),而后下降;Kan及Tet各浓度的处理都会使YII及rETR显著下降。结合4种抗生素对莱茵衣藻伴生菌的抑菌实验结果,表明在4种抗生素中,Cmp在抑菌范围内并不会明显地抑制莱茵衣藻细胞的生长与光化学活性,可用于莱茵衣藻细胞无菌化培养中。
莱茵衣藻;抗生素;微藻;光化学活性
莱茵衣藻(Chlamydomonasreinhardtii)隶属于绿藻门、团藻目、衣藻属,为低等的具鞭毛单细胞水生植物,广泛分布在海洋、江河、湖泊等水域,通过光合作用获得能量,也可以在有碳源的完全黑暗的环境中生长。高度的适应性、快速的传代能力及其至关重要的代谢途径使得莱茵衣藻成为生物学研究领域的模式生物,常被用作研究真核生物鞭毛的组装、基体功能及功能障碍等病理效应的模型。莱茵衣藻所含有的核、叶绿体及线粒体三套基因组,目前均已完成了测序,极大地促进了藻类代谢、叶绿体生物起源、光合作用机制、营养元素胁迫以及产氢等方面的研究。
微藻的无菌培养和保存是研究微藻生理、生化、营养、药理学及毒理学等必不可少的步骤之一,也是基础和关键环节。在微藻培养过程中,由于藻种常伴有杂藻或杂菌,而无法准确进行藻间或藻菌相互作用、兼养和异养等方面的研究。抗生素可抑制水生细菌的繁殖,在除菌、抑菌方面表现出了强大作用,利用微藻比杂菌具有对抗生素更强的耐受性,选择使用一种或多种抗生素进行无菌处理则较容易获得无菌藻系。如孙雯等采用了8种常用抗生素对雨生红球藻(Haematococcuspluvialis)进行无菌化处理,结果表明:在培养前期加入灰黄霉素的抑菌效果最好,且对雨生红球藻细胞的生长抑制最小;培养中后期添加青霉素的抑菌效果较明显;混合使用灰黄霉素和青霉素时抑菌效果明显优于使用单一抗生素。目前,国内外有关微藻无菌化培养及对抗生素敏感性研究的报道相对较少,主要集中在绿藻、颤藻、螺旋藻及紫球藻等方面。
本研究中,笔者根据抗生素在抗菌机制和抗菌谱上的差别,选择了常用的4种抗生素,氨苄青霉素(ampicillin,Amp)、卡那霉素(kanamycin,Kan)、氯霉素(chloramphenicol,Cmp)及四环素(tetracycline,Tet)应用于莱茵衣藻的培养中,通过生长曲线、叶绿素a含量、光化学活性等指标来探究每种抗生素的存在浓度与莱茵衣藻的生长和光化学活性之间的联系,确定分离及纯化莱茵衣藻时对藻细胞无害、同时又能抑制伴生杂菌生长的抗生素种类及浓度,以期为莱茵衣藻无菌系的建立提供理论支持。
1 材料与方法
1.1 藻种及培养
莱茵衣藻(C.reinhardtii)购自中国科学院野生生物种质库,使用TAP(tris acetate phosphate)液体培养基,其成分按文献配制,培养温度为(25±1) ℃,光照强度为60 μmol/(m·s),光暗时间比为12∶ 12。培养过程中每天摇动培养瓶数次,防止微藻附壁下沉,待进入指数生长期时,将其按5×105个/mL的密度接种后,用抗生素处理,然后测定分析微藻的相关生理指标。在藻种传代培养过程中,严格按照无菌操作规程进行,细菌培养使用LB固体培养基。
1.2 实验方法
1.2.1 藻细胞密度测定
将4种抗生素分别加入到处于指数生长期的莱茵衣藻藻液中,各抗生素的终浓度分别设定4个梯度(表1),以未加入抗生素的藻液作为对照组。采用血球计数板计数,每天定时吸取少量摇匀的藻液,置于视野为40×10倍的光学显微镜下观察,记录藻细胞总数。
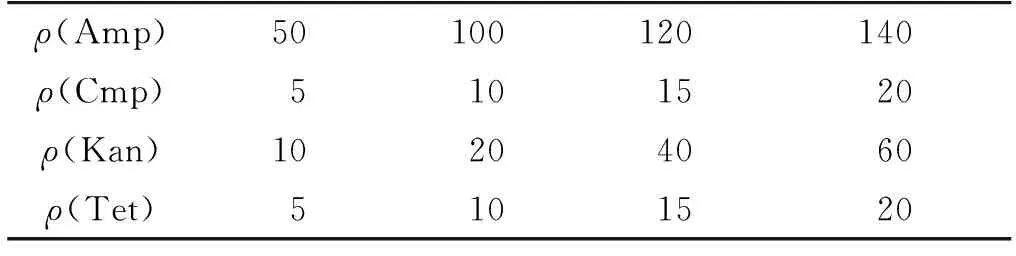
表1 4种抗生素的质量浓度
1.2.2 叶绿素a含量的测定
4种不同浓度的抗生素处理指数生长期的藻液时,每天每个处理组各取5 mL的藻液,以6 000 r/min离心10 min,去除上清液后,将藻细胞用90%丙酮在黑暗条件下提取2次,每次24 h,最后将提取液定容至10 mL,使用紫外分光光度计在750、663、645和630 nm下测定吸光度。
1.2.3 叶绿素荧光参数的测定
利用多激发波长调制叶绿素荧光仪(德国,Walz)测定藻细胞的光化学活性[10]。不同种类及浓度的抗生素处理后,每天取样,测定荧光参数。检测过程如下:首先将处于指数生长期的莱茵衣藻培养液黑暗处理12 h,然后取2 mL藻液加入石英杯中,设置检测光(measure light,ML)波长为440 nm,并将实时荧光(current fluorescence level)Ft调至1.5,运行脚本sigma 500 chl并进行O-I1拟合,保存莱茵衣藻光学截面积数据,在sp-analysis模式下进行快速光曲线测定,将保存的光学截面积数据应用于快速光曲线,最后在view-mode模式下,记录叶绿素荧光的初始值(F0)及最大值(Fm)、实际光量子产额(YII)及相对电子传递效率(rETR)。
1.3 抗生素对莱茵衣藻伴生细菌的抑制作用
采取平板涂布结合取样镜检的方法,对经抗生素处理7 d后的藻液中存在的细菌数目进行检验。实验中,将处理组和对照组藻液用TAP液体培养基稀释100倍后,涂布在LB固体培养基平板上,37 ℃培养温箱中过夜培养24 h以上,直至长出菌落为止,根据单菌落的数目确定藻液中细菌的密度。
1.4 数据统计分析
各实验组和对照组均设置3个平行处理,取平均值(Mean±SD)。以T检验比较对照组与实验组之间的差异显著性,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与讨论

图1 不同浓度的Amp(a)、Cmp(b)、Kan(c)及Tet(d)处理对莱茵衣藻生长的影响Fig.1 Effects of Amp (a),Cmp (b),Kan (c) and Tet(d) at different concentration on growth of C. reinhardtii
目前,用于微藻无菌化处理研究所使用的抗生素种类多样,但针对于不同微藻所使用的抗生素种类及其施加剂量不同,其抑菌的效果也不同。抗生素既可以通过与微藻的某些成分结合,直接作用于藻体,从而改变微藻的生理生化性质,造成微藻生长状态的改变,又可以通过抑制与微藻共生的伴生菌的生长,从而间接影响藻类的生长[11]。本研究根据抗生素在抗菌机制和抗菌谱上的差别,选择了基因工程中常用的4种抗生素Amp、Cmp、Kan及Tet应用于莱茵衣藻的无菌化研究,通过生长曲线、叶绿素a含量、光化学活性等指标并结合4种抗生素的抑菌效果来探究4种抗生素对莱茵衣藻生长及光合作用的影响。
2.1 不同抗生素对莱茵衣藻生长的影响
经抗生素处理7 d后,莱茵衣藻生长状况如图1所示。由图1(a)可知:当Amp的处理质量浓度为50及100 μg/mL时,对莱茵衣藻的生长有显著的促进作用(P<0.05),其中100 μg/mL促进生长的效果高于50 μg/mL;当Amp处理质量浓度为120 μg/mL时,对莱茵衣藻的生长有轻微的抑制作用;当处理质量浓度达到140 μg/mL时,则显著抑制莱茵衣藻的生长(P<0.05)。由图1(b)可知:不同浓度的Cmp处理对莱茵衣藻的生长均有显著促进作用;当Cmp质量浓度为5 μg/mL时,就表现出明显的促进作用(P<0.05),浓度越高,促进生长的效应越显著。由图1(c)可知:当Kan的处理质量浓度为10 μg/mL时,对莱茵衣藻的抑制作用已达到显著(P<0.05),7 d后,藻液变黄,当Kan的终质量浓度为20 μg/mL时,极显著抑制莱茵衣藻的生长 (P<0.01),藻液7 d后变透明,镜检结果显示藻细胞内部中空,几乎全部死亡。由图1(d)可知:Tet质量浓度为5 μg/mL时,表现出对莱茵衣藻的生长具有显著抑制作用(P<0.05),随着Tet浓度的增加,抑制莱茵衣藻生长的作用更加明显,藻液颜色逐渐变黄并且加深,7 d后镜检结果显示,藻细胞内部中空,几乎全部死亡。
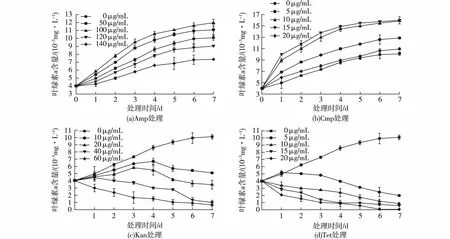
图2 不同浓度的Amp(a)、Cmp(b)、Kan(c)及Tet(d)处理对莱茵衣藻叶绿素a含量的影响Fig.2 Effects of Amp (a),Cmp (b),Kan (c) and Tet(d) at different concentration on the content Chl a of C. reinhardtii
不同抗生素对于微藻的毒性效应有所不同,而不同微藻种类对于抗生素的敏感性也有差异。在先前的研究中发现,氨苄青霉素、卡那霉素及链霉素的质量浓度都小于200 μg/mL时,对绿色巴夫藻(Pavlovaviridis) 的生长有显著促进作用,而在质量浓度分别低于800、500及200 μg/mL 时,对米氏凯伦藻(Kareniamikimotoi)有促进作用,但如果分别高于此质量浓度,则表现出显著的抑制作用,可见不同藻类对于不同抗生素及不同的质量浓度的响应程度及阈值都存在较大差异[12]。在本研究中,4种抗生素处理对莱茵衣藻的细胞密度存在着较大差异,Amp的低浓度(50和100 μg/mL)处理及Cmp各浓度(低于20 μg/mL)的处理,促使藻细胞密度增加,表明低浓度的Cmp和Amp基本上对莱茵衣藻细胞无毒性,另外,由于抗生素的加入会杀死藻液中的部分抑生菌,从而促使藻细胞生长的速度加快;Kan及Tet各浓度的处理,都会抑制藻细胞密度的增加,处理的后期会完全杀死藻细胞。对于莱茵衣藻等绿藻来说,诸如Amp等抑制细菌细胞壁合成的β-内酰胺类的抗生素对藻细胞基本无毒性,而诸如Kan、Tet及Cmp等抑制蛋白质合成作用的抗生素对藻细胞具有较高的毒性,但在本研究中,低浓度的Cmp(低于20 μg/mL)却没有表现出对莱茵衣藻的毒性,可能是因为抑制蛋白质合成的抗生素主要通过与原核生物线粒体的小亚基结合来抑制其生长及繁殖,在微藻等光合生物中,由于叶绿体在结构上与线粒体相似,这类抗生素可能与叶绿体作用,从而抑制蛋白质合成等代谢过程[13]。而Cmp主要和细菌中的核糖体50S大亚基结合,抑制肽酰转移酶的活性,从而阻止蛋白质的合成,并最终导致细胞死亡,可能是因为Cmp在莱茵衣藻细胞内没有相应的结合位点,从而导致无毒性或者毒性不明显。鉴于原核和真核细胞还存在着本质上的差别,因此抗生素的抑菌作用机制在绿藻等真核细胞内并非和原核生物是直接对应的,其抗生素和微藻之间相互作用的机制还有待进一步研究。
2.2 不同抗生素对莱茵衣藻叶绿素a含量的影响
不同种类及浓度的抗生素处理过程中,叶绿素a含量的变化如图2所示。由图2(a)可知:当Amp的处理质量浓度为50及100 μg/mL时,莱茵衣藻的叶绿素a含量显著高于未处理组,其中100 μg/mL的Amp的处理含量增加得更明显;当藻液中Amp终质量浓度为120及140 μg/mL时,莱茵衣藻的叶绿素a的含量低于对照组。由图2(b)可知:不同浓度的Cmp处理都会显著提高莱茵衣藻中叶绿素a的含量,但当质量浓度为20 μg/mL时,叶绿素含量低于5 μg/mL的处理组,但略高于对照组。由图2(c)可知:各浓度的处理,莱茵衣藻的叶绿素a含量都显著低于对照组,4 d后,叶绿素a的含量开始下降。由图2(d)可知:各浓度的处理使莱茵衣藻的叶绿素a含量都显著低于对照组,1 d后,叶绿素a的含量开始下降。
叶绿素a的含量是用来表征藻细胞生物量变化的另一重要参数。前期研究发现,小球藻(C.vtdgarisBeij.)、金藻8701(IsochrysisgalbanaParke 8701)和小新月菱形藻(NitzschiadosteriumHer.)叶绿素a含量受到氯霉素、遗传霉索、青霉素3种抗生素的影响,其中0~200 μg/mL遗传霉素明显抑制3种微藻叶绿素a的含量,质量浓度低于100 μg/mL氯霉素对小球藻和金藻叶绿素a含量的影响较小,但当质量浓度大于50 μg/mL时,会使小新月菱形藻叶绿素a的含量显著下降;3种藻对青霉素的敏感性存在差异,当质量浓度低于100 μg/mL时能够促进3种藻叶绿素a的含量,而相对增长率却随着青霉素浓度的升高而逐渐下降[12]。在本研究中,4种抗生素处理后,叶绿素a含量的变化与藻细胞密度的变化趋势基本上是一致的,即低浓度的Amp(50和100 μg/mL)处理及Cmp各浓度的处理,促使藻细胞叶绿素a的含量增加,而Kan及Tet各浓度的处理都会显著减少莱茵衣藻的叶绿素a的含量。低浓度的青霉素处理使藻细胞叶绿素a的含量上升,可能是因为一方面促进细胞内核酸和蛋白质的合成,另一方面降低细胞中叶绿素酶的活性来延缓叶绿素的降解,从而提高叶绿素a的含量;而高浓度抗生素的处理会使藻细胞叶绿素a的含量下降,原因可能是:①抗生素的胁迫可以引起叶绿体膨胀破裂,类囊体膜解体,从而导致叶绿体从组织中流失,抗生素处理的会导致藻体细胞的rETR值下降,也暗示了光合囊体膜遭到了破坏;②细胞内活性氧的积累导致叶绿体结构破坏,叶绿素合成受阻;③抗生素直接与藻体的某些成分结合,抑制叶绿体片层中捕光色素-蛋白复合体的合成,导致转能效率降低[14]。
2.3 抗生素对莱茵衣藻光化学活性的影响
2.3.1 不同抗生素对莱茵衣藻YII的影响
图3显示了在4种抗生素各浓度的处理下,莱茵衣藻的YII在7 d内的变化情况。图3(a)显示: 50 μg/mL的Amp处理使莱茵衣藻的YII值在7 d内均高于未处理组;当质量浓度为100 μg/mL时,处理后第1天的YII值略高于未处理组,但从第2天开始下降,到第4天明显低于未处理组;当质量浓度为120 μg/mL及140 μg/mL时,均使莱茵衣藻的YII值在处理后就显著低于未处理组,处理浓度越高,YII值下降越快,其中当质量浓度为140 μg/mL时,莱茵衣藻的YII值在7 d后下降为0.36,而未处理组的YII值为0.53。图3(b)显示: 5 μg/mL的Cmp处理没有显著影响莱茵衣藻的YII值,当质量浓度为10 μg/mL时,莱茵衣藻在生长7 d内的YII值略高于未处理组;质量浓度为15 μg/mL及20 μg/mL的处理均使莱茵衣藻的YII值在处理后显著低于未处理组,处理浓度越高,YII值下降得越快,其中当质量浓度为20 μg/mL时,莱茵衣藻的YII值在7 d后下降为0.30,而未处理组的YII值为0.53。图3(c)及图3(d)显示:各浓度的处理均使莱茵衣藻的YII值在处理后就显著低于未处理组,并且处理浓度越高,YII值下降得越快,其中质量浓度40 μg/mL的Kan及20 μg/mL的Tet在处理后的第1天就使莱茵衣藻的YII值从未处理时的0.47下降到0.001。
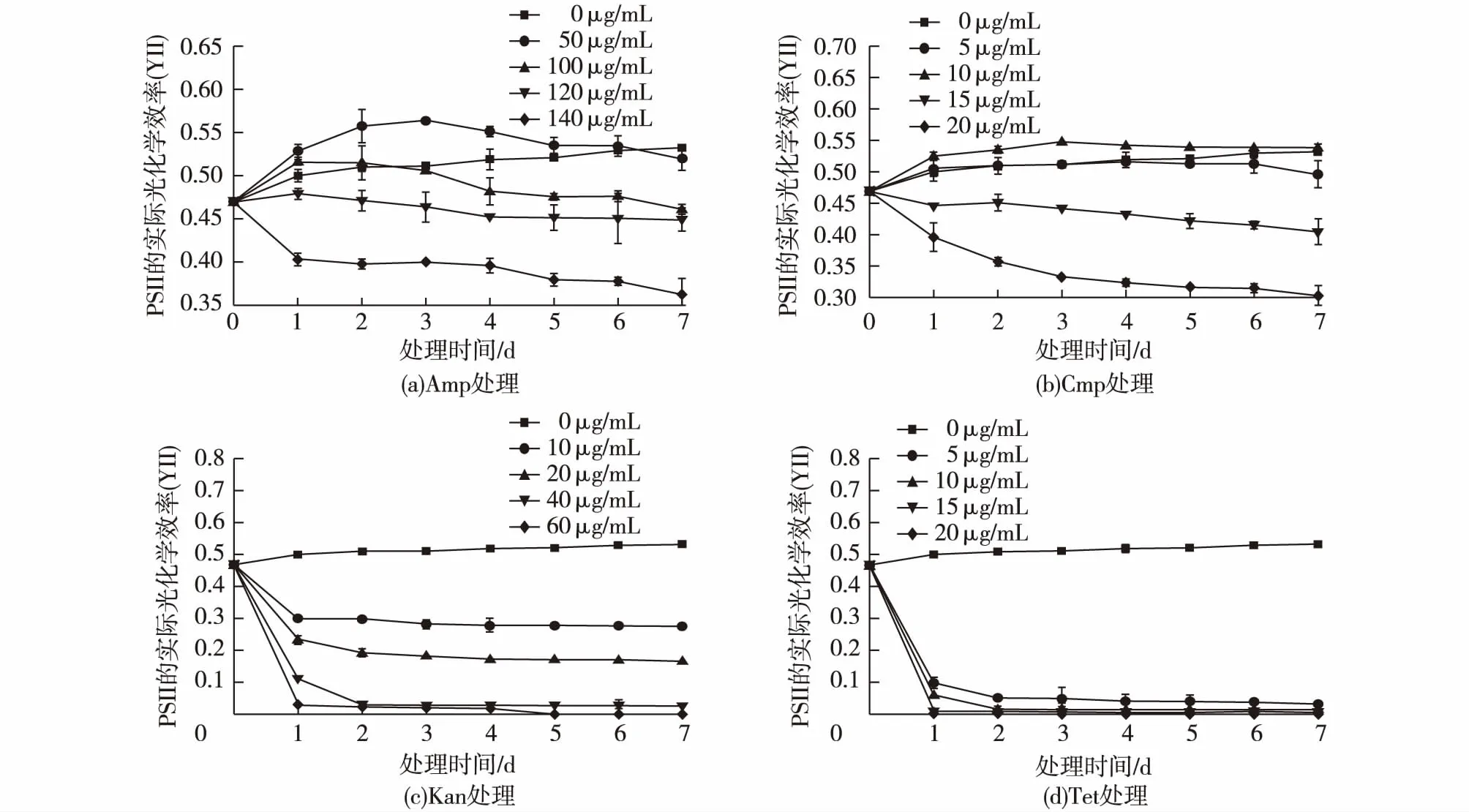
图3 不同浓度的Amp(a)、Cmp(b)、Kan(c)及Tet(d)处理对莱茵衣藻YII的影响Fig.3 Effects of Amp (a),Cmp (b),Kan (c) and Tet(d) at different concentration on YII of C. reinhardtii
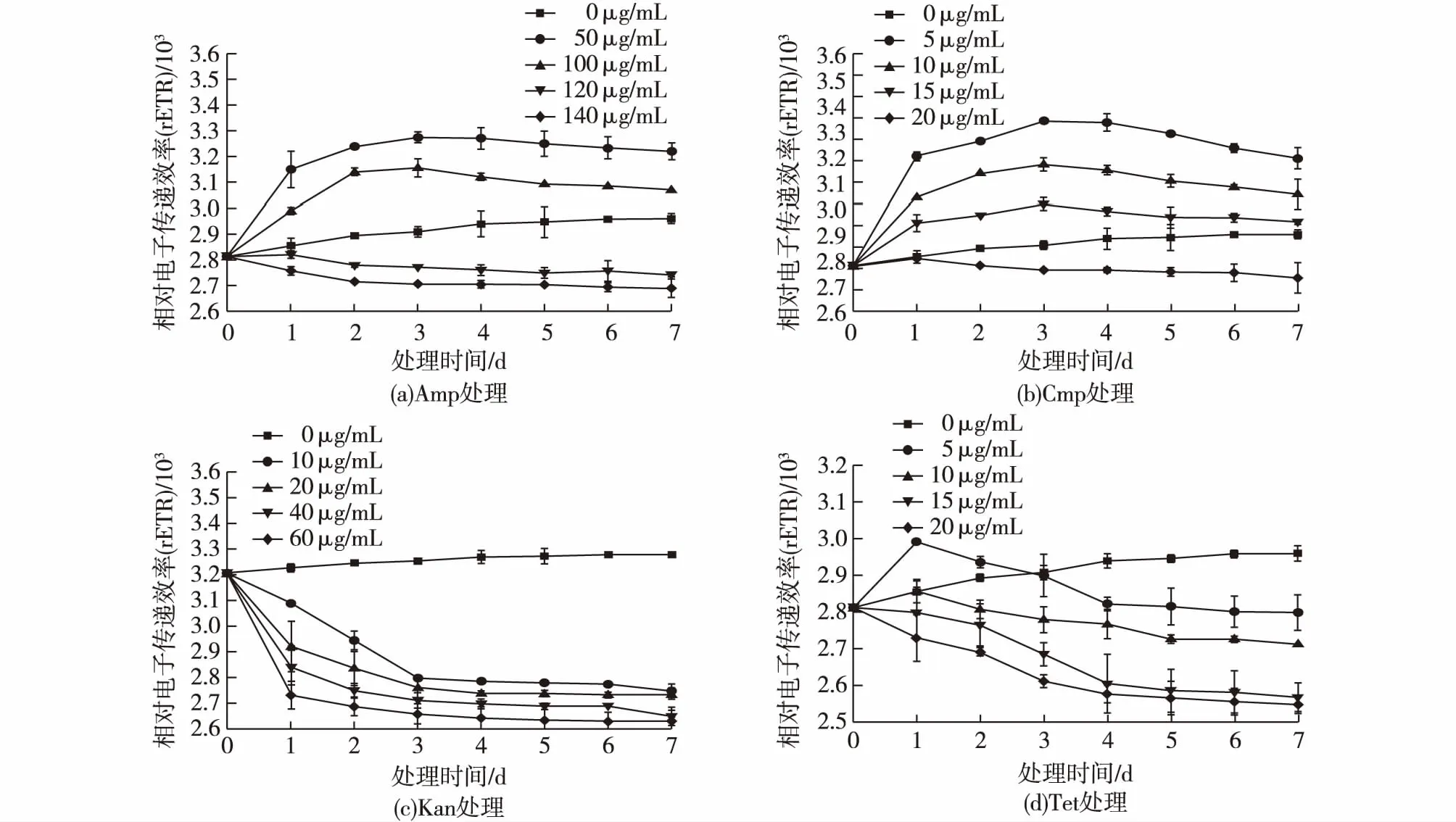
图4 不同浓度的Amp(a)、Cmp(b)、Kan(c)及Tet(d)处理对莱茵衣藻rETR的影响Fig.4 Effects of Amp (a),Cmp (b),Kan (c) and Tet(d) at different concentration on rETR of C. reinhardtii
2.3.2 不同抗生素对莱茵衣藻rETR值的影响
图4显示了在4种抗生素各浓度的处理下,莱茵衣藻的rETR值在7 d内的变化情况。图4(a)显示了质量浓度为50及100 μg/mL的Amp处理使莱茵衣藻的rETR值均高于未处理组,且50 μg/mL处理的rETR值高于100 μg/mL处理的rETR;当Amp质量浓度为120及140 μg/mL时,从处理后第2天开始,rERT值显著低于未处理组。图4(b)显示:Cmp处理时,除20 μg/mL质量浓度外,其他3个处理浓度的rETR值均高于未处理组,且5 μg/mL处理的rETR值大于10 μg/mL处理的rETR值,10 μg/mL处理的rETR值大于15 μg/mL处理的rETR值。图4(c)显示:Kan各浓度处理的rETR值均小于未处理组,且处理的浓度越高,rETR值下降得越低。图4(d)显示:Tet的处理在质量浓度为5 μg/mL时,第1天的值升高,随后下降,到第3天时与未处理组相同,随后下降显著低于未处理组,其他3个处理浓度均低于未处理组。
叶绿素荧光的变化能够真实地反映光能吸收、激发光能传递和光化学反应等光合作用的原初反应过程。YII及rETR分别指光系统II的实际光能转换效率或实际光量子产额及经过光系统II的相对线性电子流[15]。在本研究中,莱茵衣藻的YII及rETR对抗生素的处理非常敏感。YII的值在低质量浓度的Amp(50 μg/mL)及Cmp(10 μg/mL)处理的前期(3 d前)升高,可能与藻液中抑生菌的去除有关,但在3 d后,YII的值有所下降,说明低浓度的Amp及Cmp的处理会对YII有轻微的抑制作用;对于Kan及Tet的处理,在加入抗生素后YII就急剧下降,说明Kan及Tet的处理会严重抑制莱茵衣藻的光反应,也有报道证明,链霉素会选择性地给合小球藻的核糖体70S亚基,从而抑制小球藻的PSII的D1、CP43及CP47等蛋白的合成,来降低小球藻的光合效率[13];rETR值在低质量浓度的Amp(50及100 μg/mL)及Cmp(5、10及15 μg/mL)处理的rETR值都高于未处理组,但随着处理时间的延长,rETR值逐渐降低;Kan及Tet的处理都会使rETR的值急剧下降;rETR值随着抗生素的加入下降,rETR值的大小反映了PSII反应中心在光下的开放程度,它的降低暗示了光反应中心的关闭,可能是由于抗生素的存在阻碍了光合电子传递过程中的由电子传递体QA到QB的电子传递过程,也可能是抗生素作用于电子传递链上的蛋白酶,抑制酶的活性,进而影响电子传递,从而影响光合作用效率[13]。本研究结果可以看出,4种抗生素的处理对YII与rETR值的影响具有很强的相关性,但影响的程度有些不同,光合效率降低的部分原因是由于电子传递效率的下降,除此之外可能还包括热能散失及非光化学淬灭等因素。关于抗生素对光化学活性的影响机制,目前仍然没有确切的解释,其机制有待进一步揭示。
2.4 抗生素对莱茵衣藻伴生细菌的抑制作用
将抗生素处理7 d后和对照组的藻液用无菌TAP培养液稀释100倍,分别涂布在LB培养基上,菌落生长情况如图5所示,结合图5细菌数量的统计结果,表明在笔者所选取的浓度内,随着4种抗生素浓度的增加,细菌的数量随之减少,浓度越高效果越明显。当藻液中Cmp的终质量浓度达到20 μg/mL时,可以完全抑制藻液中细菌的生长。在20 μg/mL质量浓度下,虽然Tet对藻液中细菌的抑制作用也很明显,但由于Tet质量浓度为5 μg/mL时,就已经表现出对莱茵衣藻的生长具有显著抑制作用(P<0.05);藻液中Kan的终质量浓度达到60 μg/mL时,即使可以完全抑制细菌的生长,但其质量浓度为10 μg/mL时,对莱茵衣藻的抑制作用已达到显著(P<0.05);另外,当藻液中Amp的终质量浓度140 μg/mL时,并没有完全抑制藻液中细菌的生长,仍可以观察到有少数细菌菌落长出。因此,Amp、Tet及Kan不适合应用于莱茵衣藻的无菌化中。
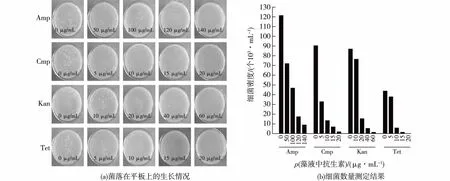
图5 4种抗生素各处理浓度的藻液中的细菌检验结果Fig.5 Bacteria inspection in C.reinhardtii culture broth treated by 4 kinds of antibiotics
3 结论
4种抗生素Amp、Cmp、Kan及Tet的不同浓度对莱茵衣藻的细胞密度、叶绿素a含量及光化学活性都产生显著的影响。Amp(低于100 μg/mL)及Cmp(低于20 μg/mL),对莱茵衣藻的生长有显著的促进作用,而Kan及Tet的各处理浓度都会显著抑制莱茵衣藻的生长;莱茵衣藻的光化学活性对4种抗生素的处理比较敏感,虽然在处理的3 d内,Amp(低于50 μg/mL)及Cmp(低于10 μg/mL)由于“毒物效应”会增加莱茵衣藻的YII及rETR值,但处理后期是呈现下降趋势的,因此4种抗生素的长期存在都会使莱茵衣藻的PSII反应中心受损,光合电子传递过程受阻及光合效率降低。此外,低浓度的Cmp可用于莱茵衣藻细胞无菌化培养中,而Amp、Kan及Tet则不适合用于莱茵衣藻的无菌化培养。本研究结果表明,水生环境中抗生素的存在,会显著影响莱茵衣藻的生长及光化学活性,尤其是不断累积的抗生素也会对莱茵衣藻等微藻的生态平衡产生影响。
[1] HARRIS E H.Chlamydomonas as a model organism.Ann Rev Plant Physiol Plant Mol Biol,2001,52(4):363-406.
[2] KELLER L C,ROMIJN E P,ZAMORA I,et al.Proteomic analysis of isolated chlamydomonas centrioles reveals orthologs of ciliary-disease genes.Curr Biol,2005,15(12):1090-1098.
[3] JOHANNINGMEIER U,FISCHER D.Perspective for the use of genetic transformants in order to enhance the synthesis of the desired metabolites:engineering chloroplasts of microalgae for the production of bioactive compounds.Adv Exp Med Biol,2010,698(1):144-151.
[4] JOO H N,LEE C G.Antibiotics addition as an alternative sterilization method for axenic cultures inHaematococcuspluvialis.J Ind Eng Chem,2007,13(1):110-115.
[5] 林伟,陈騳,刘秀云.海洋微藻除菌及除菌与自然带菌微藻生长特点比较.海洋与湖沼,2000,31(6):647-652.
[6] DIVAN C L,SCHNOES H K.Production of axenicGonyaulaxcultures by treatment with antibiotics.Appl Environ Microb,1982,44(1):250-254.
[7] 孙雯,黄和,林海龙,等.抗生素对雨生红球藻无菌化培养的影响.生物加工过程,2015,13 (4):11-16.
[8] 麻晓霞,马丽萍,石勋祥,等.微藻对常用抗生素敏感性的研究进展.微生物学免疫学进展,2012,40(1):83-86.
[9] KÖRNER S,NICKLISCH A.Allelopathic growth inhibition of selected phytoplankton species by submerged macrophytes.J Phycol,2002,38(5):862-871.
[10] SCHREIBER U,KLUGHAMMER C,KOLBOWSKI J.Assessment of wavelength-dependent parameters of photosynthetic electron transport with a new type of multi-color PAM chlorophyll fluorometer.Photosynth Res,2012,113(1/3):127-144.
[11] FAUST M,ALTENBURGER R,BACKHAUS T,et al.Predictive assessment of the aquatic toxicity of multiple chemical mixtures.J Environ Quality,2000,29(4):1063-1068.
[12] 刘莹莹,张文蕾,侯和胜,等.抗生素在微藻工程中的应用研究进展.生命科学,2016,28(9):1010-1015.
[13] PERALES-VELA H V,GARCíA R V,GóMEZ-JUáREZ E A,et al.Streptomycin affects the growth and photochemical activity of the algaChlorellavulgaris.Ecotoxicol Environ Safety,2016,132:311-317.
[14] ALBERTE R S,FRIEDMAN A L,GUSTAFSON D L,et al.Light-harvesting systems of brown algae and diatoms.Isolation and characterization of chlorophyll ac and chlorophyll afucoxanthin pigment-protein complexes.Biochim Biophys Acta,1981,635(2):304-316.
[15] BAKER N R.Chlorophyll fluorescence:a probe of photosynthesis in vivo.Annu Rev Plant Biol,2008,59:89-113.
(责任编辑 管珺)
Effects of four antibiotics on growth and photochemicalactivities ofChlamydomonasreinhardtii
JIANG Si1,2,LIU Yingying1,2,TONG Shaoming1,2
(1. College of Life Sciences,Liaoning Normal University,Dalian 116081,China;2. Key Laboratory of Plant Biotechnology of Liaoning Province,Dalian 116081,China)
Four antibiotics (ampicillin (Amp),kanamycin (Kan),chloramphenicol (Cmp),tetracycline (Tet))at different concentrations were added to the culture broth in order to explore axenic cultivation ofChlamydomonasreinhardtii.The optimal antibiotics and concentration were determined by effects on the growth and photosynthetic activities ofC.reinhardtii.Cell density and chlorophyll a content increased proportionately by the treatment below 100 μg/mL Amp and 20 μg/mL Cmp,respectively.Inhibitory effects of the antibiotics appeared at all concentrations of Kan and Tet.YII and rETR increased at 50 μg/mL Amp and 10 μg/mL Cmp,respectively within 3 days and then decreased,whereas YII and rETR decreased sharply at all concentration of Kan and Tet.Furthermore,the combination results of bacterial inspectionshowed that Cmp had better antibacterial effect for axcnic culture ofC.reinhardtii.
Chlamydomonasreinhardtii; antibiotics; microalgae; photosynthetic activity
10.3969/j.issn.1672-3678.2017.02.003
2016-11-02
辽宁省大学生创新创业训练计划项目(201610165072)
姜 思(1994—),男,辽宁普兰店人,研究方向:生物技术;共同第一作者,刘莹莹(1993—),女,辽宁凌源人,研究方向:生物技术;佟少明(联系人),副教授,E-mail:tongsm@163.com
Q949.2
A
1672-3678(2017)02-0013-08

