枯草芽孢杆菌头孢菌素C脱乙酰基酯酶在大肠杆菌中的诱导及组成型表达
朱 颖,马晓强,杨胜利,魏东芝,苏二正,2
(1.华东理工大学生物反应器工程国家重点实验室鲁华生物技术研究所,上海200237;2.南京林业大学轻工科学与工程学院酶与发酵工程实验室,南京210037)
枯草芽孢杆菌头孢菌素C脱乙酰基酯酶在大肠杆菌中的诱导及组成型表达
朱 颖1,马晓强1,杨胜利1,魏东芝1,苏二正1,2
(1.华东理工大学生物反应器工程国家重点实验室鲁华生物技术研究所,上海200237;2.南京林业大学轻工科学与工程学院酶与发酵工程实验室,南京210037)
本研究构建了8种诱导型质粒和16种组成型质粒,试图实现枯草芽孢杆菌头孢菌素C脱乙酰基酯酶(CAH)基因在大肠杆菌中的高效异源表达。经过筛选,最终选择带有pUC19上的起始位点、SIL3基因、trp启动子以及间隔序列为B1的组成型表达质粒pB1-SIL3-K为最佳表达质粒。将PB1-SIL3-K转入EscherichiacoliDH5α,重组菌在37 ℃发酵培养24 h,其OD值达到5.4,酶活达到了138.61 U/mL。进一步通过培养基组成、培养条件、放大过程等优化,在7 L发酵罐上,CAH最高酶活达到1 340 U/mL,为目前国内外文献报道最高水平。
头孢菌素C脱乙酰基酯酶;诱导型表达;组成型表达;3′-脱乙酰基-7-氨基头孢烷酸
头孢菌素类抗生素是抗生素家族的一个重要分支,它与青霉素同属β内酰胺类抗生素,具有较低的毒性、广泛的抗菌谱、高效的抗菌作用等优点。7-氨基头孢烷酸(7-ACA)是头孢菌素类抗生素的重要中间体,对其结构进行改造可以合成一系列的头孢菌素C(CPC)衍生物。当前,以7-ACA为中间体半合成的头孢菌素类抗生素已发展到了第四代,其抗菌活性变得更强,抗菌谱也变得更加广泛。
脱去7-ACA的3′位上的乙酰基后得到的带有裸露羟基的化合物为3′-脱乙酰基-7-氨基头孢烷酸(D-7-ACA),是一种新型的头孢菌素类抗生素中间体。由于7-ACA的3′位是酯基,半合成时不易反应,而D-7-ACA 的3′位是裸露的羟基,反应活性高,易受到亲核试剂的进攻,因此方便转化,可以添加不同的官能团从而得到不同类型的头孢类衍生物。所以,对第二、三、四代以及将要到来的第五代头孢菌素类抗生素的生产来说,D-7-ACA的开发是一种新的选择。
D-7-ACA的制备方法分为化学法与酶法。化学法一般在-40~-30 ℃下,加入高浓度的强碱对7-ACA进行水解,从而得到D-7-ACA。这种方法能耗高、成本高,得到的D-7-ACA产品含有较多杂质且底物的损失近20%~30%,所以导致收率也较低。而酶法可以避免化学法的上述缺点。酶法分为两步酶法与一步酶法:两步酶法是以脱乙酰基头孢菌素C(D-CPC)为原料,用固定化D-氨基酸氧化酶(DAAO)和固定化戊二酰基-7-氨基头孢烷酸酰化酶(GL-7-ACA酰化酶)两步水解制备D-7-ACA。一步酶法可以D-CPC作为底物,在固定化CPC酰化酶的作用下,一步水解制备D-7-ACA;也可以7-ACA为原料,在固定化脱乙酰基酯酶的作用下,一步水解制备D-7-ACA。不论是两步酶法还是一步酶法,乙酰基的脱除都需要固定化脱乙酰基酯酶的催化水解。
脱乙酰基酯酶(EC3.1.1.41,cephalosporin-C deacetylase(CAH))是酯酶的一种,广泛存在于许多生物体中,例如柑桔皮、放射土壤农杆菌[7-8]、真菌[9-10]、枯草芽孢杆菌[11-14]、红冬孢酵母[15]、黏红酵母[16]中。在有水的环境里,它可以催化CPC与7-ACA酯键的水解,从而脱去乙酰基变成D-CPC与D-7-ACA,同时生成乙酸。根据文献[11-14]报道,来源于枯草芽孢杆菌的CAH具有良好的催化性能和稳定性,对底物7-ACA和CPC的亲和力高,是制备D-7-ACA的最佳CAH。
本文中,笔者尝试将不同枯草芽孢杆菌来源的CAH在大肠杆菌中进行诱导及组成型表达,以期获得高表达CAH的重组大肠杆菌工程菌,为CAH高效、低成本发酵制备奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
枯草芽孢杆菌1.107购自中国普通微生物菌种保藏管理中心,枯草芽孢杆菌XSA12、YIS和SIL3保藏于华东理工大学鲁华生物技术研究所;大肠杆菌DH5α、BL21(DE3)、JM109,质粒pMD19-T、pET-24a、pET-28a、pUC 19、pKK 233-2保藏于生物反应器工程国家重点实验室。
1.1.2 工具酶、试剂及药品
限制性内切酶NdeI、XhoI、BstEII、PstI、HindIII、NdeI、BamHI与T4 DNA连接酶,Fermentas公司;DNA Marker DL2000、DL5000、DL10000以及PCR用的Premix Taq DNA 聚合酶、Prime STAR HS DNA聚合酶,TaKaRa公司;细菌基因组DNA小量提取试剂盒,北京庄盟国际生物公司;质粒DNA小量制备试剂盒与DNA凝胶回收试剂盒,上海捷瑞生物工程有限公司;酵母浸出粉和胰蛋白胨,OXOID公司。其他试剂药品均为市售分析纯。
1.1.3 培养基
牛肉膏蛋白胨培养基:葡萄糖20 g/L,蛋白胨15 g/L,NaCl 5 g/L,牛肉膏0.5 g/L;115 ℃湿热灭菌20 min,用于枯草芽孢杆菌的培养。
LB液体培养基:NaCl 10 g/L,蛋白胨10 g/L,酵母提取物5 g/L;121 ℃湿热灭菌15 min。
LB固体培养基:LB液体培养基内加入15 g/L的琼脂粉;121 ℃湿热灭菌15 min。
M9培养基:葡萄糖10 g/L,安琪酵母粉10 g/L,蛋白胨20 g/L; 115 ℃湿热灭菌20 min,加入已灭菌的M9基础盐(上海容创生物技术有限公司)。
氨苄青霉素:配制质量浓度为100 mg/mL,滤膜无菌过滤后分装到1.5 mL离心管内,-20 ℃冷冻保藏。使用终质量浓度为50 μg/mL。
卡那霉素:配制质量浓度为100 mg/mL,滤膜无菌过滤后分装到1.5 mL离心管内,-20 ℃冷冻保藏。使用终质量浓度为25 μg/mL。
1.1.4 引物
本研究所用引物如表1所示。

表1 本研究所用引物
1.2 实验方法
基因组提取、质粒提取、酶切、连接、大肠杆菌转化、核酸电泳分析、SDS-PAGE蛋白分析等操作均参照文献`[17]方法。
1.2.1 CAH基因的克隆
根据已知的来源于枯草芽孢杆菌的脱乙酰基酯酶的保守序列,设计引物CAH-NdeI和CAH-XhoI,分别以枯草芽孢杆菌1.107、XSA12、YIS和SIL3的基因组作为模板,通过PCR扩增获得4个枯草芽孢杆菌的CAH基因。PCR扩增程序:94 ℃预热10 min后,以94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min作为一个循环,进行30个循环后,在72 ℃延伸10 min。PCR产物通过琼脂糖凝胶电泳回收后,与pMD19-T质粒连接,并转入E.coliDH5α,在含氨苄抗性的LB固体培养基上,37 ℃倒置培养16 h。挑选菌落进行菌落PCR,将通过PCR结果筛选出来的阳性菌保种并送至华大基因公司进行DNA测序。
1.2.2 CAH诱导型表达菌株的构建、表达、纯化及动力学参数测定
诱导型菌株构建:将经过测序鉴定的克隆菌株E.coliDH5α接种于含有氨苄抗性的新鲜液体LB培养基内,37 ℃过夜培养12 h后,收集菌体提取质粒DNA。将含有酯酶基因的pMD19-T质粒进行NdeI与XhoI双酶切,与同时用NdeI与XhoI酶切处理过的表达质粒pET-24a、pET-28a进行连接,得到重组质粒pET24a-1.107、pET24a-XSA12、pET24a-YIS、 pET24a-SIL3和pET28a-1.107、pET28a-XSA12、pET28a-YIS、 pET28a-SIL3。重组质粒转化E.coliBL21感受态细胞,转化液均匀涂布于含有卡那霉素抗性的LB固体培养基上,37 ℃倒置培养16 h。挑选菌落进行菌落PCR,将通过PCR结果筛选出来的阳性菌保种并送至华大基因公司进行DNA测序。
重组CAH的表达:将验证过的诱导型工程菌株接种于含有卡那霉素的LB液体培养基中,37 ℃培养16 h,取500 μL接种于50 mL含有卡那霉素的LB液体培养基内,37 ℃振荡培养2~3 h,至OD处于0.6~1.0之间,加入25 μL 1 moL/L的IPTG开始诱导培养。诱导培养的温度选择20 ℃,转速200 r/min,培养20 h。诱导培养结束后,收集菌体,用0.1 moL/L pH 8.0的磷酸钠缓冲液重悬菌体,超声破碎。破碎液在8 000 r/min转速下离心10 min,使上清酶液与细胞碎片和包涵体充分分离。上清液进行CAH酶活测定,纯化和动力学参数测定,同时,将上清和沉淀进行SDS-PAGE分析。
CAH的纯化:上述上清液利用镍(Ni)柱进行亲和纯化。纯化好的酶液通过透析12 h除去咪唑等离子,保存待用。
动力学参数的测定:将透析好的CAH溶液稀释成同等蛋白浓度的纯酶溶液,用0.1 moL/L磷酸钠盐配制15 mmoL/L、pH 8.0的7-ACA和CPC溶液100 mL,稀释成浓度分别2、3、5、8、10和12 mmoL/L的底物溶液,按照测酶活的方法,加入等量体积的纯酶溶液,精确反应5 min。每个样品做3个平行,以0.1 moL/L、pH 8.0的磷酸钠盐缓冲液作为空白,高效液相色谱(HPLC)检测反应速率随着底物浓度的变化。根据液相测定结果制作Y(1/V)-X(1/cs)图,从而计算得到酶的Km值与最大反应速率Vmax。
1.2.3 CAH组成型表达菌株的构建与表达
组成型质粒构建:选择高拷贝的pUC 19质粒进行改造。首先,将pUC19的氨苄青霉素抗性替换为卡那霉素的抗性;然后,加入强终止子5S rrnT1T2,考察终止子的有无对菌株表达以及酶活的影响;利用重叠PCR技术,将trp启动子与CAH通过重叠PCR方法直接连接。同时在重叠区域设计不同的碱基组合,可以考察间隔序列碱基不同对菌种表达以及酶活的影响。
Kan抗性替代:以pUC 19-XhoI和pUC 19-BstEII为引物,pUC 19质粒为模板反向PCR扩增,去除其Amp基因部分,并引入了XhoI和BstEII两个酶切位点;同时以Kan-XhoI和Kan-BstEII为引物,以pET-28a质粒为模板,PCR扩增得到Kan抗性基因,并引入了XhoI和BstEII两个酶切位点。将上述两种PCR产物进行回收,纯化后用XhoI和BstEII在37 ℃酶切3 h,回收后进行连接,并转化到含有kan抗性的大肠杆菌E.coliDH5α,筛选得到阳性克隆。提取阳性克隆的质粒,将其命名为kan-19。
终止子加入:以Ter-PstI与Ter-HindIII为引物,pKK 233-2质粒为模板,PCR扩增得到强终止子5S rrnT1T2序列,回收后与之前提取的kan-19质粒同时进行PstI和HindIII双酶切,回收酶切产物,并进行连接,将连接产物转化到大肠杆菌E.coliDH5α,菌落PCR筛选得到含有强终止子5S rrnT1T2序列阳性菌落,并提取质粒并命名为kan19-R。
CAH与trp启动子的重叠PCR:以T1-NdeI与T1-B1为引物,大肠杆菌基因组为模板,PCR扩增得到尾端带有序列B1的trp启动子;同样的,以T1-NdeI与T2-B2,大肠杆菌基因组为模板,PCR扩增得到尾端带有序列B2的trp启动子。以CAH-B1-T1与CAH-BamHI为引物,pET28a-1.107、pET28a-XSA12、pET28a-YIS和pET28a-SIL3为模板,扩增前端带有序列B1的1.107、XSA12、YIS、SIL34种酯酶基因。同理,以CAH-B2-T2与 CAH-BamHI为引物,pET28a-1.107、pET28a-XSA12、pET28a-YIS和pET28a-SIL3为模板,扩增前端带有序列B2的1.107、XSA12、YIS和SIL3这4种酯酶基因。以T1-NdeI与CAH-BamHI为引物,通过重叠PCR的方法,扩增得到带有间隔序列分别为B1和B2的trp启动子与4种基因组合的8个长片段,将PCR产物进行琼脂糖凝胶电泳。切胶回收后连接T载体并转化大肠杆菌E.coliDH5α,筛选阳性克隆后送至华大基因公司进行DNA测序,经验证正确后保种并提取质粒保存待用。
重叠片段与组成型质粒的连接:上述获得的包含有不同组合的8种重叠片段的T载体质粒与之前构建的kan-19与kan19-R两种组成型质粒同时用NdeI与BamHI酶切,连接转化大肠杆菌E.coliDH5α,筛选阳性克隆后送至华大基因公司进行DNA测序。最终构建获得了16种质粒。
转化不同的宿主:将上述16种质粒分别转化大肠杆菌E.coliJM109和E.coliDH5α,得到32株备选工程菌株。其中组成型菌株的表达使用M9培养基,在37 ℃培养24 h。
1.2.4 CAH酶活的测定
以7-ACA或CPC为底物测定脱乙酰酯酶酶活的方法:用0.1 moL/L、pH 8.0的磷酸钠缓冲液将底物7-ACA或CPC配成浓度为150 mmoL/L的溶液,取2 mL底物溶液加入到25 mL三角瓶内,放置于30 ℃水浴摇床内预热5 min,加入稀释好的酶液1 mL,反应开始。精确反应5 min,取200 μL反应液迅速加入到800 μL乙腈中,终止反应。用乙腈稀释10倍后,12 000 r/min离心10 min,取700 μL加入到液相小瓶中,用高效液相色谱法对5 min内产物D-7-ACA或D-CPC的生成量进行检测。流动相(体积分数):15%甲醇、7.5%乙腈以及77.5%的1.29%乙酸溶液。使用反向柱 XDB C-8 column (Zorbax,4.6 mm×150 mm),流速为1 mL/min,检测波长为254 nm,柱温为30 ℃。在上述反应条件下,每分钟释放1 μmol D-7-ACA或D-CPC所需要的酶量定义为1个酶活单位(U)。
2 结果与讨论
2.1 4株枯草芽孢杆菌CAH的克隆
根据已知的来源于枯草芽孢杆菌的脱乙酰基酯酶基因序列,设计了扩增用的特异性引物CAH-NdeI与CAH-XhoI。以枯草芽孢杆菌1.107、XSA12、YIS和SIL3的基因组作为模板,进行PCR扩增反应,结果见图1。反应结束后,将PCR产物全部进行琼脂糖凝胶电泳,在紫外灯下进行电泳结果的观察与目的条带的切胶回收。由图1可知:4个样品泳道都在1 000 bp左右处出现清晰单一的条带,与已知的脱乙酰基酯酶基因(957 bp)大小相符,证明4株枯草芽孢杆菌的基因组中都含有脱乙酰酯酶的基因。
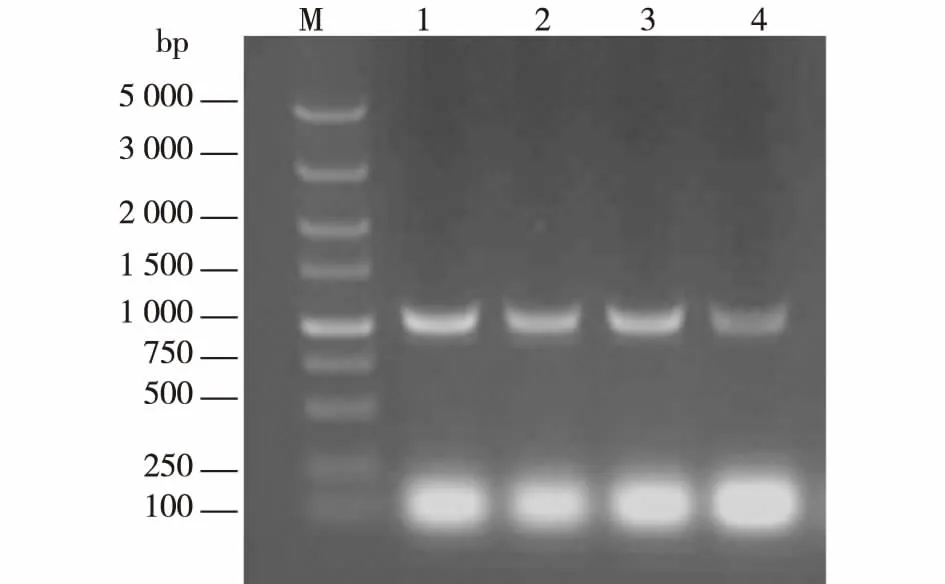
M为DL 5 000 Marker;1为CAH-1.107;2为CAH-XSA12;3为CAH-YIS; 4为CAH-SIL3图1 PCR获得脱乙酰基酯酶基因Fig.1 PCR product of CAH gene
对目的基因进行胶回收。回收纯化的片段与扩增质粒pMD19-T连接,转入大肠杆菌E.coliDH5α。转化成功后,利用蓝白斑实验筛选阳性重组子,经PCR鉴定后送至华大基因测序。测序结果显示:4种目的基因大小都是957 bp,两端都含有NdeI与XhoI酶切位点,但基因DNA序列的个别碱基略有不同。考虑到密码子存在兼并性,将4种酯酶基因的DNA序列翻译为氨基酸后,再与日本盐野义公司的枯草芽孢杆菌SHS 0133所表达的脱乙酰基酯酶进行氨基酸序列的比对,结果如表2所示。由表2可知:本研究获得的4种不同枯草芽孢杆菌来源的CAH基因所表达的蛋白都不相同,但是差异不大,且差异位点皆不是其活性位点。与盐野义公司的CAH序列相似度在98%~99%之间,其中XSA12与SIL3与之差异最小,只有3个氨基酸的差异。将上述4种CAH基因提交GenBank 获得相应的登录号:JX036322~JX036325。

表2 4种CAH与盐野义公司CAH的氨基酸序列差异
注:括号中为盐野义公司CAH的氨基酸。
2.2 4种CAH在大肠杆菌中的诱导表达
提取含有酯酶CAH基因的pMD19-T质粒,与诱导型表达质粒pET-24a、pET-28a一起用限制性内切酶NdeI与XhoI进行双酶切。将酶切后的CAH基因片段与pET-24a、pET-28a酶切片段进行回收纯化,连接后转入克隆型菌株大肠杆菌E.coliDH5α中。菌落PCR法分别筛选出8株阳性克隆并保种,提取质粒转入表达型菌株大肠杆菌E.coliBL21感受态中。利用菌落PCR的方法,对转化后涂布的8个LB固体培养基上生长的菌落进行阳性克隆的筛选。将8株PCR验证过的阳性克隆菌送去华大基因测序,测序结果显示:诱导型菌株全部构建成功,分别得到了CAH前端不含His标签的诱导型工程菌E.coliBL21/pET24a-1.107、E.coliBL21/pET24a-XSA12、E.coliBL21/pET24a-YIS、E.coliBL21/pET24a-SIL3;CAH前端带有His标签的诱导型工程菌E.coliBL21/pET28a-1.107、E.coliBL21/pET28a-XSA12、E.coliBL21/pET28a-YIS、E.coliBL21/pET28a-SIL3。
将上述8株工程菌接种于LB 液体培养基内,37 ℃培养至对数期,在IPTG的诱导下,20 ℃培养20 h,菌体OD为2.0~2.5。离心收集菌体后清洗2次,最后加入0.1 mmoL/L、pH 8.0的磷酸钠缓冲液进行破碎。破碎后全部进行聚丙烯酰胺-凝胶电泳(SDS-PAGE),验证8株工程菌的目的蛋白的表达情况。蛋白电泳结果如图2所示。由图2可知:4种基因与pET-24a、pET-28a质粒组合的8株工程菌都在3.5×104左右出现明显的目的条带(与推测蛋白大小3.6×104基本相符),说明经过诱导,它们都正常地表达了目的蛋白CAH。从基因差别上分析,XSA12与SIL3基因表达的活性蛋白量都要多于YIS与1.107基因,YIS基因表达量虽然较多,但多为无活性的包涵体,上清中的活性目的蛋白条带不明显;从质粒的角度上来看,pET-28a质粒对目的基因的表达情况都要略好于pET-24a质粒。

M为蛋白Marker;1为E.coli BL21/pET24a-1.107菌体破碎后的上清与沉淀;2为E.coli BL21/pET28a-1.107菌体破碎后的上清与沉淀;3为E.coli BL21/pET24a-XSA12菌体破碎后的上清与沉淀; 4为E.coli BL21/pET28a-XSA12菌体破碎后的上清与沉淀;5为E.coli BL21/pET24a-YIS菌体破碎后的上清与沉淀;6为E.coli BL21/pET28a-YIS菌体破碎后的上清与沉淀;7为E.coli BL21/pET24a-SIL3菌体破碎后的上清与沉淀;8为E.coli BL21/pET28a-SIL3菌体破碎后的上清与沉淀图2 8株诱导型菌株的CAH表达Fig.2 CAH expression of 8 inducible strains
将8株工程菌表达的CAH粗酶酶活测定结果列于表3中。由表3可以看出:不论是pET-24a质粒还是pET-28a质粒,XSA12与SIL3基因表达的CAH酶活都比另外2种基因要高,且SIL3的酶活最高,其中表达酶活最低的是YIS基因所表达的CAH。结合图2的电泳结果可以看出:虽然YIS基因的表达量不小,但多为无活性的包涵体;总体上看,诱导型质粒pET-28a对目的基因的表达情况也要优于pET-24a质粒,这与蛋白电泳图一致。综上所述,表达量与酶活最高的为工程菌E.coliBL21/pET28a-SIL3,其酶活为45.89 U/mL。

表3 4种CAH基因不同重组菌表达酶活的比较
注:*以7-ACA作为底物测定酶活。
2.3 4种CAH的纯化及动力学参数
因为诱导型工程菌E.coliBL21/pET28a-1.107、E.coliBL21/pET28a-XSA12、E.coliBL21/pET28a-YIS和E.coliBL21/ pET28a-SIL3表达的CAH前端带有His标签,所以可以利用Ni柱进行纯化。对洗脱浓度进行了一系列的优化后,确定了用洗脱液NPI 20洗涤与Ni柱结合的杂蛋白、用洗脱液NPI 150洗脱Ni柱结合的目的蛋白的纯化方法,最终得到了4种较纯的目的蛋白CAH。进行蛋白电泳,结果如图3所示。由图3发现,纯化后的蛋白较为纯净,杂带不明显,可以用于后续动力学参数研究。
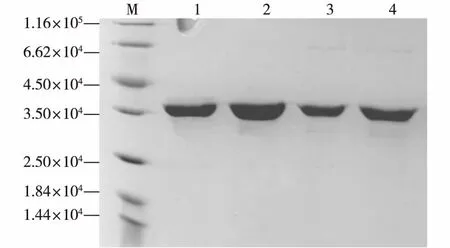
M为标准蛋白; 1为CAH-1.107;2为CAH-XSA12;3为CAH-YIS;4为CAH-SIL3图3 4种重组CAH的纯化Fig.3 Purification of the four kinds of recombinant CAH
通过比较4种纯酶的Km值,可以比较其催化性能的优劣。因为CAH也可用于CPC转化为D-CPC的反应,所以分别测定了4种纯酶对7-ACA、CPC的Km值。经过多次重复与平行试验,最终得到对7-ACA、CPC的Km值与Vmax值,结果如表4所示。
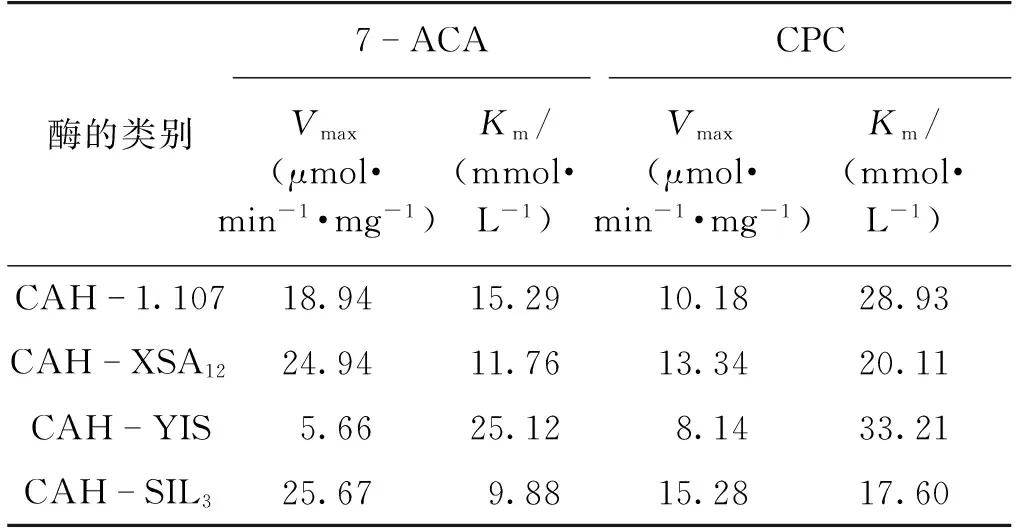
表4 4种CAH对底物7-ACA、CPC的Km值与Vmax值
由表4可知:在4种基因中,SIL3基因所表达的CAH对7-ACA、CPC的Km值都是最低值,分别为9.88和17.6,说明它对7-ACA、CPC都有最佳的亲和力,可以高效地与底物结合,进而催化底物7-ACA、CPC转化成D-7-ACA、D-CPC。日本盐野义制药公司枯草芽孢杆菌SHS 0133 CAH对7-ACA、CPC的Km值分别为7.90 和24.0[13]。而SIL3基因所表达的CAH对7-ACA的Km值略高于盐野义公司CAH,对CPC的Km值低于盐野义公司CAH。因此,SIL3基因所表达的CAH也具有工业化开发的潜力。
2.4 4种CAH在大肠杆菌中的组成型表达
构建的8株诱导型菌株在LB液体培养基中生长缓慢,20 h后菌体密度最大也只能达到2.5左右,且诱导型菌株需要诱导剂的加入和低温条件下进行诱导,设备要求高、成本高,不利于大规模工业化生产。因此,有必要构建一种适用于CAH在大肠杆菌中高效表达的组成型表达系统。启动子序列、质粒拷贝数以及SD序列与起始密码子ATG的间隔序列的长度、碱基组成都能对蛋白的表达造成重要影响。为此,按照1.2.3节的方法,本研究构建了16种CAH组成型表达质粒(表5),并考察了它们CAH基因的表达情况。

表5 16种质粒的组成情况
2.4.1 间隔序列碱基组成对CAH表达的影响
为了考察SD序列与起始密码子ATG之间的间隔序列碱基组成对CAH表达的影响,选用同样是不含终止子序列的B1-XSA12-K、B1-SIL3-K与B2-XSA12-K、B2-SIL3-K两组质粒,对其工程菌进行培养并考察发酵24 h后的CAH的表达情况,结果见图4。由图4可以看出:SD序列与ATG的间隔序列的碱基差异对于基因的表达有很大影响。与间隔序列为B2的工程菌相比,间隔序列为B1的工程菌的酶活都更高,蛋白电泳图中可以看出目的蛋白条带更粗、杂带更少。酶活测定结果表明(数据未显示):当间隔序列为B1时,XSA12、SIL3的酶活达到110.22和114.71 U/mL,分别是对应间隔序列为B2的1.89倍与1.67倍。根据上述实验结果,确定SD序列与起始密码子ATG的间隔序列的碱基组成对基因表达的确起着重要的影响。在本研究中,当间隔序列为B1时更适合于CAH的表达。推测原因可能是以B1作为间隔序列时,能使SD序列与起始密码子ATG之间的茎环结构更加稳定,并能将SD序列与起始密码子拉到最适距离,并通过将起始密码子ATG放于茎环结构突出的环形“头部”,使与SD序列结合的核糖体小亚基更快地识别出起始密码子并进行转录起始。而以B2作为间隔序列时,可能形成的茎环结构没有间隔序列B1那么稳定,所以在转录效率上略低一些。
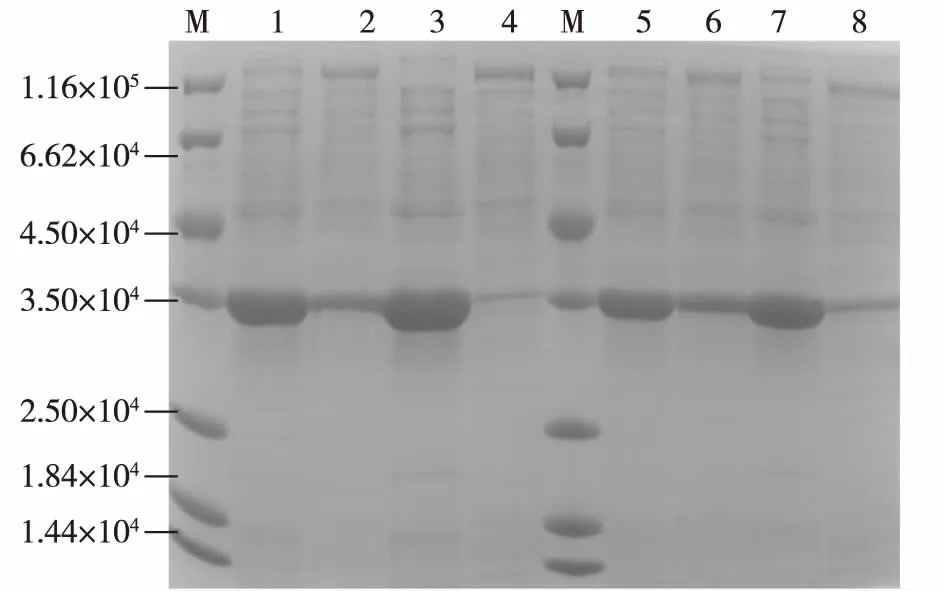
M为标准蛋白;1、2分别为E.coli DH5α/B1-XSA12-K破碎后的上清与沉淀;3、4分别为E.coli DH5α/B1-SIL3-K破碎后的上清与沉淀;5、6分别为E.coli DH5α/B2-XSA12-K破碎后的上清与沉淀;7、8分别为E.coli DH5α/B2-SIL3-K破碎后的上清与沉淀图4 间隔序列碱基组成对CAH表达的影响Fig.4 Effects of the spacing sequence composition on the CAH expression
2.4.2 终止子有无对CAH表达的影响
为了考察终止子的有无对基因表达的影响,选用同样含有SD序列与ATG的间隔序列为B1的B1-XSA12-K、B1-XSA12-R与B1-SIL3-K、B2-SIL3-R两组质粒,对其工程菌进行培养并测定发酵24 h后的OD、酶活与比酶活,结果见表6。由表6可以看出,终止子的有无对于基因的表达有很大影响。与对应的不含终止子序列的工程菌相比,含有终止子序列的工程菌的菌浓与酶活都偏低,约为前者的30%~40%,但比酶活水平基本一致。推测原因是由于终止子的存在,使得细胞对转录的监控更加严密,细菌生长缓慢而导致蛋白表达量低。
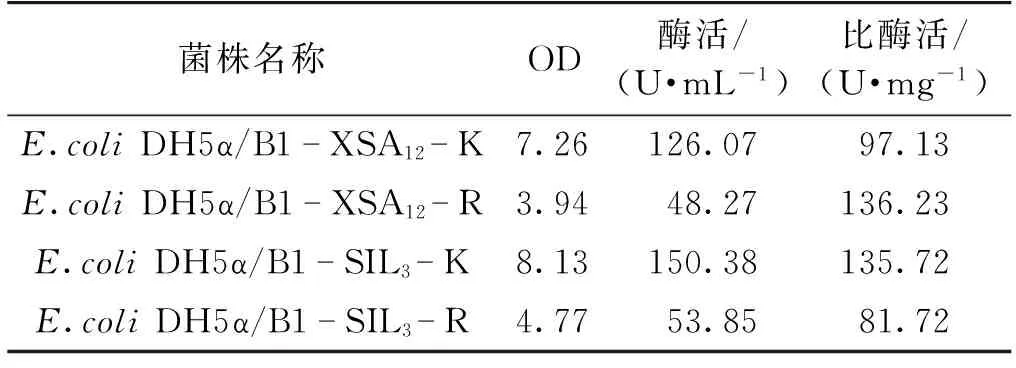
表6 终止子序列对重组菌株表达CAH的影响
2.4.3 不同CAH基因的组成表达
虽然2.3节中研究了不同CAH对底物CPC与7-ACA的催化能力,但是由于质粒的更换以及各基因调控元件的变化,可能对各基因本身的蛋白表达水平造成了不同的影响。为了选择最优的CAH基因与质粒的组合从而得到最佳工程菌,需要研究与新载体组合后各基因的蛋白表达能力。选用同样不含终止子序列、SD序列与ATG的间隔序列为B1的B1-1.107-K、B1-XSA12-K和B1-YIS-K、B1-SIL3-K 4种质粒,对其工程菌进行培养并测定发酵24 h后的OD、酶活与比酶活,结果见表7。由表7可以看出:相对于1.107、YIS基因,SIL3与XSA12基因的蛋白表达水平和蛋白产物对底物CPC与7-ACA的催化能力更高。其中,SIL3基因表达出来的CAH蛋白对底物CPC与7-ACA表现出最高的酶活与比活,而YIS虽然得到表达,但多为包涵体形式,酶活、比酶活较低,这些都与诱导型质粒的表达情况基本一致。
2.4.4 宿主对CAH表达的影响
不同宿主对组成型质粒的表达也具有很大的影响。选用同样不含终止子序列、SD序列与ATG的间隔序列为B1的B1-1.107-K、B1-XSA12-K、B1-YIS-K、B1-SIL3-K这4种质粒分别转入不同的宿主E.coliDH5α和E.coliJM109中,研究宿主不同对基因表达的影响,结果见表8。由表8可以看出:在相同的培养时间内,含有相同质粒的以E.coliJM109为宿主菌的工程菌比以E.coliDH5α为宿主菌的工程菌生长慢,表达的酶活低,所以选择E.coliDH5α作为宿主来进行CAH的表达。
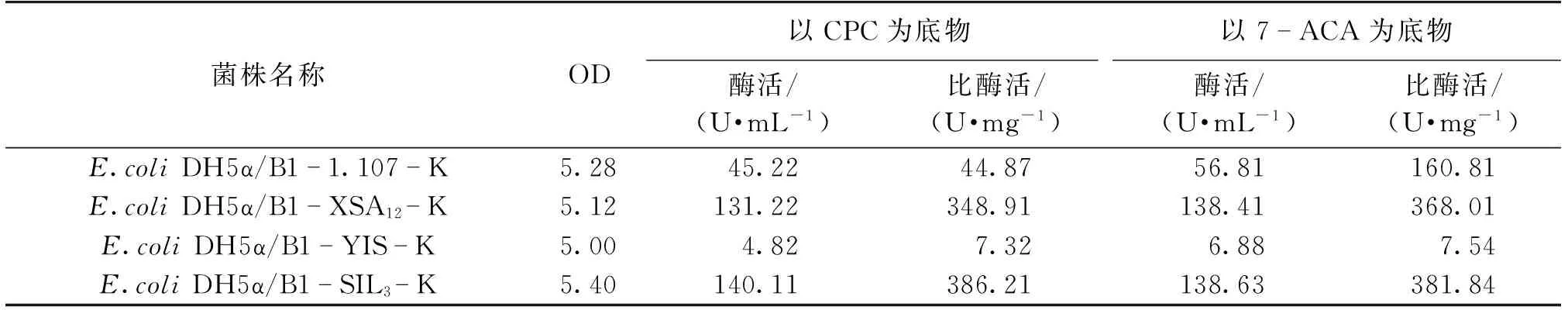
表7 不同CAH基因的组成型表达情况
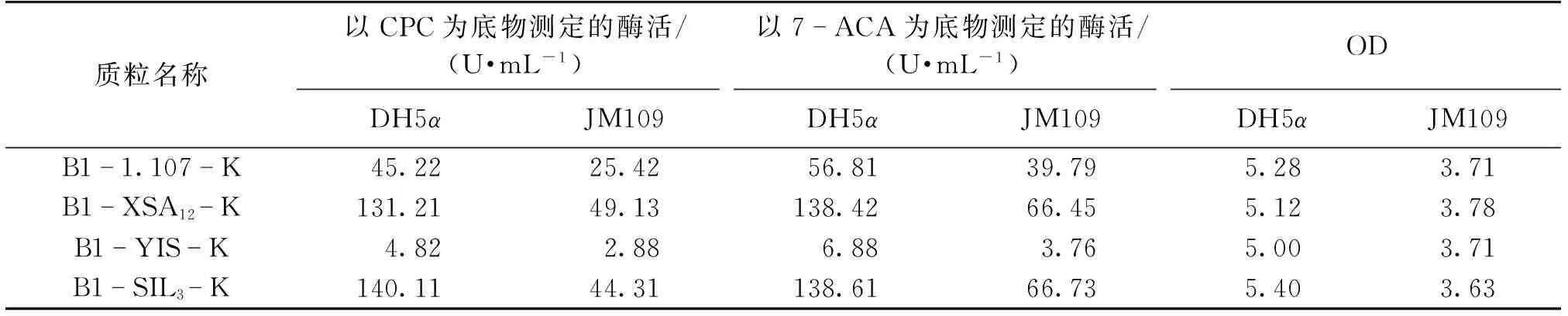
表8 不同宿主菌对CAH表达的影响
通过对上述几个因素的考察,最终选择带有pUC19上的起始位点、SIL3基因、trp启动子以及间隔序列为B1的组成型表达质粒pB1-SIL3-K为最佳表达质粒,以E.coliDH5α为最佳宿主菌。重组菌E.coliDH5α/pB1-SIL3-K在37 ℃培养24 h,酶活达到了138.61 U/mL。以E.coliDH5α/pB1-SIL3-K为工程菌株,对其培养基组成、培养条件、放大过程等进一步做了优化,在7 L发酵罐上,培养24 h后CAH最高酶活达到1 340 U/mL,此表达水平高于盐野义公司的报道值[12],为目前国内外文献报道的最高水平。
3 结论
从不同枯草芽孢杆菌中克隆CAH基因,并尝试在大肠杆菌中进行诱导型和组成型表达,以期获得最佳的CAH大肠杆菌重组表达工程菌,为CAH高效、低成本发酵制备奠定基础。论文主要结论如下:
1)从4株枯草芽孢杆菌中克隆得到4个不同CAH基因序列1.107、XSA12、YIS、SIL3。
2)4个CAH基因通过两种诱导表达质粒(pET-24a与pET-28a)重组表达,酶活最高的诱导型工程菌为E.coliBL21/pET28a-SIL3,培养24 h,酶活达到45.89 U/mL。
3)SIL3基因所表达的CAH对7-ACA、CPC的Km值都是最低值,分别为9.88 mmoL/L和17.60 mmoL/L。
4)SD序列与起始密码子ATG的间隔序列的碱基组成、终止子、CAH基因差异、宿主菌差异对CAH的组成型表达均有影响。
5)E.coliDH5α/pB1-SIL3-K为最佳的组成型表达菌株,培养24 h,OD可以达到5.40,以7-ACA为底物测定酶活达到138.61 U/mL。经过优化及放大,培养24 h后CAH最高酶活达到1 340 U/mL。
[1] 张幸幸,陈学玺.头孢菌素类抗生素的最新研究进展及发展趋势.广东化工,2013,40(16):80-81.
[2] 陈海龙,于沛.头孢类抗生素的新型中间体D-7-ACA.中国当代医药,2009,16(7):46-48.
[3] NOMURA H,FUGONO T,HITAKA T.Semisynthetic beta-lactam antibiotics sulfocephalosporins and their antipseudomonal activities.J Med Chem,1974,17(12):1312-1314.
[4] 于海军.去乙酰头孢C的分离及相关化合物的合成.天津:天津大学,2006.
[5] MA X Q,DENG S W,SU E Z,et al.One-pot enzymatic production of deacetyl-7-aminocephalosporanic acid from cephalosporin C via immobilized cephalosporin C acylase and deacetylase.Biochem Eng J,2015,95:1-8.
[6] KAPIL T,SUSAN E J.Origins of theβ-lactam rings in natural products.J Antibiot,2013,66:401-410.
[7] SAKAI Y,AYUKAWA K,YURIMOTO H,et al.A novel arylesterase toward 7-aminocephalosporanic acid fromAgrobacteriumradiobacterIFO 12607:purification and characterization.J Biosci Bioeng,1998,85:58-62.
[8] FUJISAWA Y,SHIRAFUJI H,KANZAKI T.Deacetylcephalosporin C formation by cephalosporin C acetylhydrolase ofCephalosporiumacremoniummutant.Agric Biol Chem,1975,39:1303-1309.
[9] CAO Y X,LU H,QIAO B,et al.Comparison of the secondary metabolites in two scales of cephalosporin C (CPC) fermentation and two different post-treatment processes.J Ind Microbiol Biotech,2013,40:95-103.
[10] ABBOTT B J,CERIMELE B,FUKUDA D S.Immobilization of a cephalosporin acetylesterase by countainment within an ultrafiltration device.Biotech Bioeng,1976,18:1033-1042.
[11] KONECNY J,SIEBER M.Continuous deacetylation of cephalosporins.Biotech Bioeng,1980,22:2013-2029.
[12] TAKIMOTO A,YAGI S,MITSUSHIMA K.High-level expression,purification,and some properties of a recombinant cephalosporin-C deacetylase.J Biosci Bioeng,1999,87:456-462.
[13] TAKIMOTO A,MITSUSHIMA K,YAGI S,et al.Purification,characterization and partial amino acid sequences of a novel cephalosporin-C deacetylase fromBacillussubtilis.Microbiology,1994,63:4807-4811.
[14] SAKAI Y,AOKI M,OHBAYASHI Y,et al.Purification and properties of cephalosporin-C deacetylase from the yeast,Rhodotorulaglutinis38Bl,useful for bioconversion of 7-aminocephalosporanic acid derivatives.J Ferment Bioeng,1998,85:53-57.
[15] POLITINO M,TONZI S M.Purification and characterization of a cephalosporin esterase fromRhodosporidiumtoruloides.Appl Environ Microb,1997,63:4807-4811.
[16] SAKAI Y,ABE T,OHBAYASHI Y,et al.Bioconversion of 7-aminocephalosporanic acid by intactRhodotorulaglutiniscells.Appl Environ Microb,1996,62(7):2669-2672.
[17] Sambrook J,Russell D W.分子克隆实验指南.黄培堂,译.北京:科学出版社,2002.
(责任编辑 荀志金)
Inducible and constitutive expression of cephalosporin-Cdeacetylase fromBacillussubtilisinEscherichiacoli
ZHU Ying1,MA Xiaoqiang1,YANG Shengli1,WEI Dongzhi1,SU Erzheng1,2
(1.New World Institute of Biotechnology,State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China; 2.Enzyme and Fermentation Technology Laboratory,College of Light Industry Science and Engineering,Nanjing Forestry University,Nanjing 210037,China)
In this work,8 inducible plasmids and 16 constitutive plasmids were constructed to fulfil the high-level heterogenous expression of cephalosporin-C deacetylase (CAH) gene inEscherichiacoli. A constitutive expression plasmid pB1-SIL3-K,with a replication origin derived from pUC19 and B1 sequence between theSIL3gene andtrppromoter,was selected as the most efficient expression plasmid.The OD and CAH activity expressed byE.coliDH5α/pB1-SIL3-K attained 5.4 and 138.61 U/mL when cultivating at 37 ℃ for 24 h.Furthermore, 1 340 U/mL of CAH activity was obtained in a 7-L fermenter by optimizing the medium components,culture conditions and scale-up process,which is the highest CAH activity reported to date.
cephalosporin-C deacetylase; inducible expression; constitutive expression; 3′-deacetyl-7-aminocephalosporanic acid
10.3969/j.issn.1672-3678.2017.02.004
2016-06-27
国家重点基础研究发展计划(973计划)(2012CB721003);国家高技术研究发展计划(863计划)(2012AA022206B);中央高校基本科研业务费专项资金;生物反应器工程国家重点实验室开放课题
朱 颖(1987—),女,山东聊城人,研究方向:酶工程;魏东芝(联系人),教授,dzhwei@ecust.edu.cn;苏二正(联系人),副教授,E-mail:ezhsu@njfu.edu.cn
TQ925
A
1672-3678(2017)02-0021-09

