Bacillusclarkii 7364 γ-环糊精葡萄糖基转移酶的可溶性表达及其催化特性分析
王 琰,万 一,李 皎,杨国武,邓 媛,王 军
(陕西省微生物研究所,陕西西安710043)
Bacillusclarkii7364γ-环糊精葡萄糖基转移酶的可溶性表达及其催化特性分析
王 琰,万 一,李 皎,杨国武,邓 媛,王 军
(陕西省微生物研究所,陕西西安710043)
按照大肠杆菌偏爱密码子对Bacillusclarkii7364来源的γ-环糊精葡萄糖基转移酶(γ-CGTase)进行优化,构建γ-CGTase原核表达菌株,摸索γ-CGTase的可溶性表达条件及纯化条件,并对其催化特性进行研究。结果表明:在28 ℃条件下实现了γ-CGTase的高效可溶性表达,可溶性蛋白占总蛋白表达量的63%,酶活可达3 830 U/mL。经(NH4)2SO4沉淀和α-CD-Sepharose 6B亲和柱纯化后,酶蛋白纯化了12.97倍,酶收率20.31%。使用该酶对木薯淀粉进行转化,转化产物中γ-环糊精(γ-CD)的比例可达90.9%,几乎无α-环糊精(α-CD),与天然酶的79%相比提高了15%。将该基因工程菌在20 L发酵罐中发酵,10 h后酶活达到4 375 U/mL,证实了其工业化放大的可能。该酶具有非常高的转化专一性,有非常好的工业化前景。
γ-CGTase;Bacillusclarkii;可溶性表达;纯化;产物专一性
环糊精(cyclodextrin,CD),是由若干个D-吡喃葡萄糖单元通过α-1,4糖苷键连接而成的环状低聚糖的总称。根据葡萄糖残基数目的不同,可将环糊精分为α、β和γ-CD,甚至更大的环状分子。由于其内疏水外亲水的中空筒状结构,使得环糊精能与各种客体分子形成包结复合物,从而改变客体分子的性质。因此,环糊精被广泛应用于医药、食品、化妆品、环保等众多领域,是一种具有重要价值的生物化工产品[2-3]。在环糊精的3种常用形式中,γ-CD具有的空腔和环结构均为最大,能够包合更大的客体分子,最好的水溶性使得其对活性大分子的增溶效果更为明显,因此,γ-CD的应用更加广泛[4-5]。
然而,目前γ-CD还未能实现工业化生产,主要原因是目前用于生产的环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGTase)的作用产物为α、β和γ-CD的混合物,加之γ-CD缺乏良好的后提取手段,因此,获取高专一性的γ-CGTase对于实现γ-CD的工业化生产具有重要意义。然而目前国内外对于高专一性γ-CGTase的研究报道较少。其中,Bacillussp.G-825-6的γ-CGTase在pH10.0条件下与10%可溶性淀粉反应,主要产生γ-CD和β-CD,转化率为10.7%;利用Bacillusclarkii7364野生菌株的γ-CGTase对137 g/L预胶状的马铃薯淀粉进行转化,产物中γ-CD占到79%;Brevibacteriumsp.no-9605菌株的γ-CGTase只产生β-CD和γ-CD,并且γ-CD在反应的起始阶段占据主要地位,当以44 g/L可溶性淀粉为底物,添加体积分数30%乙醇时,γ-CD产率最高为22%;Bacillussubtilis313的γ-CGTase只产生γ-CD,但是产率只有5%。国内研究则主要集中于高产γ-CGTase菌株的筛选,以及产酶发酵条件的优化。李皎等[10]筛选到一株芽孢杆菌32-3-10,其转化产物中3种环糊精γ-CD、β-CD与α-CD的质量比为53∶ 5∶ 50。纪丽萍等[11]对重组大肠杆菌产γ-环糊精葡萄糖基转移酶、王峰[12]对BacillusmacorousWSH02-06的产酶发酵条件进行了优化,都得到较优的产酶条件。
野生菌株大多存在产酶量低,发酵周期长的问题,通过大肠杆菌高效表达γ-CGTase仍是目前最有效的方式[13-14]。然而,大肠杆菌表达外源蛋白也存在其局限性,即常生成不具有生物活性的包涵体。因此,实现γ-CGTase的可溶性表达或胞外表达成为目前的研究热点。如,Jemlis等[15]在大肠杆菌中表达来源于多黏芽孢杆菌的γ-CGTase,通过37 ℃培养22 h后,诱导温度降为19 ℃,并将培养基从LB换为2TY,实现了该酶的可溶性表达,酶活达到22 U/mL。Kim等[16]通过共表达人肽基脯氨酰顺反异构酶 (PPIase),以及采用大肠杆菌高密度发酵技术和发酵上罐pH反馈补料技术实现了B.macerans来源的γ-CGTase在大肠杆菌中的可溶性表达,酶活达到1 200 U/mL。但这些可溶性表达的γ-CGTase并未进一步进行淀粉转化活性以及转化专一性的研究。
本文中,笔者将来源于B.clarkii7364的γ-CGTase基因按照大肠杆菌密码子进行优化后,将其构建到pET22b(+)载体中并转化E.coliBL21(DE3)。通过表达条件研究,实现该酶在大肠杆菌中的可溶性表达,并在20 L发酵罐中进行发酵验证。同时利用该酶进行淀粉转化研究,以期提高该γ-CGTase的转化专一性,从而为γ-CD的工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
E.coliDH5α、E.coliBL21(DE3)、pET22b(+)均保存于笔者所在实验室,pMD18-T-γ-CGTase载体委托上海桑尼生物技术有限公司合成并构建。
1.1.2 主要试剂
Taq DNA聚合酶、T4 DNA连接酶、限制性内切酶BamHI和NcoI等,大连宝生物工程有限公司(TaKaRa);α-CD、β-CD和γ-CD标准品,Sigma公司;质粒DNA提取试剂盒、胶回收试剂盒,Tiangen公司;IPTG、X-gal、乳糖、氨苄青霉素,昕泰生物公司;溶菌酶、透析袋,西安沃尔森生物科技有限公司;α-CD-Sepharose 6B填料,西安扛鼎生物科技有限公司;其他试剂均为国产分析纯。
γ-CGTase优化后序列由上海桑尼生物有限公司合成。
1.1.3 培养基
LB培养基(g/L):胰蛋白胨 10,酵母粉 5,NaCl 10。用5 mol/L NaOH调pH到7.0。
种子培养基(g/L):胰蛋白胨 16,酵母粉 10,NaCl 5,甘油 20。
初始发酵培养基(g/L):胰蛋白胨 2.5,酵母粉 2.5,NaCl 0.5,甘油 10,NH4Cl 0.5,K2HPO40.3,Na2HPO417.1,MgS04·7H2O 0.5。
1.2 方法
1.2.1E.coliBL21/pET22b(+)-γCGTase基因工程菌的构建
以GenBank公开发表的γ-CGTase基因序列(AB082929)为基础,根据大肠杆菌偏爱密码子从头设计并合成了新的γ-CGTase基因序列,并在序列的5’端和3’端各设计添加了1个BamHI和NcoI酶切位点。通过BamHI和NcoI双酶切pET22b(+)及pMD18-T-γ-CGTase,回收相应片段后进行连接,转化E.coliDH5α感受态细胞,在含100 μg/mL氨苄青霉素(Amp)的LB平板上筛选阳性克隆。通过菌落PCR和重组质粒双酶切进行验证。菌落PCR条件为94 ℃预变性10 min;再进行30个循环(94 ℃ 40 s,58 ℃ 40 s,72 ℃ 2 min);72 ℃延伸10 min。验证成功后的重组质粒转化E.coliBL21(DE3)并进行诱导表达。
1.2.2γ-CGTase水解活性的测定
采用碘液法测定γ-CGTase水解活性[17]。取10 μL酶液(对照不加酶液),加入0.2 mL 2.5 g/L的马铃薯淀粉溶液和0.2 mL 0.05 mol/L Tris-HCl (pH 8.0)缓冲液。40 ℃恒温水浴中保温10 min后立即加入0.5 mL醋酸溶液终止反应,并加入3 mL 0.05 g/L碘液显色,用分光光度计在700 nm处比色,记光密度值OD2。对照管光密度值读数记OD1。以OD1吸光值下降1/10 为1个酶活单位。每个样品做3个平行。酶活力按式(1)计算。
酶活力=(OD1-OD2)×100×
稀释倍数/(0.1×OD2)
(1)
1.2.3E.coliBL21/pET22b(+)-γCGTase的可溶性表达
从平板上挑取E.coliBL21/pET22b(+)-γCGTase的单菌落接种于10 mL含100 μg/mL Amp的LB培养液中,37 ℃培养过夜,次日以1%比例转接到含Amp的LB培养液中,37 ℃培养至OD600为0.4~0.6,用终浓度为1 mmol/L的IPTG分别在28、30和37 ℃进行诱导表达,诱导结束后离心收集菌体。按照10 mL/g菌体加入TE溶液 (10 mmol/L Tris-HCl,1 mmol/L EDTA,pH8.5) 进行重悬,再加10 μL/g的溶菌酶(50 mg/mL)进行裂菌,4 ℃裂解20 min后,加入10 mg/g脱氧胆酸钠、10 μL/g 1 mol/L MgCl2和1 μL/g DNase (25 mg/mL),搅拌至溶液无一点拉丝后,12 000 r/min离心15 min,分离上清和沉淀。15% SDS-PAGE检测γ-CGTase表达情况以及γ-CGTase在裂菌上清和沉淀中的分布情况。通过Biolog凝胶成像系统获得凝胶图谱,用软件ImageJ对凝胶图谱上的蛋白条带进行光密度扫描半定量分析,计算总蛋白量和可溶性蛋白的比例。
1.2.4 20 L发酵罐中γ-CGTase发酵条件
将种子液按6 %的接种量接入20 L全自动发酵罐(New Brunswick Scientific Bio Flo 415)中,装液量10 L,搅拌转速400 r/min,通气量1.8 L/min,37 ℃培养至OD600=5.0后加入终浓度为0.5 mmol/L的乳糖作为诱导剂并降温至28 ℃诱导培养7 h。
1.2.5 重组蛋白γ-CGTase的纯化
首先将含有目的蛋白的裂菌上清用50%饱和度的(NH4)2SO4沉淀过夜,12 000 r/min离心收集沉淀,并用0.01 mol/L乙酸缓冲液(pH5.5)溶解。在1 L 0.01 mol/L乙酸缓冲液(pH5.5)中透析3次后,12 000 r/min离心10 min,收集上清并用0.45 μm膜过滤,采用AKTA蛋白纯化仪纯化γ-CGTase。过α-CD-Sepharose 6B亲和柱,用含10 g/Lα-CD的0.01 mol/L乙酸缓冲液洗脱目的蛋白,收集洗脱峰。15%SDS-PAGE检测,对含有目的蛋白的洗脱峰在蒸馏水中透析后制备成冻干粉[18]。
1.2.6γ-CGTase转化产物的HPLC分析
用pH 8.0的Tris-HCl配制质量分数为10%的木薯淀粉,以700 U/g淀粉的量加入γ-CGTase粗酶液和5%(体积分数) 环己烷,58 ℃转化15 h。反应结束后5 000 r/min离心10 min,取上清液过0.45 μm膜,HPLC检测转化产物[19]。其中色谱柱为Thermo Phenyl-2 HYPERSIL (4.6 mm×150 mm),流动相为100%水溶液,流速1.0 mL/min,检测器为诺尔示差折光K-2301,柱温40 ℃,进样量10 μL。
2 结果与讨论
2.1 大肠杆菌E.coliBL21/pET22b(+)-γCGTase的构建
将经BamHI和NcoI双酶切的pMD18-T-γ-CGTase及载体pET-22b(+)进行连接,构建了pET22b(+)-γCGTase重组质粒表达载体,并对其进行了菌落PCR和重组质粒双酶切验证(图1)。将验证正确的pET22b(+)-γCGTase重组质粒转化到BL21(DE3)感受态细胞中,构建成E.coliBL21/pET22b(+)-γCGTase表达菌株。

M为标准DNA;1~6为pET22b(+)-γCGTase/DH5α的菌落PCR产物;7为PCR的阴性对照;8为重组质粒pET22b(+)-γCGTase的双酶切产物图1 pET22b(+)-γCGTase/DH5α的菌落PCR鉴定和重组质粒pET22b(+)-γCGTase的BamHI和NcoI双酶切鉴定Fig.1Identification of pET22b(+)-γCGTase/DH5α by colony PCR and identification of recombinant plasmid pET22b(+)-γCGTase with BamHI and NcoI double digestion
2.2γ-CGTase的可溶性表达
E.coliBL21/pET22b(+)-γCGTase表达菌株在37 ℃下经IPTG诱导后,经15% SDE-PAGE检测,与未诱导相比,经诱导的E.coliBL21/pET22b(+)-γCGTase在7.0×104附近有新条带产生,大小与预期理论值7.509×104基本相符(图2)。但是,目的蛋白主要以包涵体的形式存在。为了实现γ-CGTase的可溶性表达,分别在30 和28 ℃下对E.coliBL21 / pET22b (+)-γCGTase进行诱导表达,溶菌酶裂解菌体后,经15% SDS-PAGE检测,仅在28 ℃时实现了γ-CGTase的高效可溶性表达,并且可溶性蛋白表达量占总蛋白的63%(图3)。

M为标准蛋白;1为在37 ℃下IPTG诱导4 h的样品;2为在37 ℃下诱导样品的裂菌上清;3为在37 ℃下诱导样品的裂菌沉淀图2 E.coli BL21/pET22b(+)-γCGTase在37 ℃时诱导表达产物的SDS-PAGE分析Fig.2SDS-PAGE analysis of expression products in E.coli BL21/pET22b(+)-γCGTase at 37 ℃

M为标准蛋白; 1、5为未诱导的对照样品; 2为在30 ℃下IPTG诱导4 h的样品; 3为在30 ℃下诱导样品的裂菌上清;4为在30 ℃下诱导样品的裂菌沉淀;6为在28 ℃下IPTG诱导4 h的样品;7为在28 ℃下诱导样品的裂菌上清;8为在28 ℃下诱导样品的裂菌沉淀图3 E.coli BL21/pET22b(+)-γCGTase在28 ℃诱导温度下γ-CGTase的表达形式分析Fig.3Expression form of γ-CGTase in E.coli BL21/pET22b(+)-γCGTase at 28 ℃
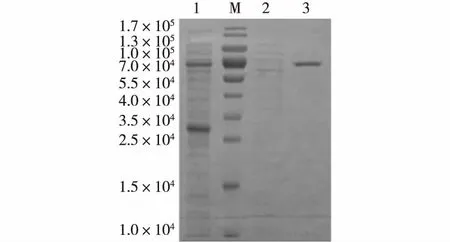
1为(NH4)2SO4沉淀再透析后的样品; M为标准蛋白;2为亲和柱纯化过程中的穿过峰; 3为纯化后的γ-CGTase图4 纯化的γ-CGTase的SDS-PAGE分析Fig.4 SDS-PAGE profile of purified γ-CGTase
2.3γ-CGTase的纯化及活性测定
E.coliBL21/pET22b(+)-γCGTase在28 ℃诱导的裂菌上清液经50%饱和度的(NH4)2SO4沉淀后复溶于0.01 mol/L乙酸缓冲液,过α-CD-Sepharose 6B亲和柱,用含10 g/Lα-CD的0.01 mol/L 乙酸缓冲液可以有效洗脱目的蛋白。纯化的蛋白经SDS-PAGE分析,获得表观电泳纯酶蛋白(图4)。对纯化的γ-CGTase溶液进行透析,冻干,制成干粉。采用1.2.2节的方法对获取的γ-CGTase冻干粉进行活性测定,其比酶活为64 400 U/mg。各步纯化样品的酶活力和蛋白质质量结果见表1。

表1 γ-CGTase的纯化总结表
2.4 20 L发酵罐发酵γ-CGTase验证及γ-CGTase作用产物分析
将种子液按6%的接种量接入20 L全自动发酵罐中,37 ℃培养至OD600=5.0后加入终浓度为0.5 mmol/L的乳糖并降温至28 ℃诱导培养7 h。发酵结束后共收集湿菌体456 g,测定发酵液菌上清酶活达到4 375 U/mL。与目前文献报道相比,Bacillusmacerans的CGTase[16]在大肠杆菌E.coliBL21(DE3)中进行可溶性表达,酶活为1 200 U/mL,通过降低诱导温度至30 ℃,添加0.5 mol/L甘露醇,可溶性蛋白量增加34倍(8.51 U/mL),活性CGTase为总蛋白的24%[20];Bacillusclarkii7364来源的γ-CGTase在大肠杆菌中培养16 h后得到可溶性表达。本研究仅通过降低诱导温度到28 ℃即实现了γ-CGTase的可溶性表达,并且γ-CGTase的酶活可达4 375 U/mL。
按照700 U/g淀粉的量加入γ-CGTase粗酶液,反应体系中木薯淀粉的质量分数为10%,转化15 h后,用HPLC检测转化产物。图5为α-CD、β-CD和γ-CD标准样品(10 mg/mL)和重组γ-CGTase转化生成α-CD、β-CD和γ-CD的HPLC色谱图。根据标准样品的浓度和峰面积计算转化产物中各CD的生成量,m(α-CD)∶m(β-CD)∶m(γ-CD)为1.33∶ 7.77∶ 90.9。原始菌Bacillusclarkii7364来源的γ-CGTase与10%可溶性淀粉在pH10.0和50 ℃条件下反应48 h后,γ-CD的转化率为10%,而该酶通过58 ℃反应15 h即实现γ-CD 10.7%的转化率,大大缩短了反应时间。同时,γ-CD的转化比例由原始菌的79%提高到90.9%,与目前文献报道相比,具有非常高的转化专一性,并且几乎无α-CD生成,具有非常好的工业化前景。但是该酶目前的转化率为10.7%,与达到工业化应用的30%[21]还有一定距离。因此,后续实验应充分利用该酶高专一性的优势,通过转化工艺的摸索,提高其转化率,从而为其工业化应用奠定坚实基础。
3 结论
通过对Bacillusclarkii7364来源的γ-CGTase按照大肠杆菌密码子进行优化后,成功构建了工程菌株pET22b(+)-γ-CGTase/E.coliBL21(DE3)。通过降低诱导温度到28 ℃实现了该酶在大肠杆菌中的可溶性表达,并且经20 L发酵罐放大发酵后,酶活可达4 375 U/mL。经过(NH4)2SO4沉淀和α-CD-Sepharose 6B亲和纯化后,酶蛋白纯化了12.97倍,酶收率20.31%。在pH 8.0、58 ℃条件下转化15 h后,γ-CD的转化比例可达90.9%,并且几乎无α-CD,证实该酶具有非常高的转化专一性,具有较好的工业化前景。
[1] QI Q,ZIMMERMANN W.Cyclodextrin glucanotransferase:from gene to application.Appl Microbiol Biotechnol,2005,66:475-485.
[2] 任爽,马麟莉,孟昭福,等.BS-12和β-环糊精复配修饰膨润土及其对苯酚吸附性能的初步研究.西北农林科技大学学报(自然科学版),2015,43(4):135-140.
[3] HAN R Z,LI J H,SHIN H D,et al.Recent advances in discovery,heterologous expression,and molecular engineering of cyclodextrin glycosyltransferase for versatile applications.Biotechnol Adv,2014,32(2):415-428.
[4] LI Z F,WANG M,WANG F,et al.γ-cyclodextrins:a review on enzymatic production and application.Appl Microbiol Biotechnol,2007,77(2):245-255.
[5] WANG F,DU G C,LY Y,et al.Regulation of CCR in theγ-CGTase production fromBacillusmacorousby the specific cell growth rate control.Enzyme Microb Tech,2006,39(6):1279-1285.
[6] HIRANO K,ISHIHARA T,OGASAWARA S,et al.Molecular cloning and characterization of a novelγ-CGTase from alkalophilicBacillussp..Appl Microbiol Biotechnol,2006,70(2):193-201.
[7] TAKADA M,NAKAGAWA Y,YAMAMOTO M.Biochemical and genetic analyses of a novel gamma-cyclodextrin glucanotransferase from an alkalophilicBacillusclarkii7364.J Biochem,2003,133(3):317-324.
[8] MORI S,HIROSE S,OYA T,et al.Purification and properties of cyclodextrin glucanotransferase fromBrevibacteriumsp. no-9605.Biosci Biotech Bioch,1994,58(11):1968-1972.
[9] KATOT,HORIKOSHI K.Cloning and expression of theBacillussubtilisNo.313γ-cyclodextrin forming CGTase gene inEscherichiacoli.Agric Biol Chem,1986,50(8):2161-2162.
[10] 李皎,杨国武,谢薇梅,等.γ-环状糊精生产用菌的筛选及初步鉴定.西北大学学报(自然科学版),2002,32(2):214-216.
[11] 纪丽萍,吴丹,吴敬,等.重组大肠杆菌产γ-环糊精葡萄糖基转移酶的摇瓶发酵优化.中国生物工程杂志,2011,31(10):50-56.
[12] 王峰.BacillusmacorousWSH02-06发酵法生产γ-环糊精葡萄糖基转移酶的研究.无锡:江南大学,2005.
[13] BANEYX F.Recombinant protein expression inEscherichiacoli.Curr Opin Biotech,1999,10(5):411-421..
[14] JANA S,DEB J K.Strategies for efficient production of heterologous proteins inEscherichiacoli.Appl Microbiol Biotech,2005,67(3),289-298.
[15] JEMLIS,BEN MESSAOUD E,BEN MABROUK S,et al.The cyclodextrin glycosyltransferase ofPaenibacilluspabuliUS132 strain:molecular characterization and overproduction of the recombinant enzyme.J Biomed Biotech,2008,2008:1-9.
[16] KIM S G,KWEON D H,LEE D H,et al.Coexpression of folding accessory proteins for production of active cyclodextrin glycosyltransferase ofBacillusmaceransin recombinantEscherichiacoli.Protein Expr Purif,2005,41(2):426-432.
[17] 淡家林,徐纯锡,任永娥.软腐芽孢杆菌D20产CGTase的条件和酶性质.微生物学报,1988,28(2):136-142.
[18] AVCI A,NICHOLS N N,BSAHA B C,et al.A thermostable cyclodextrin glycosyltransferase fromThermoanaerobactersp.5K.Curr Biotechnol,2014,3(4):305-312.
[19] 毛勇,邓媛,李皎,等.高效液相法同时测定混合环糊精中的α,β,γ-环糊精的含量.食品与发酵工业,2009,35(10):138-140.
[20] KIM M H,LEE J K,KIM H K,et al.Overexpression of cyclodextrin glycosyltransferase gene fromBrevibacillusbrevisinEscherichiacoliby control of temperature and mannitol concentration.Biotechnol Tech,1999,13(11):765-770.
[21] MARTINSR F,HATTI-KAUL R.A new cyclodextrin glycosyltransferase from an alkaliphilicBacillusagaradhaerensisolate:purification and characterization.Enzyme Microb Tech,2002,30(1):116-124.
(责任编辑 荀志金)
Expression and characterization of a recombinantγ-cyclodextringlycosyltransferase fromBacillusclarkii7364
WANG Yan,WAN Yi,LI Jiao,YANG Guowu,DENG Yuan,WANG Jun
(Microbiology Institute of Shaanxi,Xi′an 710043,China)
Theγ-CGTase gene sequence fromBacillusclarkii7364 was optimized according to the biased condons ofE.coliand its prokaryotic expression strain was constructed.The condition of expression ofγ-CGTase and the purification method ofγ-CGTase was established,and the catalytic characterization ofγ-CGTase was studied.Theγ-CGTase achieved highly soluble expression at 28 ℃ and the soluble expression protein accounts for 63% of the total protein,the enzyme activity reached 3 830 U/mL in the periplasm.The recombinantγ-CGTase was purified by ammonia sulfate precipitation,followed by affinity chromatography on aα-CD-Sepharose 6B affinity column,and the purification fold and yield was 12.97 and 20.31%,separately.After incubation with cassava starch,the majority (90.9%) of product CDs wasγ-CD that was about 15% higher than the wildγ-CGTase,and nearly noα-CD was detected.The engineering strain was cultivated in 20 L fermentor andγ-CGTase activity could reach 4 375 U/mL,which provided the possibility for further industrialization.The recombinantγ-CGTase showed very high specificity of transformation and would have better perspective in industrialization.
γ-cyclodextrin glycosyltransferase;Bacillusclarkii;soluble expression;purification;specificity of products
10.3969/j.issn.1672-3678.2017.02.002
2016-11-28
陕西省科学院应用基础研究项目(2013K-09);陕西省科学院科学技术平台项目(2015k-33)
王 琰(1982—),女,河南荥阳人,助理研究员,研究方向:基因工程类产品开发;万 一(联系人),研究员,E-mail:wanyi6565@sina.com
Q812;Q815
A
1672-3678(2017)02-0007-06

