DTPA胃漂浮囊心缓释片制备与体外释放性能
王立强, 卢迅, 应侠, 陈锐
(1. 华侨大学 生物医学学院, 福建 泉州 362021;2. 广州优米健医药科技有限公司, 广东 广州 510060)

DTPA胃漂浮囊心缓释片制备与体外释放性能
王立强1, 卢迅1, 应侠1, 陈锐2
(1. 华侨大学 生物医学学院, 福建 泉州 362021;2. 广州优米健医药科技有限公司, 广东 广州 510060)
采用粉末直接压片法制备二乙基三胺五乙酸(DTPA)胃漂浮囊心缓释片,并对其进行体外漂浮性能、释放性能和释药机理研究.结果表明:DTPA胃漂浮囊心缓释片在人工胃液中可以立即起漂,持续漂浮时间长达24 h,其释药过程用Korsmeyer-Peppas(Tlag)模型拟合的拟合度最好;同时,应用Harland方程进行验证,证明该制剂的释药过程主要为扩散和骨架溶蚀共同作用.通过该法制备的胃漂浮囊心缓释片具有起漂时间短、持续漂浮时间长、缓释效果好,漂浮性能不受制剂辅料和制备工艺的影响等优点. 关键词: 二乙基三胺五乙酸; 胃漂浮囊心缓释片; 漂浮性能; 释药机理
漂浮缓释制剂属于口服定位释药系统,具有吸收部位停留时间长、药物释放稳定等特点,是目前国内外缓控释剂型的研究热点[1].传统的胃漂浮型缓释制剂的漂浮性能和释药性能都要受制剂辅料和制备工艺的影响.二乙基三胺五乙酸(diethylene triamine pentaacetic acid,DTPA)是一种放射性核素促排药物,目前临床上使用的是DTPA-ZnNa3和DTPA-CaNa3的注射剂和喷雾制剂[2-3].它们虽有较好的促排效果,但是,此类无菌液体制剂在大规模核辐射事故爆发时,不利于大规模的储存、运输和使用.鉴于国内外目前尚未有DTPA的口服制剂上市,因此,本文将DTPA作为模型药物,制成一种新型的胃漂浮囊心缓释片,并对其体外漂浮性能、释放性能和释药机理进行考察.
1 材料与方法
1.1 仪器与试剂
DTPA(玛雅试剂有限公司),DTPA对照品(Sigma公司),乙二胺四乙酸二钠(EDTA-2Na)基准试剂(天津基准化学试剂有限公司),羟丙基甲基纤维素(HPMC,K4M)、微晶纤维素、糊精、卡波姆树脂和尤特奇S100(上海昌为医药辅料技术有限公司),滑石粉(上海泰坦科技股份有限公司),低取代羟丙基纤维素和四丁基碘化铵(上海晶纯生化科技股份有限公司),硬脂酸镁、盐酸和六水合三氯化铁(国药集团化学试剂有限公司),柠檬酸三乙酯(上海阿达玛斯有限公司),甘氨酸(Amresco公司),甲醇(美国天地公司),无水乙醇(西陇化工股份有限公司).
2450型紫外可见分光光度计(日本岛津公司),压片模具(哈尔滨东方模具厂),压片仪(日本岛津公司),RC-806型溶出试验仪(天津市天大天发科技有限公司),1200型高效液相色谱仪(安捷伦公司),OM220型智能鼓风干燥箱(上海欧迈科学仪器有限公司),HH.S11-2S型恒温水浴锅(上海跃进医疗器械厂),BSA124S型电子天平(赛多利斯科学仪器有限公司),SPH 111B型恒温摇床(上海世平实验设备有限公司),HJ-4型多头磁力加热搅拌器(江苏省金坛市友联仪器研究所),LRH型生化培养箱(上海一恒科技有限公司),H1650-W型台式微量高速离心机(湖南长沙湘仪离心机仪器有限公司),KQ-500E型超声仪(江苏省昆山市超声仪器有限公司).
1.2 DTPA胃漂浮囊心缓释片的制备
1.2.1 半片的制备 精密称取DTPA,HPMC(K4M)、微晶纤维素、糊精、低取代羟丙基纤维素、滑石粉和硬脂酸镁,按等量递增法混合,并过五号筛((180.0±7.6) μm)充分混匀;然后,使用特制的压片模具(上冲模Φ=8.22 mm,下冲模Φ=13.64 mm),压制出中部有凹面、周沿呈平面状的半片,半片质量为400 mg,硬度控制在4~5 kg之间,备用.
1.2.2 囊心材料的配制 量取处方量的无水乙醇和去离子水,混合,在室温条件下用搅拌器搅拌混匀,得混合溶剂;然后,称取处方量的尤特奇S100慢慢地分批倒入上述混合溶剂中,搅拌60 min,得尤特奇S100溶液;随后,将卡波姆加入到上述尤特奇S100溶液中,继续搅拌30 min,得混合溶液;最后,加入处方量的柠檬酸三乙酯,充分搅拌30 min,用三号筛((355±13) μm)过滤,得到囊心材料备用.
1.2.3 片剂单元的制备 将上述已制备好的囊心材料均匀喷洒在上述已制备好的半片的凹面处及其周沿,在凹面处及其周沿的表面形成包衣层,半片和囊心材料共同组成片剂单元.
1.2.4 囊心片剂的制备 在上述所得的片剂单元的囊心材料未凝固前,将两片片剂单元具有凹面的一面相对应扣合,在5~20 N的压力下将两个片剂单元的周沿粘合起来形成具有囊性空间的囊心片剂;然后,将粘合好的囊心片剂置于烘箱中,在40~60 ℃的温度下干燥烘干,即得该新型胃漂浮囊心缓释片.
1.3 体外释放度的测定
采用离子对高效液相色谱(HPLC)法检测DTPA的含量.根据已有文献[4-7]的报道,采用的色谱条件:色谱柱为依利特Sinochrom ODS-BP(5 μm,4.6 mm×150 mm);流动相为缓冲液(pH=2.8的甘氨酸-盐酸缓冲溶液)-甲醇(体积比为92∶8),内含4 mmol·L-1的TBA-I;流速为1.0 mL·min-1;检测波长为280 nm;柱温为室温;进样量为20 μL;内标物质为EDTA-2Na.体外释放度测定参照《中国药典》(2010年版,二部)附录XD释放度测定法的第一法与XC溶出度测定法的第二法进行[8].
2 实验结果与分析
2.1 标准曲线的绘制
精密称取0.4 g的DTPA对照品置于100 mL容量瓶中,加入0.1 mol·L-1盐酸溶解并定容至刻度线,摇匀,得4 mg·mL-1储备液.分别精密吸取该储备液0.5,1.0,1.5,2.0,2.5,3.0,3.5 mL置于50 mL容量瓶中,精密加入1.5 mL的4 mg·mL-1的EDTA-2Na内标溶液;然后,分别加入2.0,2.5,3.0,3.5,4.0,4.5,5.0 mL的4.96 mg·mL-1的 FeCl3溶液;最后,加入流动相定容至刻度线,摇匀,置于55 ℃水浴中反应1 h,取出,迅速冷却至室温,摇匀,过滤,吸取20 μL分别进样,按色谱条件分别进行测定.浓度在0.04~0.36 mg·mL-1范围之内,DTPA与内标峰面积的比值(Y)与DTPA浓度(X)呈良好的线性关系,其回归方程为

表1 回收率试验结果
Y=8.027 83X+0.048 85, R=0.999 89.
2.2 回收率试验
分别精密称取320,400,480 mg的DTPA各3份置于100 mL容量瓶中,按处方比例加入空白辅料;然后,用0.1 mol·L-1的盐酸溶液配制成浓度为3.2,4.0,4.8 mg·mL-1的DTPA溶液,摇匀,测定DTPA含量,计算回收率,结果如表1所示.由表1可知:平均回收率为100.10%;相对标准偏差(RSD)值为0.29%.
2.3 体外释放性能分析

图1 DTPA制剂的释药性能Fig.1 Drug release characteristics of DTPA preparation
在转速为75 r·min-1,温度为(37.0±0.5) ℃,释放介质为900 mL的人工胃液中,分别在不同时段取样5 mL,经0.45 μm微孔滤膜滤过,同时补充等温等体积的释放介质;然后,分别取续滤液适量于5 mL容量瓶中,加入适量的FeCl3和EDTA-2Na溶液,用流动相定容成待测溶液;最后,取待测溶液以HPLC法测定,计算每片在不同时间的累积释放度.
分别考察DTPA的胃漂浮囊心缓释片、半片制剂和无囊心胃漂浮缓释片的释药性能(n=6),如图1所示.图1中:η为DTPA的累积释放度;t为时间.由图1可知:DTPA半片制剂的药物释放速率明显比其他两种制剂快,12 h内药物就释放完全;无囊心的DTPA胃漂浮缓释片的释药性能在释药前8 h与DTPA胃漂浮囊心缓释片基本相似,只是在释药8 h后,制剂沉入杯底,药物的释放才会明显增快.
2.4 体外漂浮性能分析
将半片和囊心片剂分别置于(37.0±0.5) ℃的900 mL人工胃液中,转速为75 r·min-1,用照相机定时拍照,观察并记录半片和囊心片剂的起漂时间和持续漂浮时间.分别考察DTPA的胃漂浮囊心缓释片、半片制剂和无囊心胃漂浮缓释片的漂浮性能,如图2所示.由图2可知:DTPA半片制剂在整个释药过程始终不能漂浮,而DTPA胃漂浮囊心缓释片和无囊心的DTPA胃漂浮缓释片可以立即起漂.只是无囊心的DTPA胃漂浮缓释片在释药8 h后,会在不定的时间点出现不同程度的破裂,致使片剂内部充满液体而沉入杯底;而DTPA胃漂浮囊心缓释片在整个释药过程中可以始终保持漂浮状态,持续漂浮24 h以上.

(a) DTPA胃漂浮囊心缓释片 (b) DTPA的半片制剂 (c) 无囊心的DTPA胃漂浮缓释片图2 制剂的漂浮性能Fig.2 Floating characteristics of preparation
2.5 体外释药机理
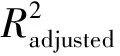

表2 DTPA胃漂浮囊心缓释片的释药模型拟合结果
2.5.2 释药机理分析 Korsmeyer-Peppas(Tlag)模型是Korsmeyer-Peppas模型的修饰形式,主要是考虑了药物从制剂中释放的滞留时间.Korsmeyer-Peppas(Tlag)模型是一个半经验公式,它是Higuchi模型的一般形式.对于圆柱型制剂(如片剂)而言,当拟合曲线时,只取药物累积的释放度在5%~60%的数据点,此时,可以通过拟合方程中的n值大小进一步分析药物的释放机理.n值的大小与制剂的几何形状、粒度分布等因素有关.当n≤0.45时,制剂的释药机制为Fick扩散;当0.45 为了进一步验证DTPA胃漂浮囊心缓释制剂的释药过程是non-Fick扩散,采用Harland等提出的Harland方程,对其进行进一步的验证,即 式中:F为t时间缓释片剂的累积释药量;α,β为常数;αt1/2为Fick扩散项;βt为骨架溶蚀项. 图3 DTPA累积释放度的拟合曲线Fig.3 Fitted curve of DTPA cumulative release 相应的拟合曲线(Harland方程,n=6),如图3所示.依据拟合的方程,分别计算出各时间点的Fick扩散释药量与骨架溶蚀释药量在累积释药量中的比例(w)(n=6),如图4所示.由图4可知:在整个释药过程中,Fick扩散与骨架溶蚀作用始终同时发生,即DTPA胃漂浮囊心缓释制剂的释药过程始终是non-Fick扩散.同时,在整个释药过程中,Fick扩散始终占主导地位;随着时间的延长,Fick扩散所占比例逐渐减少,骨架溶蚀作用释药所占比例逐渐增大. 图4 Fick扩散和骨架溶蚀作用所占释药比例Fig.4 Drug release rate of Fick diffusion and matrix erosion 所制备的DTPA胃漂浮囊心缓释片主要是依靠囊心结构的存在,来保证片剂在整个释药过程中始终保持它的完整性,可以持续漂浮直至释药完全,不会在释药过程中出现制剂下沉和瞬间释放现象.DTPA半片制剂在整个释药过程始终不能漂浮,无囊心的DTPA胃漂浮缓释片可以立即起漂,但是在释药8 h后会沉入杯底.除此之外,囊心结构的存在可以使胃漂浮缓释片的漂浮性能不受制剂辅料和制备工艺的影响,制剂的辅料和制备工艺只影响药物的溶出和释放.该缓释片可在胃内持续漂浮,延长胃内滞留时间,缓慢释放药物,从而达到减少服药次数、降低血药浓度的波动性,及提高患者用药依从性的目的.尤其是在大规模核辐射事故爆发时,该制剂便于患者自主用药,从而扩大使用范围. 采用多种释药模型对DTPA胃漂浮囊心缓释片的释药曲线进行了拟合,制剂的释药过程与Korsmeyer-Peppas模型(Tlag)拟合程度最高.进一步的研究表明,DTPA在此种新型骨架片中的释药过程为non-Fick扩散,即该制剂的释药过程是Fick扩散和骨架溶蚀的共同作用.随着时间的延长,Fick扩散所占比重逐渐减少,骨架溶蚀作用释药所占比重逐渐增大. 所制备的胃漂浮囊心缓释片通过体外实验证明,其体外漂浮性能和释放性能都较好,可进一步通过体内实验来证实.此外,含有这种囊心结构的片剂不仅仅只适用于DTPA这一种药物,在以后的研究中,可以将更多种适于制成胃漂浮片的模型药物用于制成此种制剂. [1] 陈伟茂.药物制剂新技术概述及其药剂制作中的实例研究[J].中国当代医药,2011,18(7):6-15. [2] SARIC M M,BLANUSA M,JURESA D,etal.Combined early treatment with chelating agents DMSA and CaDTPA in acute oral cadmium exposure[J].Basic Clin Pharmacol Toxicol,2004,94(3):119-123. [3] 陆志城.喷替酸钙三钠和喷替酸锌三钠注射液[N].医药经济报,2005,8(19):A07. [4] LAINE P,MATILAINEN R.Simultaneous determination of DTPA, EDTA, and NTA by UV-visible spectrometry and HPLC[J].Analytical and Bioanalytical Chemistry,2005,382(7):1601-1609. [5] 丁友超,李建军,吴丽娜,等.Fe3+络合-离子对液相色谱-串联质谱测定纺织品中乙二胺四乙酸盐和二乙烯三胺五乙酸盐[J].分析试验室,2012,31(8):27-32. [6] 陈红红,罗梅初,孙梅贞,等.反相高效液相色谱法测定二乙烯三胺五醋酸注射液的含量[J].中国现代应用药学,1998,15(6):40-42. [7] CAGNASSO C E,LOPEZ L B,RODRIGUEZ V G,etal.Development and validation of a method for the determination of EDTA in non-alcoholic drinks by HPLC[J].Journal of Food Composition and Analysis,2007,20(3/4):248-251. [8] 国家药典委员会.中华人民共和国药典: 二部[S].2010年版.北京:中国医药科技出版社,2010:附录86-87. [9] ZHANG Yong,HUO Meirong,ZHOU Jianping,etal.DDSolver: An add-in program for modeling and comparison of drug dissolution profiles[J].AAPS J,2010,12(3):263-271. [10] COSTA P,SOUSA L J.Modeling and comparison of dissolution profiles[J].Eur J Pharm Sci,2001,13(2):123-133. [11] TAHARA K,YAMAMOTO K,NISHIHATA O.Overall mechanism behind matrix sustained release tablets prepared with hydroxyprpyl methylcellulose 2910[J].J Controlled Release,1995,35(1):59-66. (责任编辑: 黄晓楠 英文审校: 刘源岗) Preparation andInVitroRelease of DTPA Intragastric Floating Sustained-Release and Capsule-Heart Tablets WANG Liqiang1, LU Xun1, YING Xia1, CHEN Rui2 ( 1. School of Biomedical Sciences, Huaqiao University, Quanzhou 362021, China;2. Guangzhou Youmijian Pharmaceutical Technology Company Limited, Guangzhou 510060, China) Diethylene triamine pentaacetic acid (DTPA) intragastric floating sustained-release and capsule-heart tablets were prepared by pressing the powder directly, and theinvitrofloatation, release characteristics and release mechanism were studied. Results indicated that DTPA intragastric floating sustained-release and capsule-heart tablets could float immediately in the simulated gastric fluid, floating up to 24 hours continuously, and theinvitrodrug release with Korsmeyer-Peppas (Tlag) model fitting was the best. At the same time, it was proved that the drug release was controlled by diffusion and matrix erosion together using Harland equation for validation. In conclusion, intragastric floating sustained-release and capsule-heart tablets have the advantages of short floating lag time, long floating duration and good sustained-release effect. In addition, the floating characteristics were not affected by the excipients and the preparation technologies. Keywords: diethylene triamine pentaacetic acid; intragastric floating sustained-release and capsule-heart tablets; floating characteristics; release mechanism 10.11830/ISSN.1000-5013.201702008 2016-10-25 王立强(1970-),男,教授,博士,主要从事药剂学和创新药物研发的研究.E-mail:wlq1599@163.com. 福建省自然科学基金资助项目(2015J01342) R 944 A 1000-5013(2017)02-0175-05
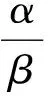
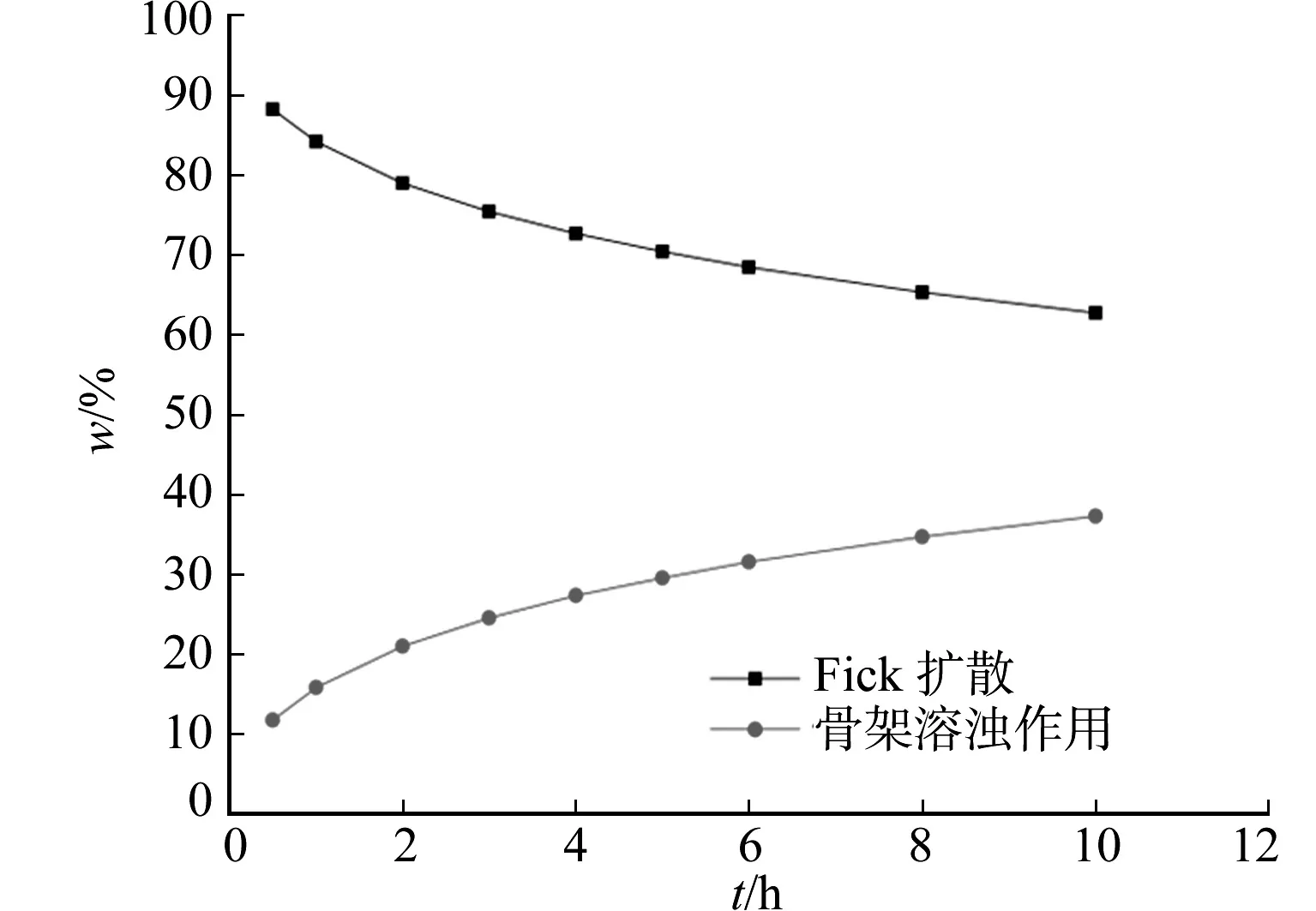
3 讨论

