金华猪MYLPF基因克隆与序列分析
宋倩倩,张金枝,蔣 梅,徐宁迎
(浙江大学动物科学学院,浙江杭州 310058)
试验研究
金华猪MYLPF基因克隆与序列分析
宋倩倩,张金枝,蔣 梅,徐宁迎
(浙江大学动物科学学院,浙江杭州 310058)
研究采用Trizol试剂提取70日龄金华猪肝脏组织的总RNA,反转录成cDNA,利用RT-PCR方法扩增MYLPF基因编码区全长序列,将纯化的目的片段与pClone007载体连接,转化至大肠杆菌DH5α感受态细胞,筛选出阳性克隆并测序,然后利用生物信息学软件分析其序列特征,并构建系统进化树。结果表明,金华猪MYLPF基因的cDNA核苷酸序列、RT-PCR产物长度为611 bp,重组后的质粒长度为756 bp,编码169个氨基酸,同源性分析表明,与大白猪的MYLPF 氨基酸序列完全相同。MYLPF分子进化树表明金华猪与鸡和斑马鱼的亲缘关系较远,与大白猪的亲缘关系最为接近。
MYLPF基因;克隆测序;金华猪
快肌肌球蛋白可磷酸化调节轻链(MYLPF)是一种肌浆球蛋白,存在种间差异。王娟等(2010)[1]通过对黏斑信号通路的研究,发现MYLPF参与细胞骨架的组成及细胞运动。肌球蛋白轻链激酶通过磷酸化作用和Ca2+结合可调节肌球蛋白轻链细肌丝的活性[2-4]。研究证实,MYLPF基因作为肌球蛋白轻链基因之一, 与猪的屠宰率、肌肉系水力、肉色和肌内脂肪存在一定的相关性,是重要的肉质基因,影响着猪的多种经济性状,因此对肉质改善具有重要影响[5-6]。
金华猪作为我国著名的优良地方猪种之一,具有肉质优良、肉味鲜美,后腿腌制成的“金华火腿”,质佳味香,外型美观,蜚声中外[7-8],开展金华猪肉质相关基因(如MYLPF基因)研究,有利于金华猪种质资源的开发与利用。
1 材料与方法
1.1 试验材料 70日龄金华猪,由金华家农两头乌种猪场提供,屠宰后,取其肝脏,液氮速冻,置于-80 ℃冰箱中保存备用。
1.2 主要试剂 Trizol试剂、质粒小提试剂盒(No.DP103)、DH5α感受态细胞(No.CB101)、DL2000 Marker购自北京某生化科技有限公司;Prime Script RT reagent Kit with gDNA Eraser(No.DRR037A) 、EX Taq(No.DR001A)、Gel Extraction Kit(胶回收试剂盒)购自大连某生物工程有限公司。特异性引物、载体通用引物及pClone007 Vector载体由杭州某生物技术有限公司提供,-20℃保存。
1.3 RNA提取 采用Trizol试剂提取金华猪肝脏组织的总RNA,取绿豆样大小的肝脏组织置于加有钢珠及添加Trizol试剂1 mL的离心管中,将离心管置于研磨仪中(频率70 Hz,时间90 s),研磨后静置10 min;再加入氯仿200 μL,混匀后静置15 min;然后在4 ℃,12000 r/min下离心15 min,取上清液置于新的离心管中,再加入异丙醇500 μL,混匀后静置10 min,然后在4 ℃,12000 r/min下离心10 min,弃上清,加入75%酒精1 mL进行洗涤,混匀后静置2 min,然后在4 ℃,7500 r/min下离心5 min,弃上清,晾干酒精后加入DNase/RNase-Free ddH2O 50 μL,RNA浓度及纯度(OD260/OD280)用核酸蛋白浓度测定仪测定(Nano Drop 2000)。余下样品-80 ℃保存备用。
1.4 cDNA合成 采用Prime Script RT reagent Kit with gDNA Eraser 进行逆转录反应。cDNA合成按下列组份配制RT反应液(反应液配制在冰上进行),基因组DNA 的除去反应:5×g DNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,Total RNA 1.0 μg,RNase Free dH2O加至10.0 μL,在42 ℃放置2 min。反转录反应:5×Prime Script Buffer 4.0 μL,Prime Script RT Enzyme MixⅠ 1.0 μL,RT Prime Mix 1.0 μL,再加入基因组DNA除去反应的反应液10.0 μL,RNase Free dH2O 加至20.0 μL。反转录反应条件为:37 ℃ 15 min(反转录反应),85 ℃ 5 s(反转录酶的失活反应)。-20 ℃保存备用。
1.5 PCR引物的设计和合成 根据GenBank中猪MYLPF基因的mRNA序列(NM_001006592),运用引物设计软件Primer 5.0设计引物,由杭州某生物技术有限公司合成。基因引物F1:5′-TTTTCCCAG CCAGAGCCACT-3′, R1:5′-TCAATTTATTAGGAAAC GAGCCAGG-3′,M13载体引物F:5′-TGTAAAACGA CGGCCAGT-3′,R:5′-CAGGAAACAGCTATGACC-3′。
1.6 PCR扩增与克隆 PCR扩增的反应体系为50 μL,其中金牌mix为45 μL、F/R primers各2 μL,模板cDNA为1 μL。PCR扩增程序为:98 ℃预变性2 min;98 ℃变性10 s;63 ℃退火20 s;72 ℃延伸10 s;最后72 ℃延伸1 min,循环数为30。PCR扩增产物用1%琼脂糖凝胶电泳检测,将目的条带用Gel Extraction Kit试剂盒纯化回收,回收后的PCR产物一部分直接送杭州某生物技术有限公司测序,其余部分纯化后的PCR产物与pClone007 Vector载体连接,转化至大肠杆菌DH5α感受态细胞,筛选出阳性克隆送杭州某生物技术有限公司测序。
2 结果与分析
2.1 RT-PCR 扩增结果 采用Trizol试剂提取金华猪肝脏组织的总RNA,逆转录后以cDNA为模板,用特异性引物进行RT-PCR扩增,然后用1%琼脂糖凝胶电泳检测。结果表明,RT-PCR产物长度为611 bp,与预期结果相符(详见图1)。
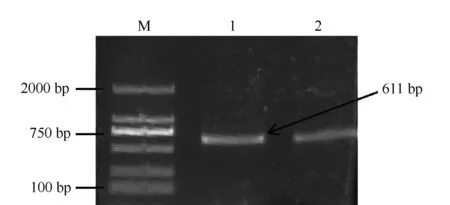
图1 RT-PCR 扩增结果(M:DL2000,1,2)
2.2 重组质粒电泳图 经纯化回收后的金华猪RT-PCR产物,利用M13引物与pClone007载体连接,构建重组质粒,然后用质粒小提试剂盒提取含有目的片段的质粒,进行PCR扩增。1%琼脂糖凝胶电泳结果显示重组后的质粒长度为756 bp,与预期结果相符(详见图2)。

图2 重组质粒PCR扩增结果(M:DL2000,2)
2.3 金华猪MYLPF基因序列分析比对 利用DNAman、Primer等多个生物学信息软件可以获得金华猪MYLPF 基因cDNA 序列编码的169个氨基酸(图3)。与NCBI网站BLAST后下载的人(NM_001324458.1)、大白猪(NM_001006592.1)、黑猩猩(XM_016928813.1)、小鼠(NM_012605.2)、大鼠(NM_016754.5)、山羊(NM_001285754.1)、绵羊(NM_001145183.1)、兔子(NM_001082761.1)、牛(NM_001075647.1)、鸡(NM_001198744.1)、马(XM_001496195.4)、斑马鱼(XM_004552448.3)等物种的氨基酸序列进行比对,相似性分别为96%、100%、96%、99%、99%、98%、98%、98%、98%、90%、98%、82%。
2.4 金华猪MYLPF基因进化树 利用MEGA5.10软件将金华猪MYLPF氨基酸序列与人、大白猪、黑猩猩、小鼠、大鼠、山羊、绵羊、兔子、牛、鸡、马、斑马鱼等物种的MYLPF氨基酸序列构建进化树。结果表明,金华猪MYLPF基因与鸡和斑马鱼亲缘关系较远,与其他10个物种较为接近,其中与大白猪的亲缘关系最为接近(详见图4)。

图3 金华猪MYLPF基因推导蛋白氨基酸序列

图4 MYLPF分子系统进化树
3 小结与讨论
MYLPF基因是由160个氨基酸组成的小分子蛋白,也是骨骼肌分化与生长的重要基因之一,对猪肉品质也有一定的影响[9]。本研究获得的金华猪MYLPF基因cDNA序列全长611 bp,重组后的质粒长度为756 bp,编码169个氨基酸。比天府肉羊的MYLPF基因cDNA和氨基酸序列分别少了5 bp和1个氨基酸,这可能与品种间差异有关[10]。
徐德全等(2005)[11]应用抑制消减杂交技术筛选出了猪MYLPF基因,研究了该基因的第5内含子多态性,结果表明该多态性与猪的胴体性状和肉质性状具有相关性,预测编码的氨基酸序列与人、小鼠和大鼠的同源性都在96%以上。本研究的同源性分析表明,金华猪与大白猪的MYLPF 氨基酸序列完全相同,与其它哺乳类动物的MYLPF 氨基酸序列相似性均在96%以上,研究表明金华猪与其它11个物种氨基酸序列间具有较高的保守性。
分子进化树表明,金华猪MYLPF基因与鸡和斑马鱼亲缘关系较远。通过DNAman软件分析,发现金华猪与大白猪的MYLPF基因核苷酸序列相似性达99.8%,仅有一个核苷酸差异,但并不影响氨基酸序列,从而表明MYLPF基因不是影响金华猪与大白猪肉质差异的主要基因。
[1]王娟,戴耀辉,贾丽华,等.口腔粘膜白斑的基因表达谱[J]. 中华口腔医学研究杂志(电子版),2010,4(6): 35-39.
[2] 朱玉贤,李毅,郑晓峰.现代动物生物化学[M].高等教育出版社,2007.
[3] 邹思湘.动物生物化学[M].中国农业出版社,2005.
[4] Lu Q,Bou-Gharios G,Partridge T. Non-viral gene delivery in skeletal muscle: a protein factory[J]. Gene therapy,2003,10(2):131-142.
[5] Davoli R,Fontanesi L,Cagnazzo M,et al. Identification of SNPs,mapping and analysis of allele frequencies in two candidate genes for meat production traits: the porcine myosin heavy chain 2B(MYH4) and the skeletal muscle myosin regulatory light chain 2 (HUMMLC2B)[J]. Animal genetics,2003,34(3):221-225.
[6] Bertani G,Johnson R,Robic A,et al. mapping of porcine ESTs obtained from the anterior pituitary[J]. Animal genetics,2003,34(2):132-134.
[7] 国家畜禽遗传资源委员会组编.中国畜禽遗传资源志猪志[M].北京:中国农业出版社,2011.
[8] 陶志伦,李雷斌.金华猪的现状与开发前景[J]. 浙江畜牧兽医,2002(3):21-22.
[9] Wang Y, Szczesna-Cordary D, Craig R, et al. Fast skeletal muscle regulatory light chain isrequired for fast and slow skeletal muscle development[J]. The FASEB Journal, 2007, 21(9):2205-2214.
[10] 徐洪刚.天府肉羊MYLPF和PID1基因克隆、表达及其与肌内脂肪含量关系研究[D].雅安:四川农业大学,2013.
[11] 徐德全.猪背最长肌差异表达基因的克隆鉴定及其特征分析[D]. 华中农业大学,2005.
2016-11-30
国家科技支撑计划(No.2015BAD03B01)、金华市农业局金华两头乌猪科技创新利用项目
S828.2
A
1005-7307(2017)02-0001-003

