臭氧胁迫对不同敏感型水稻叶片伤害的比较研究
邵在胜穆海蓉赵轶鹏,3贾一磊彭斌杨连新王云霞
臭氧胁迫对不同敏感型水稻叶片伤害的比较研究
邵在胜1穆海蓉1赵轶鹏1,3贾一磊1彭斌1杨连新1王云霞2,*
(1扬州大学 江苏省作物遗传生理国家重点实验室培育点/粮食作物现代产业技术协同创新中心,江苏 扬州225009;2扬州大学 环境科学与工程学院,江苏 扬州225009;3江苏徐淮地区徐州农业科学研究所,江苏 徐州 221121;*通讯联系人,E-mail: yxwang@yzu.edu.cn)
【目的】研究臭氧胁迫下不同敏感型水稻叶片表观响应特征,为耐性水稻品种的选育提供参考。【方法】利用自然光气体熏蒸平台,以23个水稻品种或株系为供试材料,臭氧设置室内对照(10 nL/L)和高臭氧浓度(100 nL/L)两个处理。采用组内最小平方和动态聚类方法,根据供试材料地上部最终生物量对高浓度臭氧的响应从小到大依次分为A、B和C 3个类别,研究臭氧胁迫下不同敏感类型水稻叶片伤害指数(LBS)特别是顶3叶叶色值(SPAD值,土壤、作物分析仪器开发)的动态响应及其与最终生长量变化的关系。【结果】臭氧胁迫使A、B和C 3类水稻成熟期地上部生物量平均分别下降19%、39%和52%,后两者降幅达极显著水平。臭氧处理水稻的LBS随生育期推移呈明显的增加趋势,但不同敏感类型水稻间均无显著差异,各测定时期表现一致。与对照相比,臭氧胁迫使不同测定时期的叶片SPAD值显著下降,降幅随熏蒸时间延长和叶位下移明显增加。全生育期平均,臭氧胁迫使所有供试材料倒1叶、倒2叶和倒3叶SPAD值分别下降11%、18%和30%,均达极显著水平。与此不同,臭氧胁迫对叶片SPAD值的影响不同水稻类型间无显著差异,不同测定时期趋势相同。相关分析表明,尽管臭氧胁迫水稻成熟期地上部生物量的响应与部分测定时期LBS存在一定的相关性,但其与所有测定时期叶片SPAD值变化的相关性均不显著,不同叶位趋势一致。【结论】在本研究条件下,臭氧熏蒸叶片的伤害指数和SPAD值的响应均不宜作为水稻生长对臭氧耐性程度的评价指标。
水稻;臭氧;生长;叶片伤害指数;SPAD值
臭氧是大气圈中的一种微量气体,由3个氧原子组成的带有特殊刺鼻臭味的强氧化剂。在平流层中臭氧具有吸收太阳有害紫外线的功能,而在对流层中它是一种对地球上生命有害的主要气体污染物。工业革命以来,随着工业化、城市化进程的加快,化石燃料、含氮化肥的大量使用以及汽车尾气的大量排放,臭氧前体物质氮氧化物和有机挥发物的排放量显著增加,导致臭氧污染事件发生的频度增加且持续时间延长。据报道,近地层臭氧浓度已经从工业革命前的38 nL/L上升到了目前的50 nL/L[1],模型预计2020年夏季亚洲部分地区甚至达到80~105 nL/L[2],对生命体产生严重危害[3]。
水稻是人类最重要的粮食来源之一,为全球半数以上人口提供营养[4]。我国中东部地区是近年来世界上臭氧浓度增幅最大的地区,高浓度的臭氧造成了该地区水稻产量损失约60万t[5]。已有研究表明,臭氧胁迫影响水稻叶片光合作用速率降低[6-8],摧毁抗氧化系统,加速叶片衰老[9-10],最终减少生物量和产量[11-13]。选育臭氧耐性水稻品种对保障世界和我国粮食安全意义重大,但选育的标准尚未确定[14]。Hur等[15]以3个水稻品种为供试材料,研究发现叶片谷胱甘肽还原酶、抗坏血酸过氧化物还原酶、丙二醛含量等生理指标可作为对臭氧耐性程度的评价指标,但就表观可判断的选育指标鲜有报道。叶片是水稻对臭氧胁迫的最初感应器官[16]。臭氧胁迫下叶片出现的伤害症状一般用叶片伤害指数来定量表示[17]。前人对水稻研究表明,臭氧胁迫叶片伤害指数的增幅因品种而异[18],但这些影响是否与最终生产力的变化一致鲜有报道。Sawada等[19]开顶式气室研究发现,臭氧胁迫下水稻苗期叶片的表观伤害症状并不能说明最终产量的损失情况,这在其他作物上也有类似研究结果[20]。叶片SPAD值作为用来诊断水稻氮素营养状况的关键指标。臭氧胁迫下叶片出现可见伤害症状的同时,叶片SPAD值亦降低[21-22],且抽穗后期的降幅明显大于抽穗期[7-8]。Sawada等[23]近期对3个水稻品种的观察发现,臭氧胁迫水稻剑叶SPAD值的响应存在品种间差异,但这种差异与最终生长量的变化是否存在关联还不清楚;另外,植株下位叶片SPAD值的响应是否与剑叶一致亦有待探明。
本研究依托自然光气体熏蒸平台[24],以23个水稻品种或株系为供试材料,根据供试材料地上部最终生物量对臭氧胁迫的响应分为3类不同敏感类型水稻,调查各类型水稻叶片伤害症状和顶3叶SPAD值的动态,分析臭氧胁迫下不同敏感类型水稻叶片伤害症状和顶3叶SPAD值响应的差异及其与地上部生物量响应的关系,旨在通过水稻主要光合器官叶片表观性状特征的变化为地表臭氧浓度升高情形下水稻耐性品种的选育提供参考。
1 材料与方法
1.1试验平台
试验于2013年在扬州大学农学院(119.42°E, 32.39°N)自然光气体熏蒸平台上进行。试验平台的结构和控制详见赵轶鹏等[24],简要说明如下:该平台分为上下两层,下层为设备间,上层共有4间相同并独立的气室,每个气室面积为9 m2,培育面积约为4 m2,气室中间为过道以便于相关测定,两侧为气体流通的进风口和出风口,增大了试验空间,且采用自然采光特别是土培方式培育植株,避免盆栽方式对根系生长的限制。在结构上采用分布式拓扑结构,通过实时监测由平台附属气象站观测采集到的温度变化,利用温度调控系统实现对外界环境的动态模拟,使气室内的温度与外界环境的差异维持在最小水平。
1.2生长条件及材料培育
试验土壤类型为清泥土,所在地年均降水量1000 mm左右,年均蒸发量在940 mm左右,年平均温度15 ℃,年日照时间大于2 100 h,年平均无霜期220 d。土壤理化性质如下:有机质24.3 g/kg,全N 1.5 g/kg,碱解N 126.1 mg/kg,全P 0.66 g/kg,速效P 13.4mg/kg,速效K 35.2 mg/kg,电导率为0.17 mS/cm,pH值为7.1。

图1 叶片伤害指数(LBS)调查参考Fig. 1. Investigation reference of leaf bronzing scores (LBS).
本研究以23个水稻品种或株系为供试材料,分别为L2、L9、L12、L17、L26、L35、L36、L48、L54、L56、L71、L81、L82、L92、L95、L105、L147、L152、L154、L156、日本晴、SL41和SL46,其中SL41和SL46为日本晴和野生稻品种Kasalath杂交得到的两个株系,其余均为SL41和SL46杂交再自交得到的株系[25]。大田旱育秧,5 月14 日播种,6 月5 日移栽,所有材料集中于7月下旬和8月上旬抽穗,9 月10 日开始收获。移栽密度为27 株/m2,每室3次重复,均随机分布。全生育总施氮量为15 g/m2,其中6 月4 日施基肥(占总施氮量的60%),7 月20 日施穗肥(占总施氮量的40%);磷、钾肥总施用量均为7 g/m2,均做为基肥一次性施用。氮、磷和钾肥分别使用尿素(有效成份为46.7%)、过磷酸钙(有效成份为27.5%)和氯化钾(有效成份为60%)。水分管理为6 月5 日-7 月15 日保持水层(约4 cm),7 月16 日-7 月25 日控水搁田,以轻搁为主,7 月26 日-8 月10 日保持水层(约3 cm),8 月10 日以后干湿交替,8 月25 日后断水。适时进行病虫草害防治,保证水稻正常生长发育。
1.3试验设计
共设置2个处理,即对照(浓度为10 nL/L,C-O3)和高浓度臭氧处理(浓度为100 nL/L,E-O3),每处理两个气室,气体先在下层混气箱中混匀再由风机输送至上层试验区内,由于与室外空气无接触,受外界环境干扰较小,臭氧浓度本底值较低,即室内对照臭氧浓度为10 nL/L,高浓度臭氧是以纯氧为气源,由佳环臭氧发生器(QD-001-3A)产生,通过Model 49i臭氧分析仪对臭氧浓度进行即时监测(间隔时间为1 min),并通过气体熏蒸控制系统(S7-200,Siemens)实现对目标气体浓度的设定。水稻返青后即6月13日开始进行熏气处理,9 月10 日停止熏气,共90 d。臭氧熏气时间设定为每天早上9:00至下午5:00。相对湿度在7月22日之前设定为78%,后根据室外平均湿度改为65%,9 月3 日至9 月10 日调整为50%,温度、光照和大气压力动态模拟外界环境。平台运行期间,因设备维护检修、雷雨天气以及臭氧分析仪校准等原因暂停布气(6 月17 日、7 月10 日、7 月17~18 日和7 月20~21 日,共6 d)外,其余时间系统运行正常。
1.4测定内容和方法
成熟期以穴为单位分别测定各品种地上部不同营养器官,即叶片、茎鞘和稻穗于105℃下杀青30 min,80℃下烘干72 h后,称量干物质量,并计算植株地上部总干物质量。
水稻移栽后10、12、19、27、41和59 d,对应日期分别为6 月14 日、6 月16 日、6 月23 日、7 月1 日、7 月15 日和8 月2 日,分别调查臭氧处理中水稻叶片的伤害症状,依据图1,将叶片分为没有伤害症状和10个不同伤害级[17],记录单穴植株顶3叶受伤害症状指数,并计算平均值,即为该植株叶片伤害指数(leaf bronzing score,LBS)。
叶片SPAD值:移栽后23 d、53 d、67 d和81 d(对应日期分别为6 月27 日、7 月27 日、8 月10 日和8 月27 日),采用SPAD-502 叶绿素仪(Minolta,日本)测定水稻叶片SPAD值,每穴植株测定同根单茎上的倒1叶(第1张完全展开叶,抽穗后均为剑叶)、倒2叶和倒3叶,测定的叶片部位在距叶尖1/3至1/2处,每张叶片测定3次后的平均值即为该叶片的SPAD值。
1.5统计分析方法
最小组内平方和动态聚类方法是以组内平方和之和最小为标准的新的动态聚类方法,能有效地调整初始分组中的个体,使其达到最优的分类,并具有良好的稳健性[26]。本研究采用这种聚类方法将供试材料按成熟期地上部生物量对臭氧胁迫的响应从低到高依次分为A、B和C 3种类型。使用Excel 软件进行基础统计和作图,应用SPSS19.0软件进行数据标准化处理和方差分析,处理间的比较采用最小显著差法(LSD),显著水平设P<0.01、P<0.05、P<0.1、P>0.1,分别用**、*、+和ns表示。
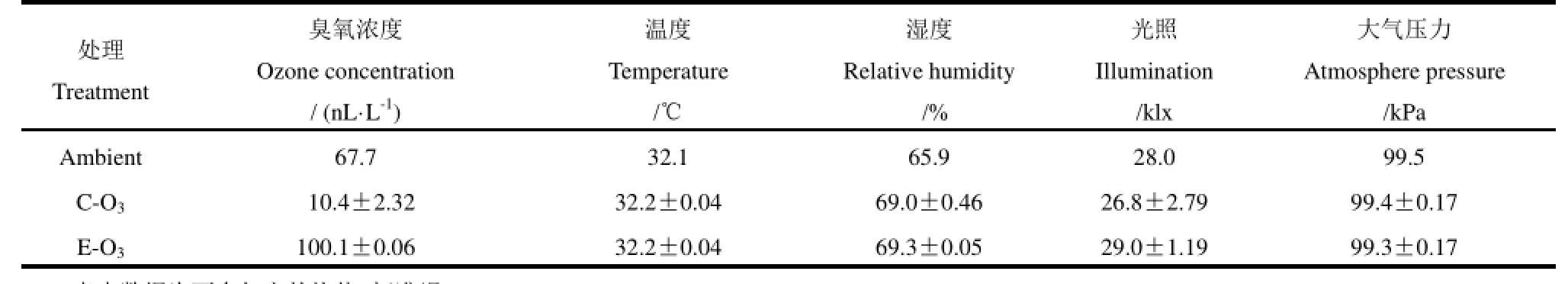
表1 臭氧熏蒸期间自然光气体熏蒸平台的控制情况(9:00-17:00)Table 1. The performance of greenhouse-type gas fumigation platforms during the period of ozone fumigation(9:00-17:00).

表2 不同类型水稻地上部生物量对臭氧胁迫响应的统计分析Table 2. Statistical analysis of ozone-induced changes in the above-ground biomass of different types of rice.
2 结果与分析
2.1臭氧熏蒸平台的控制
熏蒸平台臭氧、温度、光照和大气压的控制情况如图2和表1。熏蒸平台的控制一般用TAR(target achievement ratio,实际测定值/设定目标值)值来表示,TAR值越接近1,则控制精度越高。由图2可见,室内对照和高浓度臭氧处理熏蒸期间平均臭氧浓度分别为10.4和100.1 nL/L,臭氧精度控制的TAR值为1.01。整个臭氧熏蒸期间除光照强度由于平台框架结构的影响控制精度稍低,其他因子如温度、湿度和大气压力的控制均与目标值接近,TAR值均达到了1.00,满足试验要求。
2.2臭氧胁迫对不同类型水稻地上部生物量的影响
本研究采用组内最小平方和的动态聚类分析方法,根据23个水稻品种或株系成熟期地上部生物量对臭氧胁迫的响应大小,从低到高依次分为A、B和C 3个类别,各类供试材料详见表2。与对照相比,臭氧胁迫使A、B和C类水稻地上部生物量平均分别下降9.3、22.4和28.6 g/株,降幅分别为19.2%、38.5%和51.8%,后两者达极显著水平(图3)。方差分析表明,臭氧处理、水稻类型及其互作对地上部生物量的影响分别达0.01、0.05和0.1显著水平。多重比较表明,地上部生物量对臭氧胁迫的响应不同水稻类型间均达极显著水平(表2)。

图2 水稻生长季臭氧熏蒸期间8 h平均臭氧浓度变化(9:00-17:00)Fig. 2. Dynamic changes of daily 8-h mean ozone concentration during rice growing season (9:00-17:00).
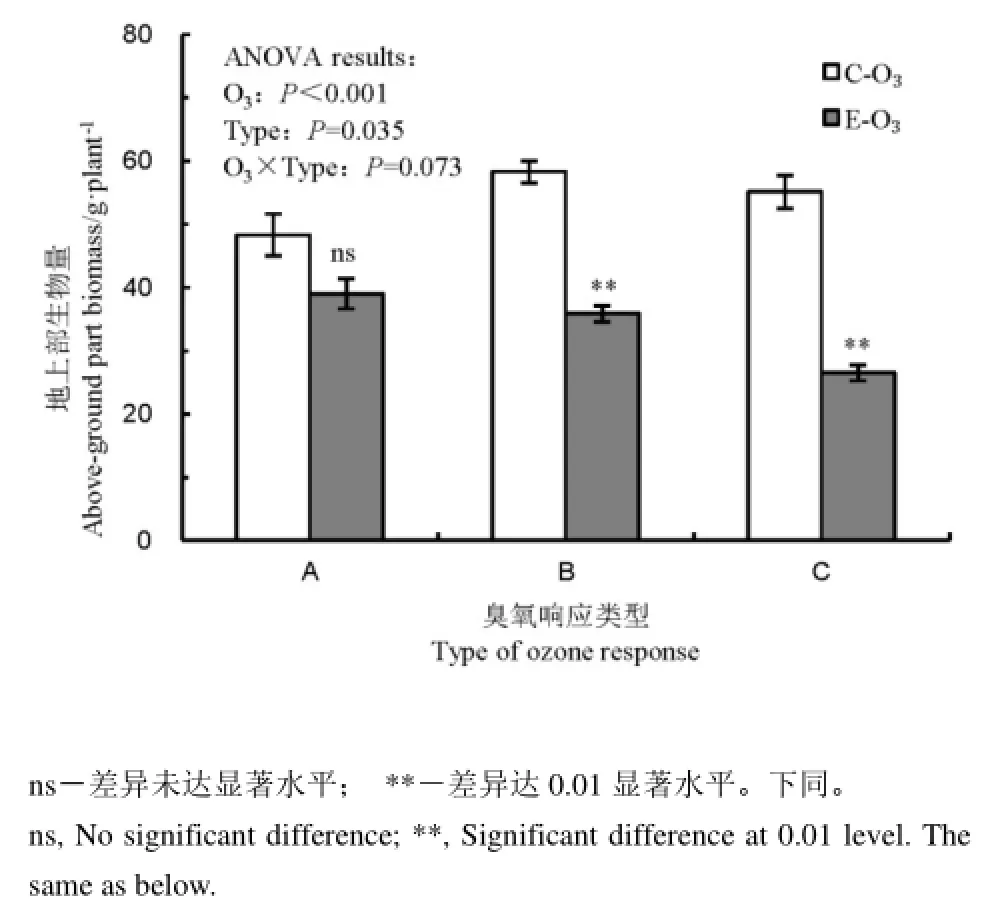
图3 臭氧胁迫对不同类型水稻成熟期地上部生物量的影响Fig. 3. Effects of ozone stress on the above-ground biomass of the different types of rice at maturity.

图4 臭氧熏蒸下不同类型水稻叶片伤害指数(LBS)的动态变化Fig. 4. Dynamic changes of the leaf bronzing scores (LBS) of different types of rice exposed to ozone.
2.3臭氧胁迫对不同类型水稻叶片伤害指数的影响
图4为臭氧胁迫下不同类型水稻的叶片伤害指数(LBS)。随着时间推移,臭氧熏蒸水稻的LBS不断增加,至移栽后41 d接近最大值,三类水稻趋势相同。从不同类型看,A类水稻移栽后10、12、19、28、41和60 d的LBS分别为0.28、0.78、2.47、3.75、6.50和6.33;B类水稻对应时期分别为0.21、0.65、2.72、4.11、6.45和6.38;C类水稻各对应时期分别为0.33、1.01、3.03、4.63、6.33和6.78。所有测定时期平均,臭氧熏蒸下A、B和C类水稻LBS平均分别为3.35、3.42和3.74。尽管该参数C类水稻略大于B类和A类,但多重比较表明不同水稻类型间无显著差异,各测定时期一致。
2.4臭氧胁迫对不同类型水稻功能叶SPAD值的影响
臭氧胁迫对不同敏感类型水稻倒1叶SPAD值的影响见图5。水稻移栽后23 d、53 d和67 d倒1叶SPAD值差异较小,但明显大于移栽后81 d。臭氧胁迫对A(n=18)和B(n=78)两类水稻移栽后23和53 d的倒1叶SPAD值无显著影响,但使C(n=42)类水稻平均下降4%左右,均达显著水平;臭氧胁迫使A、B和C类水稻移栽后67 d和81 d倒1叶SPAD值均极显著下降,其中移栽后67 d分别下降11.2%、9.0%和11.8%,移栽后81 d分别下降30.9%,32.3%和32.4%。全生育期平均,臭氧胁迫使A、B和C类水稻倒1叶SPAD值分别下降10.6%、9.4%和12.5%,均达极显著水平。方差分析表明,臭氧处理对水稻各期倒1叶SPAD值及全生育期平均值的影响均达0.05以上显著水平,但臭氧与水稻类型的互作对移栽后67 d和81 d及全生育期平均值均无显著影响。
不同类型水稻倒2叶SPAD值对臭氧的响应示于图6。水稻移栽后23 d、53 d和67 d倒2叶SPAD值差异较小,但明显大于移栽后81 d。与对照相比,臭氧胁迫使A类水稻移栽后23、53、67和81 d的倒2叶SPAD值平均分别下降11.9%、9.0%、15.4%和33.8%,B类对应时期分别下降11.3%、6.3%、17.4%和39.4%,C类水稻分别下降11.3%、8.4%、20.5%和37.8%,均达显著或极显著水平。全生育期平均,臭氧胁迫使A、B和C类水稻倒2叶SPAD值分别下降17.2%、17.8%和18.4%,均达极显著水平。尽管臭氧处理使水稻各期倒2叶SPAD值及全生育期平均值极显著下降,但臭氧处理与水稻类型间均无互作效应。
图7为不同类型水稻倒3叶SPAD值的动态变化。该叶位SPAD值随着生育进程推移呈一致的下降趋势,不同类型水稻趋势相似。臭氧胁迫使各类水稻倒3叶SPAD值均显著或极显著下降,且降幅随时间明显增加,其中A类水稻移栽后23、53、67和81 d平均分别下降20.6%、22.8%、29.5%和39.8%,B类水稻对应时期分别下降21.7%、25.7%、32.2%和46.2%,C类水稻分别下降21.6%、26.5%、34.5%和47.2%。全生育期平均,臭氧胁迫使A、B和C类水稻倒3叶SPAD值分别下降27.0%、30.6%和30.9%,均达极显著水平。臭氧处理使水稻各期倒3叶SPAD值及全生育期平均值极显著下降,但臭氧与水稻类型间的互作均未达显著水平。

图5 臭氧胁迫对不同类型水稻各测定时期倒1叶SPAD值的影响Fig. 5. Effects of ozone stress on SPAD value of the first leaf from the top of different types of rice at different testing stages.

图6 臭氧胁迫对不同类型水稻各测定时期倒2叶SPAD值的影响Fig. 6. Effects of ozone stress on SPAD value of the second leaf from the top of different types of rice at different testing stages.

图7 臭氧胁迫对不同类型水稻各测定时期倒3叶SPAD值的影响Fig. 7. Effects of ozone stress on SPAD value of the third leaf from the top of different types of rice at different testing stages.
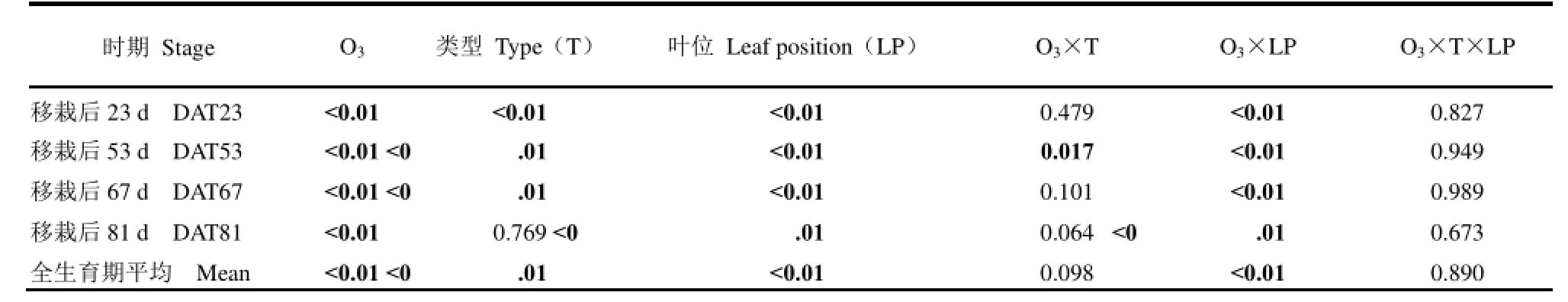
表3 不同类型水稻顶3叶SPAD均值对臭氧胁迫响应的显著性检验(P值)Table 3. Analysis of variance for ozone-induced changes in mean SPAD value of three leaves from the top of different types of rice (P value).

表4 水稻不同生长期LBS与地上部最终生物量对臭氧胁迫响应的相关分析Table 4. Correlation analysis of rice LBS at different growth stages and ozone-induced changes in above-ground part biomass.
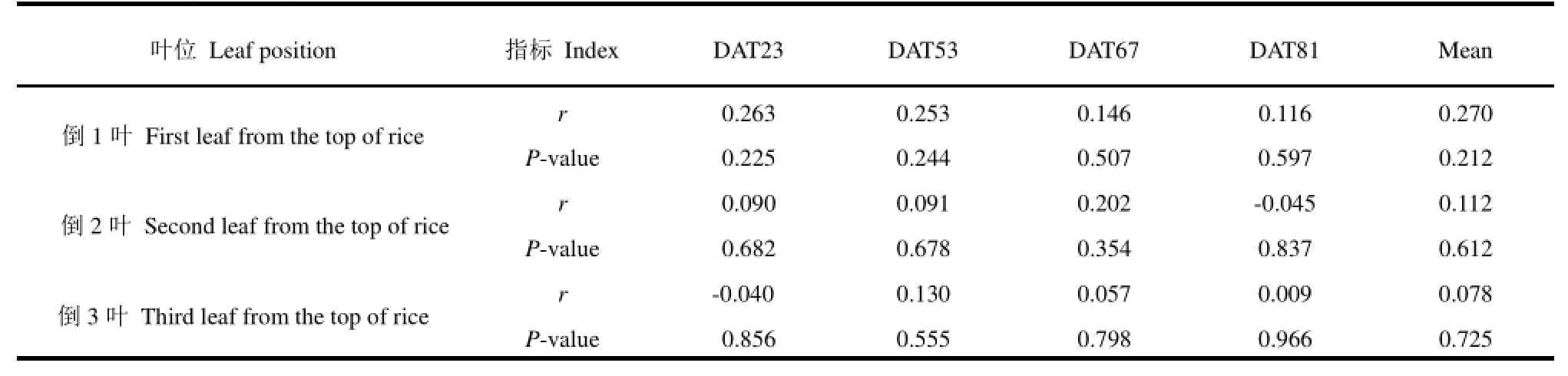
表5 水稻不同生长期叶片SPAD值对臭氧胁迫的响应与地上部最终生物量响应的相关分析Table 5. Correlation analysis of ozone-induced changes in rice leaf SPAD value at different growth stages and final above-ground part biomass.
对水稻不同测定期倒1、倒2和倒3叶SPAD值分别进行多重比较,结果表明水稻各叶位SPAD值对臭氧胁迫的响应不同类型间均无显著差异,不同时期及全生育期平均值结果相同。
综合分析水稻不同叶位SPAD值的测定结果表明(表3),除移栽后81 d不同水稻类型间无显著差异外,臭氧处理、不同类型和不同叶位三个主效应对叶片SPAD值的影响均达极显著水平。从主效应间的互作来看,只有臭氧处理与叶位间各期均表现出一致的交互作用。各类型水稻全生育期平均,臭氧胁迫使倒1叶、倒2叶和倒3叶SPAD值平均分别极显著下降10.8%、17.8%和29.5%,老叶的降幅明显大于新叶。
2.5不同类型水稻LBS和SPAD值对臭氧胁迫的响应与最终生物量响应的关系
水稻叶片性状对臭氧胁迫的响应与最终生物量响应的相关分析列于表4和表5。臭氧胁迫下最终生物量的响应与移栽后19 d、27 d和59 d LBS均呈显著正相关(相关系数为0.450~0.513),但与其它3个测定期相关均不显著(表4)。与此不同,臭氧胁迫下地上部生物量的响应与各期叶片SPAD值及全生育期平均值的相关均未达显著水平,不同叶位趋势一致(表5)。
3 讨论
本研究使用的自然光气体熏蒸平台采用土培方式培育水稻植株,并动态模拟室外的空气温度,试验环境与自然稻田较为接近[24]。水稻生长季平台运行数据表明,自然光气体熏蒸平台控制相对准确,满足试验要求。
地上部最终生物量被广泛地用于衡量水稻逆境条件下生长响应的重要指标[18],因为该指标较籽粒产量更少受结实期极端气候如高温的影响。本研究供试材料开花和灌浆期恰逢高温热害,因此根据水稻成熟期地上部生物量对臭氧胁迫的响应大小,通过聚类分析将23个供试材料分为A、B和C 3种敏感类型,结果表明,100 nL/L臭氧浓度使所有供试材料地上部最终生物量平均下降达37%,其中A、B和C类水稻分别下降19%、39%和52%,不同类型水稻的响应存在显著差异(表2和图3)。Ainsworth等[27]对前期气室研究的整合分析表明,与过滤空气相比,84 nL/L臭氧浓度使水稻地上部生物量平均下降16%(n=68)。本研究供试材料生长对臭氧的响应总体上明显大于前人整合分析的结果,特别是B、C两类水稻。这可能与本研究臭氧处理浓度较高以及供试材料较为敏感有关。
水稻叶片是近地层大气中臭氧进入植物组织的主要通道,是水稻对臭氧胁迫的最初感应器[16],臭氧进入叶片内,降低叶片光合作用、破坏膜结构的完整性、加剧植物叶片膜脂过氧化,叶片损伤并加速衰老,导致细胞死亡[9,28]。当大气中臭氧浓度超过40 nL/L时,就可使敏感品种产生可见伤害[29]。Nouchi等[30]报道,水稻叶片在100 nL/L臭氧浓度熏蒸35 d后受伤害叶的百分比达70%左右。本研究结果表明,臭氧熏蒸始期,叶片表面出现棕色或黄褐色的细密斑点,而且形状、大小较为一致,随时间推移叶片表面的坏死斑会增大并融合。根据叶片伤害症状给出叶片伤害指数(图1和图4),结果表明,随着臭氧熏蒸时间延长,叶片伤害症状越趋明显,臭氧熏蒸32 d时叶片LBS达6.5左右,这与Nouchi等[30]研究结论基本一致。另外,多重比较结果表明臭氧胁迫下不同水稻类型间LBS均无显著差异,各测定时期表现一致(图4)。A、B和C类水稻各期LBS平均分别为3.35、3.42和3.74,尽管C类水稻略大于B类和A类水稻,但不同类型间的差异很小,肉眼难于区分。Sawada等[19]研究结果亦表明叶片伤害症状与最终水稻产量损失情况关系并不密切,说明臭氧熏蒸叶片伤害症状不太适宜作为评价水稻对臭氧胁迫敏感性的指标。
叶片SPAD值是用来诊断水稻氮素营养状况的关键指标,具有快速、简便和无损等特点。臭氧胁迫使水稻叶片SPAD值降低[20-21]。我们近期对单一品种的大田臭氧研究发现,臭氧胁迫使汕优63抽穗期和抽穗后20 d剑叶SPAD值平均分别降低12%和23%[7]。本研究结果表明,臭氧胁迫使水稻移栽后23、53、67和81 d的倒1叶SPAD值平均分别下降2.1%、2.3%、10.7%和31.9%,降幅随时间明显增加(图5),这与前人报道基本一致。本研究还动态测定了倒2叶和倒3叶的SPAD值,结果发现,两个叶位SPAD值对臭氧胁迫响应的时间变化与倒1叶趋势相似,即随着生育进程的推移降幅明显增大(图6和图7);不同叶位比较,臭氧胁迫对叶片SPAD值的影响倒1叶<倒2叶<倒3叶。全生育期平均,臭氧胁迫使倒1叶、倒2叶和倒3叶分别下降11%、18%和30%。结合叶片伤害指数,本研究结果表明,臭氧胁迫对水稻叶片的伤害具有明显的累积效应。与新生叶相比,生育后期或植株下部的叶片(老叶)由于在臭氧中暴露的时间更长,因此伤害逐渐累积。
已有文献表明臭氧胁迫对水稻生长的影响因品种而异[12,31],但叶片SPAD值对臭氧胁迫响应的基因型差异报道甚少。Sawada等[23]气室研究发现,臭氧胁迫使Kirara397叶片SPAD值显著降低,而对另两个品种没有影响。本研究对23个供试材料不同时期顶3叶SPAD值的动态观察发现,尽管臭氧胁迫使不同敏感类型A、B和C类水稻顶3叶片SPAD值均呈显著下降趋势,但降幅不同水稻类型间无显著差异。进一步相关分析表明,不同叶位SPAD值对臭氧胁迫的响应与最终生物量的响应无显著相关性,不同时期结果一致(表5)。这一结果说明,臭氧胁迫导致不同敏感类型水稻最终生长量下降的可能机理与叶片伤害程度没有关联,故用叶片SPAD值的响应难以判定不同敏感型水稻生长对臭氧胁迫的耐性。本研究的前期报道表明,水稻生长中后期茎蘖数、最终成穗数、每穗颖花数、总颖花数以及养分吸收量的变化与水稻敏感类型关系密切,可作为抗臭氧品种选育的参考依据[32,33]。
4 结论
本研究表明,臭氧胁迫导致叶片伤害指数增加,相应的不同叶位SPAD值降低,臭氧胁迫对两参数的影响均表现出明显的累积效应,即叶片在高臭氧浓度环境中暴露的时间越长伤害越大。与此不同,臭氧处理LBS和不同叶位SPAD值对臭氧的响应不同水稻类型间均无显著差异,不同时期表现一致。可见,臭氧熏蒸叶片的伤害症状以及SPAD值的响应均不能反映水稻对臭氧胁迫的敏感程度。
[1] Fiscus E L, Booker F L, Burkey K O. Crop responses to ozone: Uptake, modes of action, carbon assimilation and partitioning. Plant Cell Environ, 2005, 28: 997-1011.
[2] Yamaji K, Ohara T, Uno I, Kurokawa J, Pochanart P, Akimoto H. Future prediction of surface ozone over east Asia using Models-3 Community Multiscale Air Quality Modeling System and Regional Emission Inventory in Asia. J Geophys Res, 2008, 113(D8): D08306.
[3] Cooper O R, Parrish D D, Stohl A, Trainer M, Nédélec P, Thouret V, Cammas J P, Oltmans S J, Johnson B J, Tarasick D, Leblanc T, McDermid I S, Jaffe D, Gao R, Stith J, Ryerson T, Aikin K, Campos T, Weinheimer A, Avery M A. Increasing springtime ozone mixing ratios in the free troposphere over western North America. Nature, 2010, 463(7279): 344-348.
[4] IRRI. Rice Almanac: Source Book for the Most Important Economic Activity on Earth. 3rd. Oxford: CABI Publishing, 2002.
[5] Feng Z W, Jin M H, Zhang F Z, Huang Y Z. Effects of ground-level ozone(O3)pollution on the yields of rice and winter wheat in Yangtze River delta. J Environ Sci-China, 2003, 15: 360-362.
[6] Pang J, Kobayashi K, Zhu J G. Yield and photosynthetic characteristics of flag leaves in Chinese rice(Oryza sativa L.) varieties subjected to free-air release of ozone. Agr Ecosyst Environ, 2009, 132: 203-211
[7] 彭斌, 李潘林, 周楠, 赖上坤, 朱建国, 杨连新, 王余龙. 不同秧苗素质和移栽密度条件下臭氧胁迫对水稻光合作用、物质生产和产量的影响. 生态学报, 2013, 33( 12) : 3668-3675.
Peng B, Li P L, Zhou N, Lai S K, Zhu J G, Yang L X, Wang Y L. Effects of ozone stress on photosynthesis, dry matter production and yield of rice under different seedling quality and plant density. Acta Ecol Sin, 2013, 33(12): 3668-3675. (in Chinese with English abstract)
[8] 彭斌, 赖上坤, 李潘林, 王云霞, 朱建国, 杨连新, 王余龙. 不同密度下臭氧胁迫对 Ⅱ 优 084 水稻光合作用和物质生产的影响——FACE 研究. 应用生态学报, 2015, 26(1): 17-24.
Peng B, Lai S K, Li P L, Wang Y X, Zhu J G, Yang L X, Wang Y L. Effects of ozone stress on photosynthesis and dry matter production of rice Ⅱ-you 084 under different planting densities. Chin J Appl Ecol, 2015, 26(1): 17-24. (in Chinese with English abstract)
[9] 金明红, 冯宗炜, 张福珠. 臭氧对水稻叶片膜脂过氧化和抗氧化系统的影响. 环境科学, 2000, 21(3): 1-5.
Jin M H, Feng Z W, Zhang F Z. Effects of ozone on membrane lipid peroxidation and antioxidantsystem of rice leaves. Chin J Envir Sci, 2000, 03: 1-5. (in Chinese with English abstract))
[10] 黄益宗, 隋立华. 臭氧污染胁迫下植物的抗氧化系统调节机制. 生态毒理学报, 2013, 04: 456-464.
Huang Y Z, Sui L H. Antioxidant mechanism of plants under ozone stress. Asian J Ecotoxicol, 2013, 04: 456-464. (in Chinese with English abstract)
[11] Frei M. Breeding of ozone resistant rice: Relevance, approaches and challenges. Environ Pollut, 2015, 197: 144-155.
[12] 杨连新, 王余龙, 石广跃, 王云霞, 朱建国, Kobayashi K, 赖上坤. 近地层高臭氧浓度对水稻生长发育影响研究进展. 应用生态学报, 2008, 19(4): 901-910.
Yang L X, Wang Y L, Shi G Y, WangY X, Zhu J G, Kobayashi K, Lai S K. Responses of rice growth and development to elevated near-surface layer ozone (O3) concentration: a review. Chin J Appl Ecol, 2008, 19(4): 901-910. (in Chinese with English abstract)
[13] Kobayashi K, Okada M, Nouchi I. Effects of ozone on dry matter partitioning and yield of Japanese cultivars of rice (Oryza sativa L.). Agr Ecosyst Environ, 1995, 53(2): 109-122.
[14] Pandey A K, Majumder B, Keski-Saari S, Kontunen-Soppela S, Mishra A, Sahu N, Pandey V, Oksanen E. Searching for common responsive parameters for ozone tolerance in 18 rice cultivars in India: Results from ethylenediurea studies. Sci Total Environ, 2015, 532: 230-238.
[15] Hur J S, Kim P G, Yun S C, Park E W. Indicative responses of rice plant to atmospheric ozone. Plant Pathol J, 2000, 16(3): 130-136.
[16] Sagar V K, William J M. Atmospheric ozone: Formation and effects on vegetation. Environ Pollut, 1988, 50(1-2): 101-137.
[17] Wissuwa M, Ismail A M, Yanagihara S. Effects of zinc deficiency onrice growth and genetic factors contributing to tolerance. Plant Physiol, 2006, 142(2): 731-741.
[18] Frei M, Tanaka J P, Wissuwa M. Genotypic variationin tolerance to elevated ozone in rice: dissection of distinct genetic factors linked to tolerance mechanisms. J Exp Bot, 2008, 59(13): 3741-3752.
[19] Sawadw H, Kohno Y. Differential ozone sensitivity of rice cultivars as indicatedby visible injury and grain yield. Plant Biol, 2009, 1435-8603.
[20] Picchi V, Iriti M, Quaroni S, Saracchi M, Viola P, Faoro F. Climate variations and phenological stages modulate ozone damages in field-grown wheat. A three-year study with eight modern cultivars in Po Valley (Northern Italy). Agr Ecosyst Environ, 2010, 135(4): 310-317.
[21] Olszyk D M,Wise C. Interactive effects of elevated CO2and O3on rice and flacca tomato. Agr Ecosyst Environ, 1997, 66(1): 1-10.
[22] Phothi R, Umponstira C, Sarin C, Siriwong W, Nabheerong N. Combining effects of ozone and carbon dioxide application on photosynthesis of Thai jasmine rice (Oryza sativa L.) cultivar Khao Dawk Mali 105. Aust J Crop Sci, 2016, 10(4): 591-597.
[23] Sawada H, Komatsu S, Nanjo Y, Khan N A, Kohno Y. Proteomic analysis of rice response involved in reduction of grain yield under elevated ozone stress. Environ Exp Bot, 2012, 77: 108-116.
[24] 赵轶鹏, 邵在胜, 宋琪玲, 赖上坤, 周娟, 王云霞, 秦超, 杨连新, 王余龙. 一种新型自然光气体熏蒸平台:系统结构与控制精度. 农业环境科学学报, 2012, 31(11): 2082-2093.
Zhao Y P, Shao Z S, Song Q L, Lai S K, Zhou J, Wang Y X, Qin C, Yang L X, Wang Y L. System structure and control accuracy of a solar-illuminated gas fumigation platform. J Agro-Environ Sci, 2012, 31(11): 2082-2093. (in Chinese with English abstract)
[25] Wang Y X, Yang L X, Meike H, Shao Z S, Pariasca-Tanaka J, Wissuwa M, Frei M. Pyramiding of ozone tolerance QTLs OzT8 and OzT9 confers improved tolerance to season-long ozone exposure in rice. Environ Exp Bot, 2014, 104: 26-33.
[26] 顾世梁, 莫惠栋. 动态聚类的一种新方法一最小组里平方和法. 江苏农学院学报, 1989, 10(4): 1-8.
Gu S L, Mo H D. A new dynamic clustering method-MinSSw mehtod. J Jiangsu Agric Coll, 1989, 10(4): 1-8. (in Chinese with English abstract)
[27] Ainsworth E A. Rice production in a changing climate: A meta-analysis of responses to elevated carbon dioxide and elevated ozone concentration. Glob Change Biol, 2008, 14: 1642-1650.
[28] Ueda Y, Siddique S, Frei M. A novel gene OsORAP1 enhances cell death inozone stress in rice (Oryza sativa L.). Plant Physiol, 2016, 169: 873-889.
[29] Tausz M, Grulke N E, Wieser G. Defense and avoidance of ozone under global change. Environ Pollut, 2007, 147(3): 525-531.
[30] Nouchi I, Ito O, Harazono Y, Kobayashi K. Effects of chronic ozone exposure on growth, root respiration and nutrient uptake of rice plants. Environ Pollut, 1991, 74(2): 149-164.
[31] Shi G Y, Yang L X, Wang Y X, Kobayashi K, Zhu J G, Tang H Y, Pan S T, Chen T, Liu G, Wang Y L. Impact of elevated ozone concentration on yield of four Chinese rice cultivars under fully open-air field conditions. Agr Ecosyst Environ, 2009, 131(3): 178-184.
[32] 邵在胜, 沈士博, 贾一磊, 穆海蓉, 王云霞, 杨连新,王余龙. 臭氧浓度增加对不同敏感型水稻元素吸收与分配的影响. 农业环境科学学报, 2016, 35(9): 1642-1652.
Shao Z S, Shen S B, Jia Y L, Mu H R, Wang Y X, Yang L X, Wang Y L. Impact of Ozone Stress on Element Absorption and Distribution of Rice Genotypes with Different Ozone Sensitivity. J Agro-Environ Sci, 2016, 35(9): 1642-1652. (in Chinese with English abstract)
[33] 邵在胜, 沈士博, 贾一磊, 穆海蓉, 王云霞, 杨连新,王余龙. 臭氧胁迫对不同敏感型水稻生长和产量形成的影响. 中国农业科学, 2016, 17: 3319-3331.
Shao Z S, Shen S B, Jia Y L, Mu H R, Wang Y X, Yang L X, Wang Y L. Impact of ozone stress on growth and yield formation of rice genotypes with different ozone sensitivity. Sci Agric Sin, 2016 17: 3319-3331. (in Chinese with English abstract)
A Comparative Study of Ozone-induced Leaf Injury of Rice with Different Ozone Sensitivity
SHAO Zaisheng1, MU Hairong1, ZHAO Yipeng1,3, JIA Yilei1, PENG Bin1, YANG Lianxin1, WANG Yunxia2,*
(1Jiangsu Key Laboratory of Crop Genetics and Physiology/Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, China;2College of Environmental Science and Engineering, Yangzhou University, Yangzhou 225009, China;3Xuzhou Institute of Agricultural Sciences of the Xuhuai Region of Jiangsu Province, Xuzhou 221121, China;*Corresponding author, E-mail: yxwang@yzu.edu.cn)
【Objective】In order to provide reference for ozone-tolerant rice breeding, the leaf characteristics of rice with different ozone sensitivity in response to ozone stress were studied.【Method】By using glasshouse-type fumigation chambers, 23 rice cultivars or lines were grown in soil from around a week after transplanting to maturity at two ozone concentrations: low ozone concentration as control (C-O3, 10 nL/L) and high ozone concentration as elevated O3treatment (E-O3, 100 nL/L). Based on the decrease in the above-ground biomass under high ozone concentration, these rice genotypes were clustered into three types by the MinSSw (dynamic clustering method-minimum sum of squares within groups) method, namely A, B and C in the order of ozone sensitivity from low to high, respectively. The effects of ozone stress on leaf bronzing score (LBS) and Soil and Plant Analyzer Development (SPAD) values of the top three leaves were examined, and the relationships between leaf LBS or SPAD under ozone stress and the ozone-induced changes in the above-ground biomass at maturity stage were studied.【Result】Ozone stress decreased the above-ground biomass of three rice types A, B and C at maturity by 19%, 39% and 52%, respectively, and significant treatment effects were detected in B and C. The LBS of rice under ozone stress increased along with the process of plant growth, but no significant difference was detected among different types of rice, irrespective of growth stages. Compared to the control, ozone stress significantly decreased the leaf SPAD values of all growth stages, and the decline was increased with the prolonging fumigation time and the lowering leaf position. Averaged across all growth stages, ozone stress significantly decreased the leaf SPAD values of the first, second and third leaf from the top by 11%, 18% and 30%, respectively. On the contrast, the influence of ozone stress on the leaf SPAD values showed no significant difference among different types of rice, and different growth stages showed the same trend. Correlation analysis showed that, although there were positive correlations between the ozone-induced changes in the rice above-ground biomass and LBS of a few growth stages, the ozone-induced changes in the above-ground biomass were not closely associated with that of the leaf SPAD values of all growth stages, and same trends were observed for all leaves at different leaf positions.【Conclusion】The above results indicated that under current experimental conditions, leaf bronzing score and leaf SPAD value were not suitable index to evaluate the rice tolerance to ozone stress.
rice; ozone; growth; leaf bronzing score; SPAD value
Q945.78; S511.01
A
1001-7216(2017)02-0175-10
2016-06-21;修改稿收到日期:2016-10-11。
国家自然科学基金面上项目(31471437和31371563);江苏省自然科学基金资助项目(BK20151298和BK20161161);扬州大学“新世纪人才工程”资助项目;江苏高校优势学科建设工程项目。
——硫酰氟熏蒸应用技术

