硫代乙酰胺诱导大鼠肝纤维化模型合并肾脏病变
秦冬梅,李静,陈文,王新春
(1石河子大学药学院,新疆 石河子832002;2石河子大学医学院第一附属医院,新疆 石河子832002)
硫代乙酰胺诱导大鼠肝纤维化模型合并肾脏病变
秦冬梅1*,李静2,陈文1,王新春2
(1石河子大学药学院,新疆 石河子832002;2石河子大学医学院第一附属医院,新疆 石河子832002)
为建立硫代乙酰胺诱导大鼠肝纤维模型,分析肝组织病理切片及肝纤维血清指标等,并检查肾脏病理改变。方法:选取Wistar大鼠60只,随机分为对照组30只、模型B组、模型C组、模型D组,每组10只。根据大鼠体重,采用腹腔隔天注射硫代乙酰胺诱导肝纤维化,观察大鼠肝纤维化形成情况与肾脏组织学变化。结果显示,与对照组比较,模型组大鼠ALT、AST血清浓度均升高(P<0.01),T-SOD活性显著降低,GSH-PX活性显著降低,MDA含量显著升高(P< 0.01)。模型C组与模型D组LN、HA与对照相比有明显差别(P<0.01),模型D组CIV、PCⅢ与对照相比有明显差别(P< 0.05)。模型B组LN与对照组相比有明显差别(P<0.01)。肝脏病理组织提示模型组大鼠肝细胞大量坏死,假小叶形成,肾组织有轻度病变。由此可知,硫代乙酰胺能诱导大鼠形成肝纤维化,并且造成肾脏病理改变。
硫代乙酰胺(TAA);肝纤维化;腹腔注射
慢性肝病是一类十分常见的疾病,肝纤维化(Hepatic fibrosis,HF) 是各种慢性肝病向肝硬化发展的必经的病理过程[1-2]。肝纤维化是指由于肝损伤诱因的持续存在,导致肝细胞持续坏死,继发肝脏类炎症或损伤后修复过程中持续的炎症反应,导致肝脏内纤维性结缔组织异常增生,以细胞基质在肝内过量沉积为特征的病理变化。其终末阶段称为肝硬化,最终导致肝衰竭门脉高压和肝癌。如果要深入研究肝纤维化的发病机制,成功建立比较接近人肝纤维化的动物模型是首要问题。它必须是一个慢性的发生发展过程,且应该成模率高,制模方法简易过程,且成模后逆变缓慢,便于探讨肝纤维化形成的分子机制和抗肝纤维化药物的作用机理[3]。
本研究中,我们选用硫代乙酰胺诱导大鼠产生肝纤维化模型,分析肝组织病理切片及肝纤维血清指标等,考察该方法成模率及形成机制,并且观察该化合物对主要排泄器官肾脏的影响,旨在为进一步模型给药奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
Wistar大鼠60只(180-250 g)(新疆维吾尔自治区疾病预防控制中心)(合格证号:2011-00145)。
1.1.2 药品与试剂
硫代乙酰胺TAA(分析纯,天津市光复精细化工研究所)、蒸馏水、甲醛溶液(分析纯,天津市致远化学试剂有限公司)、0.9%Nacl注射液(西安京西双鹤药业有限公司)、AST、ALT、T-SOD、MDA、GSH-PX、LN、PCⅢ、CIV与HA试剂盒均购自南京建成生物工程研究所。
1.1.3 仪器
FA2104B电子天平(上海精密科学仪器有限公司)、一次性注射器、大鼠解剖器具、电热恒温水浴锅(北京长安科学仪器厂)、722N型可见分光光度计(上海精密科学仪器有限公司)、TDL-5台式离心机(上海安亭科学仪器厂)、漩涡混合器(江苏海门其林医用仪器厂)。
1.2 方法
1.2.1 动物分组与模型建立
将60只大鼠按分层随机分笼法分为对照组与模型B组、模型C组、模型D组,对照组30只,模型组每组10只。所有大鼠在常温条件下自由饮水自由摄取标准鼠粮,适应性饲养1周后再进行实验。
将TAA用灭菌注射用水配制成质量浓度为40 mg/mL的溶液。模型1组、模型2组和模型3组以200 mg/kg隔日腹腔内注射。
1.2.2 标本的收集与处理
大鼠分别于三周末、五周末、七周末给药后24小时用戊巴比妥以mg/kg1腹腔注射麻醉后,经腹主动脉采血,离心 15 min(3000 r/min),分离血清,冷冻保存,备用。
观察肝脏颜色及形态后取出,经0.9%生理盐水灌注冲洗残血,大鼠肝脏用10%中性甲醛固定,用于病理诊断。
1.2.3 观察指标及测定方法
1.2.3.1 一般情况、体质量及肝脾指数
定期观察大鼠的体态变化,记录体重。用电子天平称取大鼠肝脏和脾脏的质量,计算器官指数。器官指数=器官质量(g)/大鼠体重(g)*100。
肝脏标本经10%甲醛固定,石蜡包埋切片,进行HE染色。于光镜下观察肝组织炎症,由同一病理专科医生予以纤维化分级。
1.2.3.2 血清肝功及肝纤维指标
血清AST、ALT、T-SOD、MDA、GSH-PX、Ⅲ型前胶原N端肽(PCⅢ)、Ⅳ型胶原(IV-C)、层粘连蛋白(LN)与透明质酸(HA)检测按试剂盒说明书进行操作,由全自动生化分析仪测定。
1.2.3.3 肝组织病理学检测
将取下的肝组织标本用10%甲醛固定后,常规脱水,包埋,制作成5 μm厚切片,HE染色,光镜下观察。HE染色由石河子大学第一附属医院病理科专家盲法阅片,分别在低倍镜(×10)、高倍镜(×40)下观察肝组织的病理学改变。
肝纤维程度判断标准参照王泰龄等[4-5]提出的慢性肝炎分类、分级与分期的统计方法。肝纤维化程度分级标准为:
0:无纤维化;
Ⅰ:轻度纤维化,纤维沉积仅位于小叶中央;
Ⅱ:中度纤维化,纤维沉积扩展至小叶中央之外,但未至小叶边缘;
Ⅲ:严重肝纤维化,纤维沉积扩展至小叶边缘;
Ⅳ:早期肝硬化(定性标准)。
1.2.3.4 肾组织病理学检测
肾脏摘下后去除包膜,长轴方向对切。10%中性福尔马林固定、石蜡包埋切片,切片厚度4 μm。切片HE染色光镜观察20个高倍视野。病理损伤标准:
(1)肾小管损伤标准:细胞空泡变性、小管塌陷(与间质纤维化和小管膜增厚无关)、小管肿胀;
(2)肾间质损伤标准:单个核细胞浸润,间质细胞空泡变性、水肿及间质纤维化、瘢痕化。
1.3 统计学处理
用统计软件SPSS17.0进行分析,计量资料用均数±标准差(±S)表示,采用t检验。P<0.05认为差异有显著的统计学意义,P<0.01认为差异有非常显著的统计学意义。
2 结果与分析
2.1 各组大鼠一般生存情况
造模期间,模型B组大鼠死亡1只,肝纤维化形成率为60%。模型C组死亡1只,肝纤维化形成率为90%。模型D组死亡4只,肝纤维化形成率为90%。
死亡原因为注射TAA过量所致(诱导期的肝脏相对敏感),剖腹可见肝脏肿胀并大面积坏死,其中两只出现肝腹水。对照组未出现死亡。
2.2 各组大鼠质量变化
对照组大鼠平均质量整体高于模型各组大鼠平均质量。对照组大鼠体质量增长呈上升趋势,模型组大鼠的体质量在14 d内下降较快,35 d后大鼠体质量变化不大,趋于平稳。建立的模型表明:大鼠体质量变化为10 g-20 g,提示有适度肝脏损害以维持肝硬化进程[7]。
2.3 各组大鼠器官指数变化
各组大鼠器官指数变化见表1。
与对照组相比,模型B组大鼠的肝脏指数显著性升高(P<0.01),脾脏指数无统计学意义。模型C组的肝脏指数显著性升高(P<0.01),脾脏指数升高(P<0.05),模型D组的肝脏指数、脾脏指数均显著性升高(P<0.01)(表1)。
表1 各模型组大鼠肝脏、脾脏系数变化 ±STeb.1 Changes of liver and spleen indexs in various model rats

表1 各模型组大鼠肝脏、脾脏系数变化 ±STeb.1 Changes of liver and spleen indexs in various model rats
注:与对照组比较,*P<0.05,**P<0.01
2.4 各实验分组大鼠血清学指标的变化
2.4.1 ALT、AST、SOD、MDA、GSH-PX指标变化
与对照组相比,模型组的血清AST、ALT水平均显著升高(P<0.01),模型B组的ALT、AST水平最高,模型C组与模型D组的AST、ALT水平相当,比模型B组的水平低。模型组的T-SOD、GSH-PX活性随时间延长逐渐降低(P<0.01),模型组的MDA活性随时间延长逐渐升高(P<0.01)(表2)。
表2 各组大鼠ALT、AST、SOD、MDA、GSH的变化 ±STab.2 Changes of levels of ALT、AST、T-SOD、MDA and GSH-px in various model rats
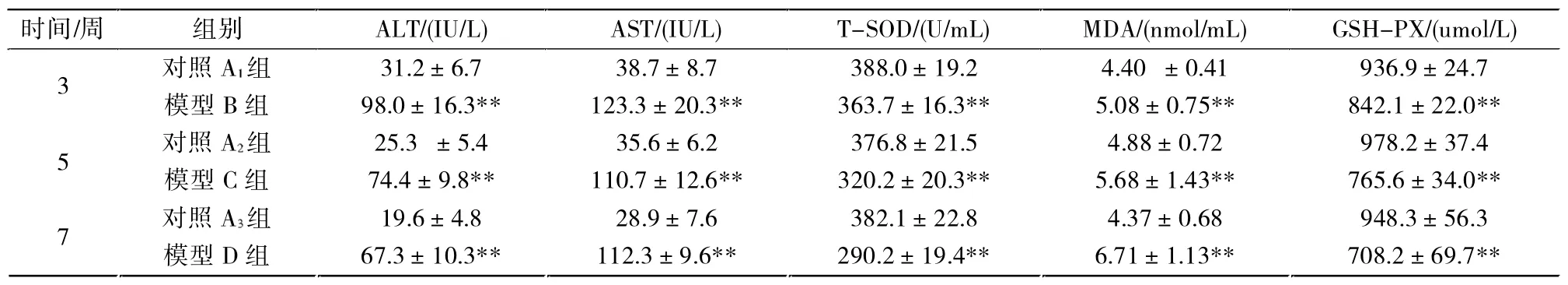
表2 各组大鼠ALT、AST、SOD、MDA、GSH的变化 ±STab.2 Changes of levels of ALT、AST、T-SOD、MDA and GSH-px in various model rats
注:与对照组比较,*P<0.05,**P<0.01。
2.4.2 各组大鼠血清LN、HA、IV-C与PCⅢ的比较
模型C组与模型D组LN、HA与对照相比有明显差别(P<0.01),模型D组CIV、PCⅢ与对照相比有明显差别(P<0.05)。模型B组LN与对照组相比有明显差别(P<0.01)(表3)。
表3 各模型组大鼠血清 LN、HA、IV-C和PCⅢ水平变化 ±STab.3 Changes of levels of LN、HA、IV-C and PCⅢ in varions model rats
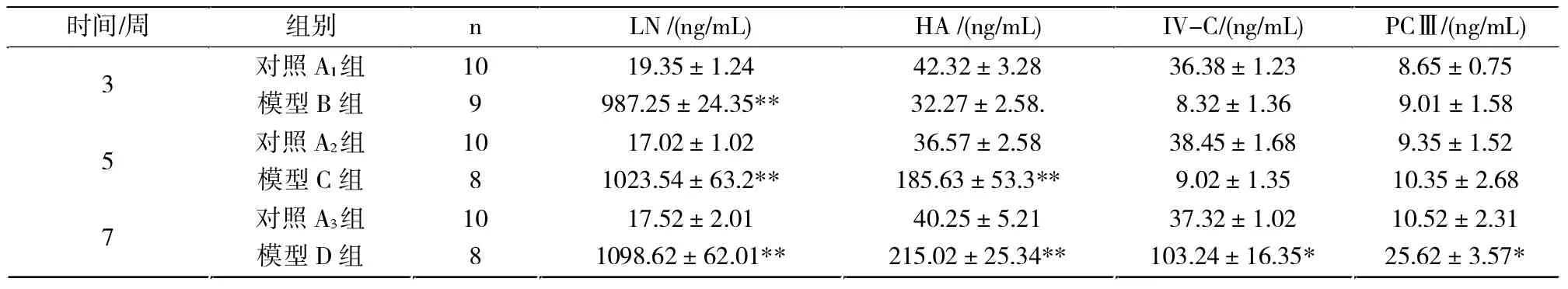
表3 各模型组大鼠血清 LN、HA、IV-C和PCⅢ水平变化 ±STab.3 Changes of levels of LN、HA、IV-C and PCⅢ in varions model rats
注:与对照组比较,*P<0.05,**P<0.01。
2.5 病理检查结果
2.5.1 肝纤维化分级
造模7周期间,大鼠在第3、5、7周末肝纤维化程度分级以及其SSS计分统计分析见表4。结果显示,同对照组相比,模型B、C、D 3组在第5、10、14天的肝纤维化分级SSS计分差异明显(P<0.05)。

表4 大鼠肝纤维化程度分级Tab.4 The stages of hepatic fibrosis in rats
2.5.2 肝组织HE染色检查结果
对照组:均为0级。模型B组:出现在Ⅰ期和Ⅱ期。模型C组:大部分出现在Ⅲ期。模型D组:大部分出现在Ⅳ期(图2)。
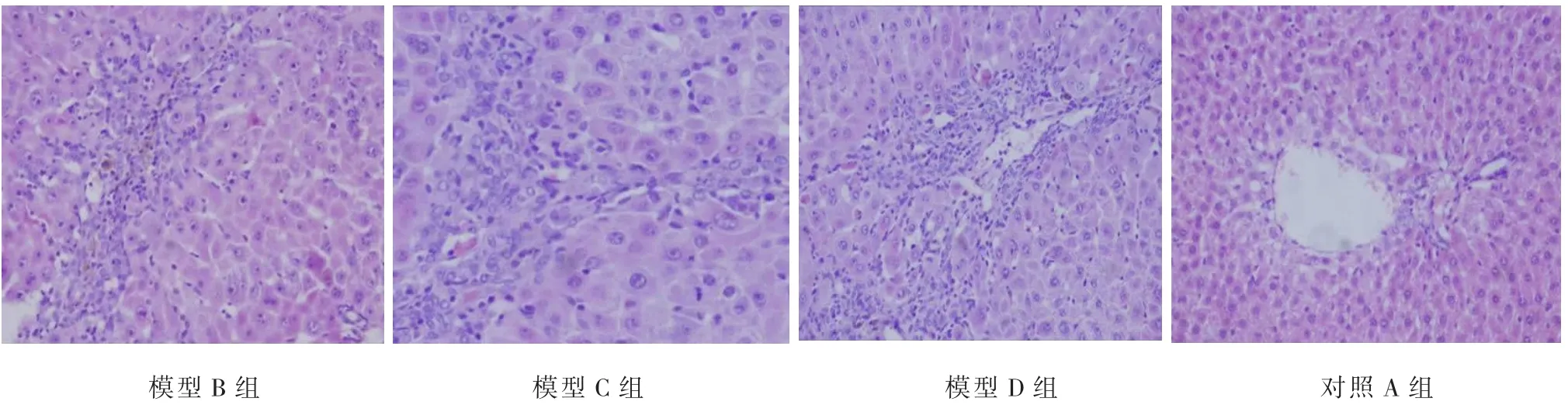
图1 对照组及模型组大鼠肝组织病理切片(HE染色×200)Fig.1 The liver pathological test of normal groupand model group in rats
2.5.3 肾组织HE染色检查结果
B组大鼠肾脏形态结构基本正常;C组与D组大鼠见肾间质炎细胞浸润,部分区域可见上皮细胞空泡变性、脱落(图3)。

图2 对照组及模型组大鼠肾组织病理切片(HE染色×200)Fig.2 The kidney pathological test of normal group and model group inrats
3 讨论
建立一个能完全反映人类肝纤维化的动物模型比较困难,但是可供选择的实验动物模型种类很多,并且各种造模方法各有其特点与不足,可依据不同的实验目的来选择相应的实验动物模型,同时兼顾造模的重复性、可预测性、可比性和费效比[6]。采用硫代乙酰胺诱导的肝纤维化动物模型在血流动力学、形态学及生化代谢的改变均与人肝纤维化最相似[7],与病毒性诱发的肝硬化也很相似[8],硫代乙酰胺可作用在肝细胞DNA、RNA和蛋白合成酶上产生毒性作用,还可诱导肝的代谢紊乱,甚致肝坏死[9]。采用腹腔注射硫代乙酰胺染毒易于控制大鼠硫代乙酰胺的摄入量,组内差异小组间差别易于量化控制,具有较好的重复性和可控性,诱导时间短,只需35~42 d。硫代乙酰胺致肝纤维化模型,大鼠死亡率低,形成的肝纤维化相对稳定,不易被吸收,适用于肝纤维化的基质研究、治疗药物的筛选和肝纤维化血清学标记物的可靠性评价等[10]。
在实验中大鼠在诱导期间一般情况较差,体重减轻较快,诱导结束后,体重缓慢增长。血清检测指标和病理检查结果显示模型B组肝损伤较轻,大鼠处于Ⅰ和Ⅱ期,模型C组的大鼠大部分处于Ⅲ期,这组模型正是实验所需的最佳阶段,模型D组的大鼠大部分处于Ⅳ期,即肝硬化阶段。所以硫代乙酰胺造肝纤维模型的的最佳造模时间是五周,隔天腹腔注射浓度为40 mg/mL,其初始剂量是200 mg/kg,之后根据大鼠的质量变化调整剂量,此为良好的肝纤维模型。本实验结果还显示了肝纤维大鼠的肾脏功能有轻度病变,肾间质炎细胞浸润,部分区域可见上皮细胞空泡变性、脱落,可能该化合物对于肾脏有一定的毒性,其机制有待进一步研究。因此要重视在化学性肝纤维模型的制备中其它脏器的病变,以及人类肝炎发生发展中是否存在其它脏器的病变情况,此对选择与人类肝纤维化病变更接近的模型,改善预后,降低死亡率均具有重要的意义。
[1]叶任高,陆再英.内科学[M].6版.北京:人民卫生出版社,2006:430-436,440-449.
[2]Petera L B,Scot T,Friedman S L,et al.Is liver fibrosis reversible[J].N Engl J Med,2001,344:452-454.
[3]文志萍,秦冬梅,曹文江,等.CCl4皮下注射制备大鼠肝纤维化模型的建立[J].时珍国医国药,2011,22(196)2849-2851. Wen Z P,Qin D M,Cao W J,et al.Eseablishment of Rat liver fibrosis model by subcutaneous lnjection of CCl4[J]. Lishizhen Medicine and Materia Medica Research,2011,22 (196):2849-2851.
[4]中华肝脏学会肝纤维化学组.肝纤维化诊断及疗效评价共识[J].药品评价,2007,4(4):265-266. Hepatic fibrosis study gronp of chinese liver diseases association consensus on eraluation of the dingnosis and efficacy of hepatic fibrosis[J].Evaluation of medicinal products,2007,4(4):265-266.
[5]Waters N J,Waterfield C J,Farrant R D.Metabo-nomic deconvolution convolution of embedded toxicity:application to thioacetamide hepato-and nephrotoxicity[J].Rearch, 2005,18(4):639-654.
[6]Solgaard S,Binger C,Soelund K.Displaced distal radius fractures[J].Arch Orthop Trauma Surg,1989,109:34-38.
[7]Fu Y C,Chien S H,HuangP J,et al.Use ofan external fixation combined with the buttressmaintain pinningmethod in treating comminuted distal radius fractures in osteoporotic patients[J].J Trauma,2006,60(2):330.
[8]秦冬梅,赵文惠,胡利萍,等.胆总管结扎术造大鼠肝纤维化模型的研究[J].时珍国医国药,2012,23(4):803-805 Qin D M,Zhao W H,Hu L P,et al.Model establishment of liver fibrosis by the ligation of common Bile duct in rats [J].Lishizhen Medicine and Materia Medica Research,2012, 23(4):803-805
[9]秦冬梅,文志萍,王新春,等.维药毛菊苣萃取物对肝纤维化大鼠的保护作用[J].中国医院药学杂志,2013,33(18): 1480-1483. Qin D M,Wen Z P,Wang X C,et al.Protective effects of cichorium glandulosum boiss extracts on liver fibrosis in rats[J].Chin hosp pharm J,2013,33(18):1480-1483
[10]Hong Qiang Feng,Nate D,Weymouth D R.End othelin antagonism in portal hypertensive mice:implications for endothelin receptor-specific signaling liver disease[J].Am J Physiol Gastrointest Liver Physiol,2009,297:27-33.
Establishment of rat hepatic fibrosis model with kidney disease induced by thioacetamide intraperitoneal injection
Qin Dongmei1*,Li Jing2,Chen Wen1,Wang Xinchun2
(1 College of Pharmacy,Shihezi University,Shihezi,Xinjiang 832002,China; 2 The First Hospital of Shihezi University,Shihezi,Xinjiang 832002,China)
To lay the foundation of a rat hepatic fibrosis model under the induction of thioacetamide (TAA),and to analyze hepatic pathologic classification and serum test index of rat.The renal pathological changes also examined.60 Wistar rats were chosen and randomly divided into control group,model group B,model group C and model group D.According to the rats weight,intraperitoneal injection of thioacetamide every 2d to induce liver fibrosis.Compared with control group,model group, serum ALT,AST levels were elevated(P<0.01).The activity of T-SOD decreased significantly.The activity of GSH-PX decreased significantly.The content of MDA increased significantly (P<0.01).Model C HA significant difference compared with control(P< 0.01),model group D CIV,PCⅢ significant difference compared with the control(P<0.05).LN Model B group compared with the control group were significantly different (P<0.01).The liver pathology organization prompts the model group big mouse liver cell massive necroses,false small leaf formation,Renal tissue with a mild lesions.Thioacetamide can induce the formation of liver fibrosis in rats,and can lead to renal pathological changes.
thioacetamide(TAA);hepatic fibrosis;intraperitoneal injection
R743.6
A
10.13880/j.cnki.65-1174/n.2017.01.021
1007-7383(2017)01-0124-05
2016-10-25
国家自然科学基金项目(81560680),石河子大学“应用基础研究青年项目”(2014ZRKXYQ19)
秦冬梅(1976-),女,副教授,从事天然药物及制剂研究,e-mail:dongmeiqinli@163.com。

