常规临床检验项目如何选择不同分析性能规范模型*
张诗诗,王薇,赵海建,王治国
(1.北京医院 国家老年医学中心,卫生部临床检验中心/北京市临床检验工程技术研究中心,北京 100730;2.北京协和医学院研究生院,北京 100730)
·专家论坛·
常规临床检验项目如何选择不同分析性能规范模型*
张诗诗1,2,王薇2,赵海建2,王治国1,2
(1.北京医院 国家老年医学中心,卫生部临床检验中心/北京市临床检验工程技术研究中心,北京 100730;2.北京协和医学院研究生院,北京 100730)
2014年,欧洲临床化学和检验医学联合会(EFLM)等机构在米兰联合召开了一次关于设定分析性能规范(analytical performance specifications)的战略性会议。该会成立了一个任务完成小组,专门负责根据不同分析性能规范设定模型的准则,为常规临床检验项目选择合理的模型并设定合理的分析性能规范。模型1,基于分析性能对临床结果的影响设定分析性能规范。选择该模型的被测量应在特殊疾病的诊断和/或监测以及医疗决策的制定中起关键且明确的作用,其相应测量结果所建立的切值/决定限在疾病的诊断、筛查或监测过程中也起核心作用。模型2,基于被测量的生物学变异组分来设定分析性能规范。选择该模型的被测量应在特殊疾病的诊断和/或监测,以及临床表现中不起关键作用,且被测量的浓度处于稳定状态。模型3,基于测量的当前技术水平来设定分析性能规范。选择该模型的被测量应该是无法使用前2种模型以及需要进一步研究临床结果或生物学变异数据的被测量。该文介绍常规临床检验项目如何选择不同分析性能规范模型。
分析性能规范;生物学变异;当前技术水平
2014年欧洲临床化学和检验医学联合会(The European Federation of Clinical Chemistry and Laboratory Medicine,EFLM)等机构[1]在意大利米兰召开了关于“在斯德哥尔摩会议15年之后规定分析性能规范”的第1次战略性会议。该会议将1999年“斯德哥尔摩等级结构”调整并简化成3种模型用于设定分析性能规范(analytical performance specifications):模型1,基于分析性能对临床结果的影响;模型2,基于被测量的生物学变异(biological variation)组分;模型3,基于测量的当前技术水平[2]。同时,EFLM成立了专门的任务完成小组,负责根据米兰会议共识声明中所规定的各种模型的准则以及不同检验项目的具体情况,为常规临床检验项目选择恰当的分析性能规范设定模型[1-3]。
1 选择模型的基本流程
设定分析性能规范的3种模型各具优缺点。在为常规临床检验项目选择分析性能规范设定模型时,必须清楚地说明选择依据[3]。对于同一检验项目,用不同模型设定分析性能规范有差异。例如,糖化血红蛋白(HbA1c)基于生物学变异数据导出的适当水平允许总误差是±3%,但我国室间质量评价(EQA)标准则基于我国实验室检测的当前技术水平将允许总误差设定为±10%。因此,对于运用何种模型,应以患者需求为基础并提供清晰明确且科学合理的依据。在选择模型的过程(图1)中,模型1和2是优先选择的方法。然而,模型1作为设定分析性能规范的“金标准”,是极难实现的一种方法;模型2作为临床实验室普遍认可和接受的方法,也依然无法适用于所有检验项目。因此,对于无法使用前两种优选模型的检验项目以及需要进一步研究临床结果或生物学变异数据的检验项目,可以暂时使用模型3来设定分析性能规范。
2 选择模型1的准则及检验项目
模型1的显著优点在于其可以通过研究分析性能对临床结果的影响,导出直接与临床结果相关的分析性能规范。研究一般分为2类[5]:(1)直接结果研究,适用于检测结果、医疗决策与临床结果间有明确定义关系的检验项目。研究方法通常是诊断性随机对照试验(randomized controlled trials,RCTs),要求大量的样本数据,并且根据检测结果制定的医疗决策,其完整的临床结果需要通过持续较长的随访时间来获得,时间成本大。(2)间接结果研究,是基于试验的分析性能对临床分类或医疗决策以及患者结局概率的影响设定分析性能规范。研究方法包括联系证据法、模拟或决策分析模型(相比于诊断性RCTs,此方法更快、更易且成本更低)。一般用于比较新检测方法和现有检测方法的分析性能差异并推断临床结果的差异。适用检验项目满足以下条件:(1)与检测结果相关的临床决策具有明确的定义;(2)可以利用与检测的诊断准确度相关的证据进行临床(患者)分类并制定不同的医疗决策;(3)对于正确或错误的检测结果分类,已经建立了相应的临床结果。由于直接结果研究极具挑战性,因此间接结果研究更为可行[5]。
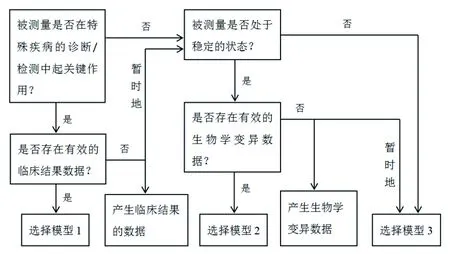
图1 常规临床检验项目选择分析性能规范设定模型的基本流程[4]
然而,模型1也存在明显的缺点,即易受当前检测质量的影响,临床结果可能会因实际应用的试验方法、研究人群和医疗环境的差异而有所不同[2]。因此,在使用模型1设定的分析性能规范之前,需要评估其有效性。原则上,该模型设定的分析性能规范,其对应的被测量应该在特殊疾病的诊断和/或监测以及医疗决策的制定中起关键且明确的作用;被测量的测量结果不仅可用于建立公认的切值或决定限,还可直接影响患者的管理及其临床结果。选择模型1来设定分析性能规范的常规临床检验项目有多种:(1)总胆固醇、高(低)密度脂蛋白胆固醇等。这些与血脂含量相关的检验项目目前已有明确规定的决定限和相关的治疗指征,对心血管疾病的风险定义至关重要,提高检测过程的分析质量可有效降低心血管疾病风险定义的错误分类[6-7]。(2)肌钙蛋白。该项目是诊断急性冠脉综合征(acute coronary syndrome, ACS)特异的生物化学标志物。假设检测方法无偏移,在肌钙蛋白的决定限,当分析不精密度(CVA)为16%时,医生的误诊率为1.8%~3.6%;当CVA<10%时,误诊率<1%;当CVA<6%时,误诊率仅为0.5%[8]。数据说明了分析不精密度对误诊率(临床结果)的影响,若能研究并确定临床可接受的误诊率,即可反过来设定重复测量中可接受的允许不精密度。若检测方法存在正偏移,则部分真阴性的检测结果会被判断为阳性;若检测方法存在负偏移,则部分真阳性的检测结果会被判断为阴性;对于错误划分的检测结果(假阳性和假阴性结果),若能通过研究确定其可接受的百分比,即可反过来设定检测方法的允许偏移[9]。类似地,对于不同允许总误差下的肌钙蛋白检测结果,若能研究并确定其产生的临床结果(死亡率、再入院率等)的可接受程度,也可反过来设定允许总误差。(3)清蛋白。该指标在血液、泌尿、消化系统等多种疾病的诊断和治疗监测中是一个重要的生物化学标志物。在血液系统疾病的诊断中,国际骨髓瘤工作小组推荐,血浆清蛋白浓度>35 g/L联合血浆β2微球蛋白<3.5 g/L,可用于第一期多发性骨髓瘤的分类[10]。在对肾脏透析患者治疗监测时,血浆清蛋白浓度达到并维持在40 g/L以上可认为患者达到治疗目标并有较好的蛋白质能量营养状态;相反,若在慢性透析开始或维持透析治疗过程中,血浆清蛋白浓度低于40 g/L,则预示有高度的死亡风险[11-12]。在消化系统疾病中,肝硬化并伴有自发性细菌性腹膜炎或伴有难治性腹水并使用利尿剂治疗的患者,或伴有肠下垂或经历大型外科手术的患者,一般血浆清蛋白浓度<25 g/L代表需要输注清蛋白。在使用人体清蛋白替代治疗时,建议使用血浆清蛋白的测量结果来计算其输注剂量并用于治疗监测。(4)血红蛋白。血红蛋白浓度水平是临床诊断贫血或相关疾病,以及判断有无输血指征的重要依据。目前,国际上对于贫血的诊断切值规定为男性130 g/L、非妊娠女性120 g/L、儿童110 g/L[13];输血的决定限为70~80 g/L,但若患者血红蛋白浓度处于稳定状态则无需输血[14-15];血红蛋白增多症的决定限为男性180 g/L、女性160 g/L。(5)血小板。其浓度对于判断是否输注血小板有重要意义。对于临床表现稳定的患者,当血小板<10×109/L时表明需要输注血小板;对于临床表现不稳定的患者,需要输注血小板的切值是20×109/L;对于小型外科手术治疗的患者,需要输注血小板的切值是50×109/L,而对于大型外科手术治疗的患者切值则为100×109/L[16]。(6)葡萄糖和糖化血红蛋白(HbA1c)。二者对于糖尿病的诊断和治疗监测有重要意义,且目前已有明确规定的决定限。其中,血糖监测可采用其他模型来设定相应的分析性能规范。(7)促甲状腺激素(TSH)。TSH是诊断和治疗监测甲状腺功能减低症和甲状腺功能亢进症的重要生物标志物。欧洲的一部临床实践指南中[17],规定轻度甲状腺功能减低症的TSH浓度4.0~10.0 mIU/L,重度甲状腺功能减低症TSH浓度>10.0 mIU/L;并推荐用甲状腺素替代治疗,且成年患者TSH治疗限是0.4~2.5 mIU/L,老年患者TSH治疗限是1.0~5.0 mIU/L。此外,欧洲的另一部指南则对甲状腺功能亢进症进行了规定[18],将该疾病分为2个等级:等级1的TSH浓度0.10~0.39 mIU/L,等级2的TSH浓度<0.1 mIU/L;并建议对于65岁以上患有任意一种等级甲状腺功能亢进症的患者均需治疗,但对于较年轻的患者仅需治疗患有等级2甲状腺功能亢进症者。然而,不同国家/地区的临床实践指南中对这2种疾病TSH浓度的规定有差异[19-20]。此外,对于以上规定,目前仍没有临床试验评估TSH检测的分析性能对其应用的影响。(8)其他。如C反应蛋白的浓度可用于区分病毒和细菌感染或用于判定急性胰腺炎的严重程度;中性粒细胞的浓度严重降低时(≤0.5×109/L,中性粒细胞减少症的范围),预示严重感染的高度风险。
3 选择模型2的准则及检验项目
模型2(也称生物学变异模型)的显著优点是其适用于已经基于人群或特定个体建立生物学变异数据的大部分检验项目。生物学变异分为个体内生物学变异(CVI)和个体间生物学变异(CVG),二者是设定允许不精密度、允许偏移和允许总误差的相关变异组分,在使用模型2设定分析性能规范的过程中非常重要[9]。以肌酐为例,其CVI为5.95%、CVG为14.7%[21],结合表1中的公式可得到基于生物学变异导出的各水平允许不精密度、允许偏移和允许总误差(见表2)。

表1 基于生物学变异导出各水平分析性能规范的计算公式[9]

表2 肌酐基于生物学变异导出的各水平分析性能规范
因为获得生物学变异数据的方法科学合理[22-23],所以使用该模型设定的分析性能规范也具有客观依据。然而,值得注意的是,有研究表明当CVI>33.3%时,个体差异的数据呈非高斯分布,该情况下不再适合用模型2来设定分析性能规范[2,24]。目前,www.westgard.com网站上所提供的生物学变异数据库由西班牙临床化学和分子病理学学会的Ricos教授及其团队成员在多年前共同研究编制[21],此数据库中有一些检验项目的生物学变异数据呈现了上述特征,因此这些检验项目应暂时选择模型3并探索更好的生物学变异数据研究方法或数学方法来导出更合适的生物学变异数据[25]。由EFLM成立的任务完成小组也正在对Ricos团队提出的生物学变异数据库进行修订。
使用模型2时,需要尽可能地将分析变异(相对于生物学变异)最小化。虽然该模型设定的分析性能规范与临床结果没有直接关联,但尽量降低分析噪音与生物学信号固有变异的比值将使结果的临床解释变得容易。原则上,该模型适用于特殊疾病诊断和/或监测,以及临床表现中不起关键作用的检验项目。但被测量稳定与否、被测量的浓度、检测的时间间隔以及潜在疾病等均会影响生物学变异数据的相关性和有效性。因此,对于选择该模型的检验项目有一个重要要求,即相应被测量的浓度需要处于一个稳定状态。关于“稳定”,可以分为2种不同的情况:第一,在血清/血浆中,被测量需要维持在一定的浓度水平,否则机体会患病并表现出症状(例如,被测量处于严格的稳态控制下);第二,被测量实际上具有稳定的浓度,但偏离该浓度本身不会引起症状。据此,在实验室中,适于选择该模型的检验项目(见表3)包括:(1)电解质和矿物质,例如钠离子、钾离子、钙离子、无机磷酸盐等,其血浆中的浓度受到激素(例如醛固酮、甲状旁腺素等)和其他病理生理机制(例如肾损伤)的严格调控;(2)肌酐、尿素和半胱氨酸蛋白酶抑制剂C,其血浆中的浓度均受到肾脏功能的精细调控;(3)尿酸,肾功能可代偿其内源性生成和饮食补充间的差异;(4)总蛋白,大部分典型的蛋白质在血浆中有相对较长的半衰期,可受到激素的精细调控而保持浓度稳定;(5)血液成分(红细胞计数、红细胞压积、平均红细胞体积);(6)血红蛋白(用于治疗监测);(7)具有明确临床应用的基本凝血试验,例如凝血酶原时间用于监测双香豆素治疗,活化部分凝血活酶时间用于监测肝素治疗。
其中,钾离子、钙离子、肌酐、红细胞计数、红细胞压积、PT、APTT等指标虽然也在医疗决策的制定中起关键且明确的作用,但它们仍选择模型2设定分析性能规范。主要原因是:(1)这些指标具有生物学变异数据,且浓度或值通常处于稳定状态;(2)根据模型1设定分析性能规范的原理,主要是通过“检测-管理(医疗决策,指治疗及进一步检测)-结果(临床结果,指死亡率、再入院率、生活质量等)”路径来获得分析性能的变化对临床结果的影响[5]。虽然这些检验项目的结果对于医疗决策的制定起关键明确的作用,但对临床结果的影响还需进一步明确。显然,需要严格按图1流程选择合适的模型。

表3 选择各种分析性能规范设定模型的常规临床检验项目
注:该表仅列出临床实验室中的部分检验项目;a,代表样本类型。
4 选择模型3的准则及检验项目
在实验室实际工作中,对于不适于使用模型1或2的检验项目,以及需要进行临床结果或生物学变异数据研究以使用对应分析性能规范设定模型的检验项目,可暂时使用模型3来设定分析性能规范。其中,在“当前技术水平”下的测量性能通常代表临床实验室常规检测方法在技术上可以实现的分析性能的最高水平,但这与临床需求之间并没有直接的关系。显然,该模型并非设定分析性能规范的首选方法。截止目前,针对如何使用该模型来设定分析性能规范依然尚未达成官方共识,仅Haeckel等提出的一些经验性方法或通过EQA计划来设定分析性能规范[2,26]。在临床检验中,适于选择该模型的检验项目主要是尿液中的多种被测量,例如钠离子、钾离子、肌酐、尿素等(见表3)。
5 总结
文中根据EFLM第1次战略性会议共识声明中3种不同分析性能规范设定模型的特点[2],为临床实验室常规检验项目如何选择具体模型提出了初步建议,并列出了适于各种模型的部分常规临床检验项目。基于常规检验项目的特点确定具体的分析性能规范设定模型,有助于临床实验室运用合理的模型设定实用有效的分析性能规范,确保其分析性能水平能够满足要求并不断提高,力求为临床提供更准确的检测结果。对于设定具体模型的检验项目,临床实验室不能盲目地运用该模型设定的分析性能规范作为质量要求。相反,临床实验室应判断其实际的分析性能水平是否符合具体模型所设定的分析性能规范的要求。若符合,则可使用此分析性能规范;若不符合,则实验室可能需要使用较低等级的模型设定较宽松的分析性能规范。
对于文中未列出的大部分常规临床检验项目,也应根据3种模型的选择原则来选择模型并设定符合实验室分析质量水平的分析性能规范。此外,使用文中所描述的选择原则来为检验项目选取合理模型的同时,还需考虑另一问题,即不同实验室检测同一检验项目的分析质量水平有差异。因此,若其他模型能参照生物学变异模型为检验项目设定不同质量水平(最低、适当和最佳)的分析性能规范,则实验室可以根据实际的分析质量水平设定更合适的分析性能规范。实验室可在达到并使用最低水平分析性能规范时,不断提高分析质量,进一步达到适当或最佳水平分析性能规范的要求。另外,对于暂时使用模型3来设定分析性能规范的检验项目,仍需进行基于临床结果或生物学变异数据的研究。
[1]Panteghini M, Sandberg S. Defining analytical performance specifications 15 years after the Stockholm conference[J]. Clin Chem Lab Med, 2015, 53(6): 829-832.
[2]张诗诗,王薇,赵海建,等. 临床检验定量测定项目性能规范制定新进展[J]. 临床检验杂志, 2016, 34(3): 208-210.
[3]Sandberg S, Fraser CG, Horvath AR,etal. Defining analytical performance specifications: Consensus Statement from the 1st Strategic Conference of the European Federation of Clinical Chemistry and Laboratory Medicine[J]. Clin Chem Lab Med, 2015, 53(6): 833-835.
[4]Ceriotti F, Fernandez-Calle P, Klee GG,etal. Criteria for assigning laboratory measurands to models for analytical performance specifications defined in the 1st EFLM Strategic Conference[J]. Clin Chem Lab Med, 2017,55(2):189-194.
[5]Horvath AR, Bossuyt PM, Sandberg S,etal. Setting analytical performance specifications based on outcome studies - is it possible?[J]. Clin Chem Lab Med, 2015, 53(6): 841-848.
[6]Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on detection, evaluation and treatment of high blood cholesterol in Adults (Adult Treatment Panel III)[J]. J Am Med Assoc, 2001, 285(19): 2486-2497.
[7]Langlois MR, Descamps OS, van der Laarse A,etal. Clinical impact of direct HDLc and LDLc method bias in hypertriglyceridemia. A simulation study of the EAS-EFLM Collaborative Project Group[J]. Atherosclerosis, 2014, 233(1): 83-90.
[8]Sheehan P, Biennerhassett J, Vasikaran SD. Decision limit for troponin I and assay performance[J]. Ann Clin Biochem, 2002, 39(3): 231-236.
[9]王治国. 临床检验生物学变异与参考区间[M]. 北京:人民卫生出版社, 2012: 16-44.
[10]Grelpp PR, San Miguel J, Durie BG,etal. International staging system for multiple myeloma[J]. J Clin Oncol, 2005, 23(15): 3412-3420.
[11]National Kidney Foundation. KDOQI Clinical Practice Guideline for hemodialysis adequacy: 2015 update[J]. Am J Kidney Dis, 2015, 66(5): 884-930.
[12]Davison AM. European best practice guidelines for haemodialysis[J]. Nephrol Dial Transplant, 2002,17(Suppl 7): 1-111.
[13]World Health Organization. Worldwide prevalence of anaemia 1993-2005: WHO global database on anaemia[R]. Geneva, Switzerland: World Health Organization, 2008.
[14]Vincent JL, Baron JF, Reinhart K,etal. Anemia and blood transfusions in critically ill patients[J]. J Am Med Assoc, 2002, 288(12): 1499-1507.
[15]Carson JL, Grossman BJ, Kleinman S,etal. Red blood cell transfusion: a clinical practice guideline from the AABB[J]. Ann Intern Med, 2012, 157(1): 49-58.
[16]Kaufman RM, Djulbegovic B, Gernsheimer T,etal. Platelet transfusion: a clinical practice guideline from the AABB[J]. Ann Intern Med, 2015, 162(3): 205-213.
[17]Pearce SH, Brabant G, Duntas LH,etal. 2013 ETA guideline: management of subclinical hypothyroidism[J]. Eur Thyroid J, 2013, 2(4): 215-228.
[18]Biondi B, Bartalena L, Cooper DS,etal. The 2015 European Thyroid Association guidelines on diagnosis and treatment of endogenous subclinical hyperthyroidism[J]. Eur Thyroid J, 2015, 4(3): 149-163.
[19]Jonklaas J, Bianco AC, Bauer AJ,etal. Guidelines for the treatment of hypothyroidism: prepared by the American Thyroid Association Task Force on Thyroid Hormone Replacement[J]. Thyroid, 2014, 24(12): 1670-1751.
[20]Bahn RS, Burch HB, Cooper DS,etal. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists[J]. Endocr Pract, 2011, 17(3): 456-520.
[21]Desirable specifications for Total Error, Imprecision, and Bias, derived from intra- and inter-individual biological variation[EB/OL].(2016-08-15)[2016-10-20].http://www.westgard.com/biodatabase1.htm.
[22]Carobene A. Reliability of biological variation data available in an online database: need for improvement[J]. Clin Chem Lab Med, 2015, 53(6): 871-877.
[23]Bartlett WA, Braga F, Carobene A,etal. A checklist for critical appraisal of studies of biological variation[J]. Clin Chem Lab Med, 2015, 53(6): 879-885.
[24]Braga F, Panteghini M. Generation of data on within-subject biological variation in laboratory medicine: an update[J]. Crit Rev Clin Lab Sci, 2016, 53(5): 313-325.
[25]Kristoffersen AH, Petersen PH, Sandberg S. A model for calculating the within-subject biological variation and likelihood ratios for analytes with a time-dependent change in concentrations; exemplified with the use of D-dimer in suspected venous thromboembolism in healthy pregnant women[J]. Ann Clin Biochem, 2012, 49(6): 561-569.
[26]Haeckel R, Wosniok W, Streichert T. Optimizing the use of the "state-of-the-art" performance criteria[J]. Clin Chem Lab Med, 2015, 53(6): 887-891.
(本文编辑:王海燕)
10.13602/j.cnki.jcls.2017.02.02
北京市自然科学基金(7143182);北京医院课题(BJ-2015-025)。
张诗诗,1991年生,女,硕士研究生,研究方向为实验室质量管理。
王治国,研究员,E-mail:zgwang@nccl.org.cn。
R446
A
2016-10-20)

