溶血对酮胺氧化酶法测定糖化清蛋白结果的影响与校正*
张世昌,杨璐,李云飞,陈晓婷,石晶,汪琪,张炳峰
(南京医科大学第一附属医院检验学部,南京 210029)
·临床检验技术研究·
溶血对酮胺氧化酶法测定糖化清蛋白结果的影响与校正*
张世昌,杨璐,李云飞,陈晓婷,石晶,汪琪,张炳峰
(南京医科大学第一附属医院检验学部,南京 210029)
目的 评价标本溶血对酮胺氧化酶法测定糖化清蛋白(GA)的影响,并建立有效的校正方法。方法 酮胺氧化酶法测定无溶血血清GA浓度及其对应人工溶血血清GA浓度、溶血指数;分析溶血对GA检测结果的影响及二者的相关性;利用多元回归分析建立纠正公式,用于临床溶血标本的GA测定值的数学纠正。结果 溶血降低酮胺氧化酶法GA测定结果(P<0.01),溶血程度与GA浓度呈负相关(R2=0.943 4);以无溶血血清GA浓度为Y,其对应人工溶血血清GA浓度为Z,溶血吸光度值为X,经多元回归分析,纠正公式为Y=2.468X+Z-0.015 73;溶血标本GA浓度经公式纠正后GA浓度偏移均小于10%。结论 标本溶血可导致酮胺氧化酶法GA检测结果降低,运用纠正公式可有效校正溶血对GA测定的干扰,符合临床要求。
溶血;糖化清蛋白;干扰;校正
糖尿病是一种可引起多系统病变和并发症的内分泌代谢性疾病[1],严格控制血糖水平是治疗糖尿病及预防其各种并发症的有效手段[2-3]。糖化清蛋白(glycated albumin,GA)是葡萄糖与血浆清蛋白发生非酶促糖化反应的产物,能反映近2~3周内的血糖水平,作为糖尿病辅助诊断、治疗和预防监测的重要指标已广泛应用于临床[4-5]。酮胺氧化酶法是目前临床检测GA应用最多的方法,而溶血是临床检验血标本中常出现的一种现象,但溶血对GA浓度检测的影响尚不明确[4-6]。本研究观察溶血对酮胺氧化酶法测定GA浓度的影响,并探讨利用AU5800自动生化分析仪的溶血指数对溶血标本GA值纠正的可能性。
1 材料与方法
1.1 试剂与仪器 酮胺氧化酶法GA试剂盒(Lucica GA-L,批号1503A,含溴甲酚紫法测定清蛋白的配套试剂)及配套标准品(批号1501A)、质控品(批号150810)购自日本旭化成制药株式会社;奥林巴斯AU5800全自动生化分析仪。
1.2 样本收集与处理 收集本院门诊或住院患者无溶血、黄疸、脂血血清和对应患者EDTA-K2抗凝全血。
1.2.1 人工溶血液制备 将EDTA-K2抗凝血2 mL以3 000 r/min离心5 min,收集红细胞,用生理盐水洗涤红细胞3次,将标本于-80 ℃反复冻融3次,加生理盐水至总体积2 mL,以雅培1700血液分析仪检测Hb浓度。根据Hb浓度用生理盐水配成Hb浓度为5、10、20、40、80 g/L的溶血液。
1.2.2 人工溶血标本制备 分别取20 μL上述溶
血液与对应患者血清180 μL混合,制备成Hb浓度为0.5、1.0、2.0、4.0、8.0 g/L的血清标本;将20 μL生理盐水加入180 μL血清中,作为对应患者的无溶血血清。
1.3 项目仪器参数设置与检测
1.3.1 GA浓度 终点法,主波长540 nm,副波长700 nm,样本3.0 μL,试剂1(R1)120 μL,试剂2(R2) 30 μL,反应时间为5 min。
1.3.2 清蛋白浓度 终点法,主波长600 nm,副波长660 nm,样本1.5 μL,R1 110 μL,R2 55 μL,反应时间为5 min。
1.3.3 检测 在AU5800自动生化分析仪上分别检测清蛋白、GA、血清信息指数(LIH)等指标。以LIH检测信息中溶血信息的吸光度(A)值作为标本溶血指数。
1.4 统计学分析 用SPSS 17.0统计软件进行。溶血与对应无溶血标本结果的比较用配对t检验,以P<0.05为差异有统计学意义;相关分析用Pearson相关性分析;纠正公式通过多元回归分析,拟合计算回归曲线。
2 实验与结果
2.1 Hb浓度与A值的关系 以Hb浓度为X,A值为Y,对变量X、Y进行回归分析,决定系数(R2)=0.999 7,A值与溶血标本的Hb浓度呈线性正相关,见图1。AU5800分析仪LIH检测标本溶血指数A值可有效代替标本溶血程度。
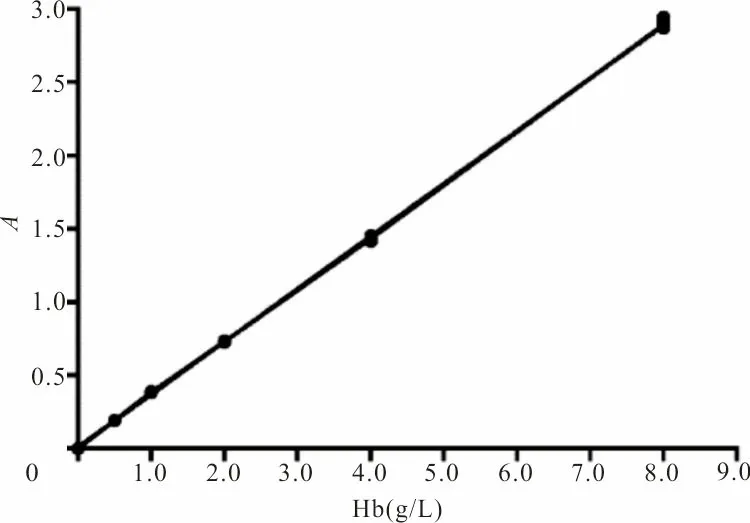
图1 溶血标本Hb浓度与检测A值相关性分析结果
2.2 不同程度溶血对不同浓度GA检测结果的影响 将11份患者血清(GA浓度9.60%~41.47%)分别用溶血液配置成含8、4、2、1、0.5、0 g/L Hb的溶血标本,获得不同溶血程度的标本,分别检测溶血与无溶血标本GA浓度和溶血程度。同一患者标本随溶血程度增加,GA逐渐降低;以无溶血标本GA浓度作为原值,计算溶血标本GA检测结果偏移,GA浓度越低,溶血导致GA检测结果偏移越大;将溶血标本与对应无溶血标本GA浓度进行配对t检验,两者差异有统计学意义(P<0.01),标本溶血对GA检测结果存在严重影响。以代表溶血程度的A值为X,测定GA浓度为Y,对不同患者标本的变量X、Y分别进行回归分析,R2均>0.970,将所有患者标本的变量X、Y进行回归分析,R2=0.943 4,GA浓度与标本溶血A值呈密切负相关。见图2。
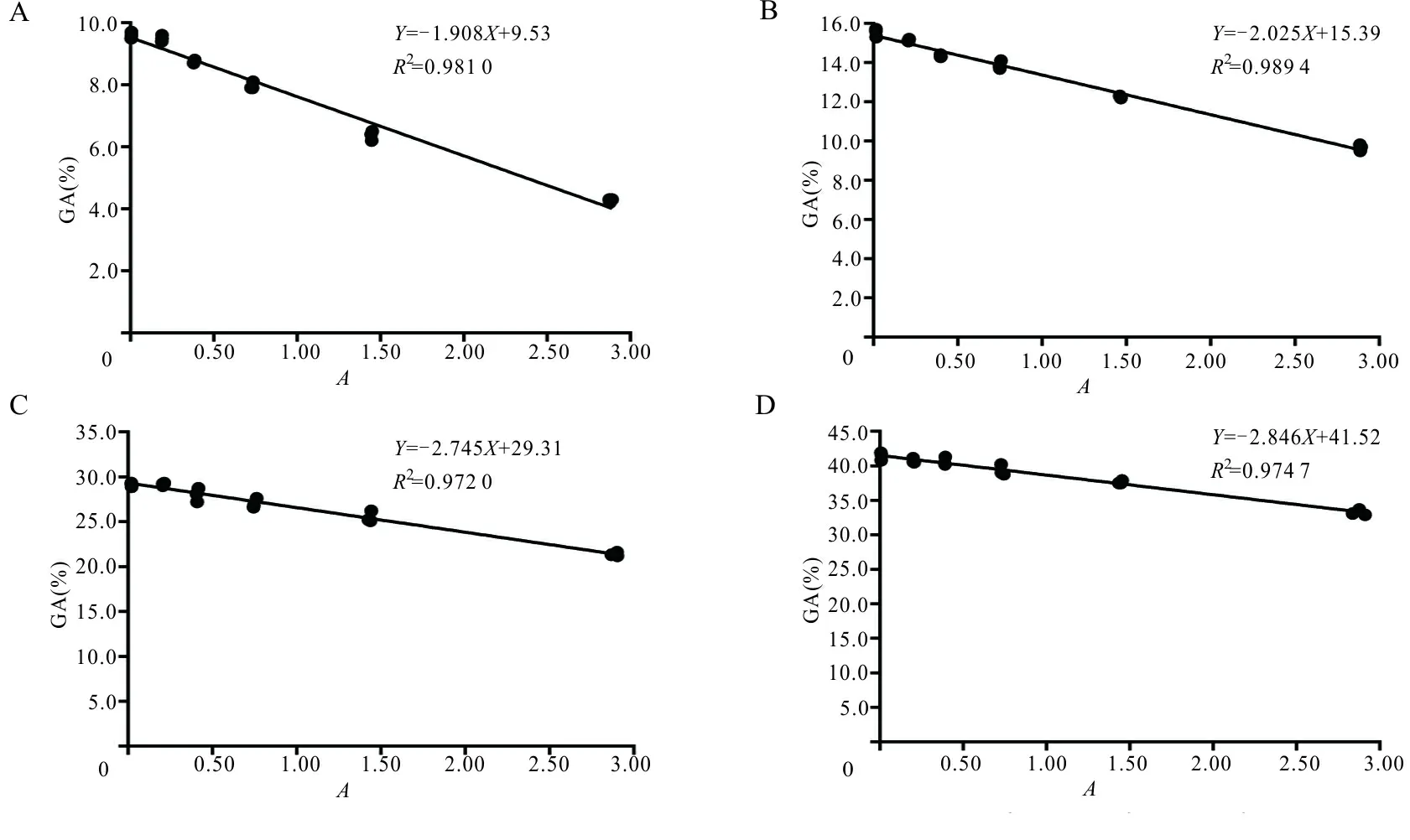
注:A~D,GA初始浓度为9.6%、15.4%、29.3%、41.6%。
图2 不同GA浓度标本溶血对GA检测结果的影响
2.3 回归纠正公式的建立 设溶血时GA值为Z,标本溶血A值为X,无溶血时GA值为Y。对变量Z与因变量X、Y进行回归分析,计算得多元回归式:Y=2.468X+Z-0.015 73。
2.4 临床溶血标本纠正试验 测定6份不同溶血程度的溶血血清GA与溶血A值,运用回归公式Y=2.468X+Z-0.015 73纠正,得GA纠正值,结果见表1。与相应无溶血血清所测得的GA值比较,用美国CLIA′88能力比对检验的分析质量要求,GA测定的可接受范围为10%,以此作为纠正值可接受性的检验。纠正前GA值偏移最高达48.82%,纠正后GA值偏移最高为8.03%,纠正后GA值的偏移平均值为0.61%,远小于纠正前GA值偏移平均值11.79%。见表1。
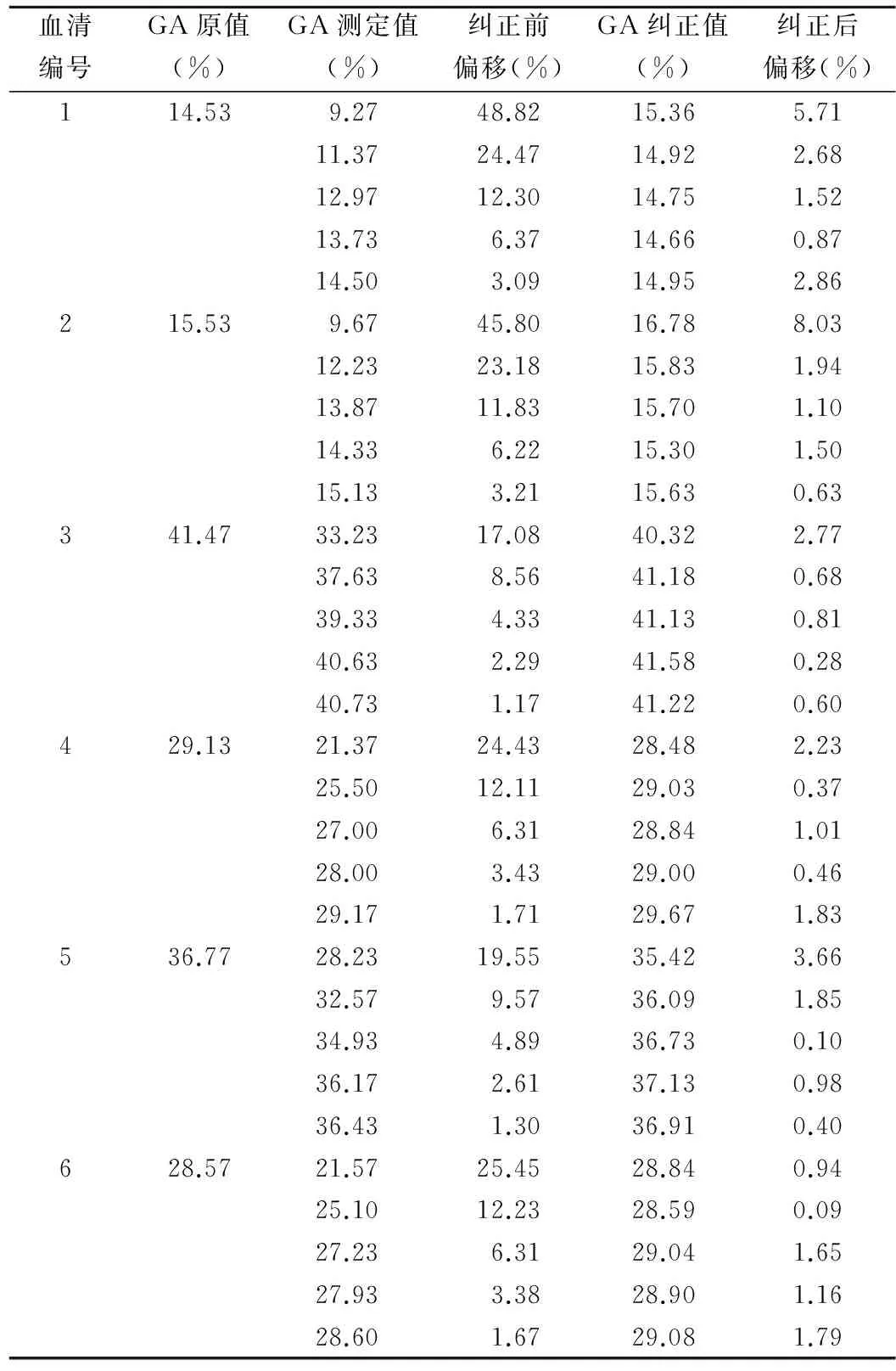
表1 溶血标本GA检测结果纠正前后的变化
3 讨论
血糖水平监测是糖尿病防治的关键。GA是一种可反映血糖近期变化的优良指标,可作为HbA1c临床应用的有效补充,用于糖尿病辅助诊断和治疗监测[4]。溶血是临床检验血标本经常遇到的问题,对多种检验结果有明显的干扰,以往未见研究报道溶血对GA检测结果的影响[7]。本研究结果表明,不同程度溶血均降低酮胺氧化酶法GA测定结果。贾珂珂等[8]研究酮胺氧化酶法测定GA的干扰,结果显示溶血对GA检测结果为负影响,与本研究结果基本一致。
GA是监控短期血糖波动的重要指标,GA检测结果轻微变化可影响对糖尿病辅助诊断、治疗效果和预后的判断[9-10]。本研究发现,溶血对GA浓度影响较大,特别是GA浓度越低,溶血导致GA检测结果偏移越大。在实际工作中轻度溶血往往不容易发现,应采取有效措施纠正或降低溶血对GA检测准确性的影响。运用本研究建立的纠正公式对GA检测结果纠正,能有效纠正溶血对GA检测结果的影响,将纠正前GA浓度平均偏移从11.79%降低到0.61%。美国CLIA′88能力比对检验的分析质量要求,GA测定的可接受范围为10%,本研究纠正后所有结果偏移均小于10%,完全符合临床检验的要求。
溶血干扰临床生化检验结果的机制可能通过以下几方面[11]:(1)血细胞高浓度的组分逸出使血清中分析物的浓度增高;反之,细胞内浓度极低的物质因溶血而对血清稀释;(2)Hb对比色分析的干扰;(3)化学物质的干扰。本研究制备溶血标本时,对照组亦加入同体积的生理盐水,避免了细胞内浓度极低的物质因溶血对血清的稀释作用;AU5800双波长终点法能够避免Hb颜色对比色分析的干扰。因此,溶血产生的化学物质对酮胺氧化酶法的干扰作用是溶血影响GA检测结果的可能机制[12]。我们推测:Hb中Fe2+易在测定过程中被氧化成Fe3+,此过程可能消耗部分酮胺氧化酶产生的H2O2,从而造成溶血标本GA检测结果的降低。但该机制尚需通过下一步实验来验证。
本研究初步明确了溶血对酮胺氧化酶法检测GA结果的干扰作用,并建立可有效纠正溶血标本GA测定结果的纠正公式。但该研究是建立在小样本量研究的基础之上,需进一步扩大样本量对纠正公式进行校正和验证,并研究溶血干扰酶法测定GA结果的可能机制,探讨从方法学上校正溶血的干扰作用。
[1]贺腊姑, 胡敏. 载脂蛋白M调控及其与糖尿病关系的研究进展[J]. 临床检验杂志, 2016, 34(7): 595-598.
[2]Yang W, Lu J, Weng J,etal. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12): 1090-1101.
[3]谭婷婷, 程莉, 魏红霞, 等. HbA1c、尿AAG和血清CysC对早期糖尿病肾病的诊断价值[J]. 临床检验杂志, 2015, 33(11): 827-829.
[4]Vetter SW. Glycated serum albumin and AGE receptors[J]. Adv Clin Chem, 2015, 72: 205-75.
[5]Selvin E, Rawlings AM, Lutsey PL,etal. Fructosamine and glycated albumin and the risk of cardiovascular outcomes and death[J]. Circulation, 2015, 132(4): 269-277.
[6]Dozio E, Gaetano N Di, Findeisen P,etal. Glycated albumin: from biochemistry and laboratory medicine to clinical practice[J]. Endocrine, 2016.[Epub ahead of print]
[7]Agarwal S, Vargas G, Nordstrom C,etal. Effect of interference from hemolysis, icterus and lipemia on routine pediatric clinical chemistry assays[J]. Clin Chim Acta, 2015, 438: 241-245.
[8]贾珂珂, 李国权, 张捷. 酮胺氧化酶法测定糖化清蛋白的评价[J]. 中国实验诊断学, 2010, 14(10): 1620-1623.
[9]李海霞. 糖化清蛋白临床研究进展[J]. 中华检验医学杂志, 2014, 37(12): 887-889.
[10]Montagnana M, Paleari R, Danese E,etal. Evaluation of biological variation of glycated albumin (GA) and fructosamine in healthy subjects[J]. Clin Chim Acta, 2013, 423(8): 1-4.
[11]Farrell CJ, Carter AC. Serum indices: managing assay interference[J]. Ann Clin Biochem, 2016, 53(Pt 5): 527-538.
[12]Kouzuma T, Usami T, Yamakoshi M,etal. An enzymatic method for the measurement of glycated albumin in biological samples[J]. Clin Chim Acta, 2002, 324(1-2): 61-71.
(本文编辑:王海燕)
Interference of hemolysis on glycated albumin determined by ketoamine oxidase method and its correction
ZHANGShi-chang,YANGLu,LIYun-fei,CHENXiao-ting,SHIJing,WANGQi,ZHANGBing-feng
(DepartmentofLaboratoryMedicine,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,Jiangsu,China)
Objective To investigate the effects of hemolysis on glycated albumin (GA) determined by ketoamine oxidase method and its correction. Methods GA concentration and hemolytic parameter(optical density, A) in non-hemolytic serum and different degree hemolytic serum samples were measured. The impact of hemolysis on GA and the relationship between hemolysis and GA were analysed. A formula was developed to correct the interference of hemolysis on GA measurement using regressive Multiple analysis. Results Compared with non-hemolytic serum, hemolysis resulted in the significantly decreased concentrations of GA detected by ketoamine oxidase method(P<0.01), which were significantly associated with the degree of hemolysis (R2=0.943 4).YandZrepresented GA concentration of non-hemolytic serum and different degree hemolytic serum, whileXrepresented optical density of hemolytic parameter. Formulas for GA measurement were presented:Y=2.468X+Z-0.015 73, GA concentrations of hemolytic samples can be reverted to the values without statistical difference from the GA concentration in corresponding non-hemolytic samples. The bias of corrected GA was less than 10%. Conclusion Our results indicate that the level of GA measured through ketoamine oxidase method is negatively affected by hemolysis. The formula of mathematical correction of GA results in hemolytic samples should be suitable for the requirements of clinical laboratory.
hemolysis; glycated albumin; interference; correction
10.13602/j.cnki.jcls.2017.02.03
国家自然科学基金面上项目(81671836)。
张世昌,1975年生,男,副主任技师,博士,主要从事糖尿病与干细胞再生医学研究。
张炳峰,主任技师,副教授,E-mail:bingfengzh2000@163.com。
R446;R587.1
A
2016-12-20)

