敲低RACK1基因抑制C2C12细胞中MyoG和MHC基因表达
张 晶,王胜军,刘 妍,汪文俊,刘玉兰
(1.武汉轻工大学,动物营养与饲料科学湖北省重点实验室,湖北武汉 430023;2.中南民族大学,生命科学学院,湖北武汉 430074)
敲低RACK1基因抑制C2C12细胞中MyoG和MHC基因表达
张 晶1*,王胜军1,2,刘 妍1,2,汪文俊2,刘玉兰
(1.武汉轻工大学,动物营养与饲料科学湖北省重点实验室,湖北武汉 430023;2.中南民族大学,生命科学学院,湖北武汉 430074)
本实验旨在研究RNA干扰(RNAi)RACK1基因对C2C12成肌细胞中肌分化标志基因MHC和MyoG表达的影响。将人工合成的靶向RAKC1基因的3条siRNA(1,2,3)转染C2C12细胞,用RT-qPCR方法检测并筛选干扰效率最高的1条siRNA。将筛选出的siRNA转染C2C12成肌细胞并诱导细胞分化,通过RT-qPCR、Western blot和免疫荧光方法在mRNA及蛋白水平检测RACK1基因沉默后对MHC和MyoG表达的影响。此外,Western blot方法检测RACK1基因沉默后对PI3K/Akt和Erk/MAPK通路激活的影响。结果表明:RACK1-siRNA-2干扰效率最高,转染48 h后抑制率可达70%。随后,C2C12细胞转染siRNA-2,诱导分化48h后RT-qPCR表明,MHC和MyoG的mRNA表达均显著性下调(P<0.05);诱导分化72 h后,Western blot和免疫荧光结果表明MHC和MyoG的蛋白表达明显低于对照组,但AKT和Erk磷酸化水平未见明显变化。上述结果表明,干扰RACK1能显著抑制MHC和MyoG的表达,提示RACK1正向调控C2C12成肌细胞的分化。
成肌细胞;激活性蛋白激酶C受体l;肌细胞生成素;肌球蛋白重链;RNA干扰
RACK1(激活性蛋白激酶C受体l)是含7个色氨酸-天冬氨酸(WD40)重复序列结构的蛋白。它由GNB2Ll基因编码,与G蛋白β亚基显著同源,并在所有真核细胞生物中高度保守[1]。RACK1是一种多功能支架蛋白,介导多条胞内信号转导,调控细胞增殖、凋亡、迁移、转录和蛋白合成等过程[1-3]。RACK1基因敲除小鼠的原肠胚无法正常形成,揭示其在胚胎发育中发挥重要作用[4]。Tang等[5]研究发现,RACK1在通城猪和长白猪胚胎期65 d骨骼肌中显著差异表达,提示其在骨骼肌发育中发挥作用,但具体功能和调控机制仍然未知。
骨骼肌分化是一个复杂的过程,包括成肌细胞增殖、退出细胞周期、迁移、融合以及最后多核肌管的形成[6]。在肌分化的过程中,一系列骨骼肌特异性基因开始表达,肌细胞生成素(myogenin,MyoG)和肌球蛋白重链(Myosin heavy chain,MHC)是其中比较关键的基因。MyoG是骨骼肌分化的决定因子,调控成肌细胞融合和肌纤维形成[7-9]MyoG敲除小鼠因无肌肉形成,在出生前后致死[10]MHC是构成骨骼肌纤维内粗肌丝的主要成分。肌纤维类型主要由肌纤维内表达的MHC类型来决定[11]。
本研究将C2C12成肌细胞作为研究模型,将细胞内源性RACK1用RNAi进行敲低表达,研究RACK1对C2C12细胞分化基因MHC和MyoG表达的影响,从而揭示RACK1基因表达变化对胚胎骨骼肌生长发育的影响。
1 材料与方法
1.1 主要试剂 C2C12细胞(小鼠成肌细胞)由华中农业大学赵书红教授惠赠;胎牛血清、马血清、DMEM高糖培养基、胰酶、TRIzol试剂、liPofecta mine 2 000 Transfection Reagent均购自Invitrogen公司;3条RACK1siRNA由Invitrogen公司设计合成;PrimeScript RT reagent Kit WithgDNA Eraser反转录试盒和SYBR Premix Ex TaqTMRT-PCR试剂盒均购自宝生物工程(大连)有限公司;全蛋白提取试剂盒KGP2100购自南京凯基生物发展有限公司;MyoG抗体、Akt抗体、P-Akt抗体、Erk1/2抗体、P-Erk1/2抗体、β-action抗体、HRP-goat Anti-Mouse IgG均购自Cellsignaling公司;MF-20(MHC抗体)购自DHSB公司。
1.2 主要仪器设备 RT-PCR仪(7500 Real-time PCRsystem,ABI公司);NanodroP2 000超微量分光光度计(Thermo);电泳仪、电泳槽及转膜仪(Bio-Rad);荧光显微镜(Nikon)。
1.3 C2C12成肌细胞培养及诱导分化 C2C12 成肌细胞株常规复苏后,用DMEM高糖培养基(含10%的胎牛血清,1%谷氨酰胺,1%双抗),在体积分数5% CO2,37℃的培养箱中培养。当细胞增殖融合至 70% ~ 80% 时,更换为含2%马血清的DMEM分化培养基进行诱导分化。
1.4 RACK1siRNA转染C12C12细胞 3条RACK 1siRNA序列见表1。用liPofectamine 2 000转染试剂将RACK1siRNA及阴性对照siRNA转染细胞。转染前24 h,将细胞接种到培养板或培养皿中,当细胞达到大概80%左右时进行转染。根据lipofecta mine 2 000的操作说明进行转染,转染5 h后更换新鲜培养基。其中siRNA用量为50 nmoL/L。
1.5 基因mRNA表达测定 细胞总RNA提取、cDNA 合成、Real-time PCR均参照刘妍等[12]的方法。Real-time PCR引物见表2。基因mRNA相对表达量计算采用Livak等[13]的2-ΔΔCt法,以β-actin为内参基因。采用SPSS17.0统计软件进行t检验,以P<0.05表示差异显著性标准,P<0.01表示差异极显著性标准。
1.6 Western blot 本实验参照刘妍等[12]的方法。用凯基全蛋白提取试剂盒提取细胞总蛋白,测定浓度后,进行SDS-PAGE电泳。电泳后,采用BIORAD转膜仪将样品转移至PVDF膜,将膜置于封闭液(5%脱脂乳的PBST)室温封闭3 h,加一抗4℃冰箱过夜。洗膜后将膜孵育在含二抗的PBST溶液中,室温下孵育3 h,用ECl试剂进行荧光显色,于AlPha Innotech成像系统中检测及分析条带强度。
1.7 免疫荧光 4%多聚甲醛固定细胞爬片20 min,DPBS洗3次,每次10 min;用0.2% Triton×-100透化10 min,DPBS洗3次;5% BSA室温封闭30 min,DPBS洗3次;加一抗(用1%BSA按1∶40稀释)放在湿盒里,4℃孵育过夜;弃去一抗,DPBS洗3次,加入FITC标记二抗(用1%BSA按1∶100稀释),湿盒内37℃避光孵育2 h,DPBS洗3次;DAPI避光孵育10 min,荧光显微镜下观察结果。
2 结 果
2.1 RACK1siRNA干扰效率检测及筛选 为了研究RACK1对C2C12细胞分化的影响,设计靶向RACK1基因的3条siRNA序列并转染细胞,实现细胞内源性RACK1的低表达。用脂质体分别将3条RACK1siRNA和Cy3标记的阴性对照转染C2C12细胞,转染5 h后,通过观察阴性对照的红色荧光强度,以确定siRNA的转染效率。转染48 h后,通过RT-qPCR检测RACK1mRNA的表达,筛选出干扰效率最高的1条siRNA。由图1A结果显示,转染5 h后C2C12细胞中出现的红色荧光较强,且转染效率达80%以上。RT-qPCR结果显示,3条siRNA均能显著地抑制细胞内RACK1基因的表达(P<0.05,图1B),其中siRNA-2的干扰效率最高(抑制率约70%),因此选择RACK1siRNA-2进行后续的干扰实验。

表1 3条RACK1siRNAs序列
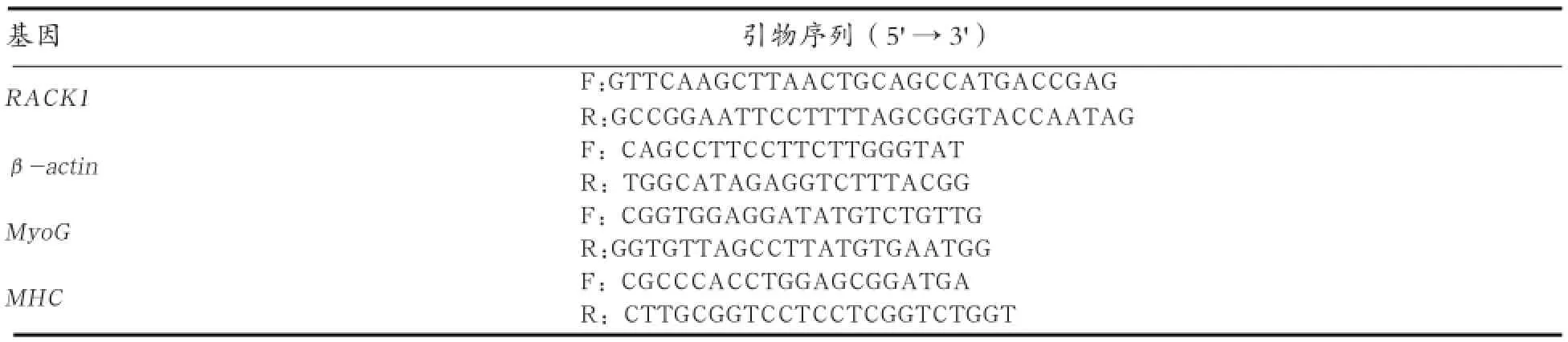
表2 Real-time PCR引物序列

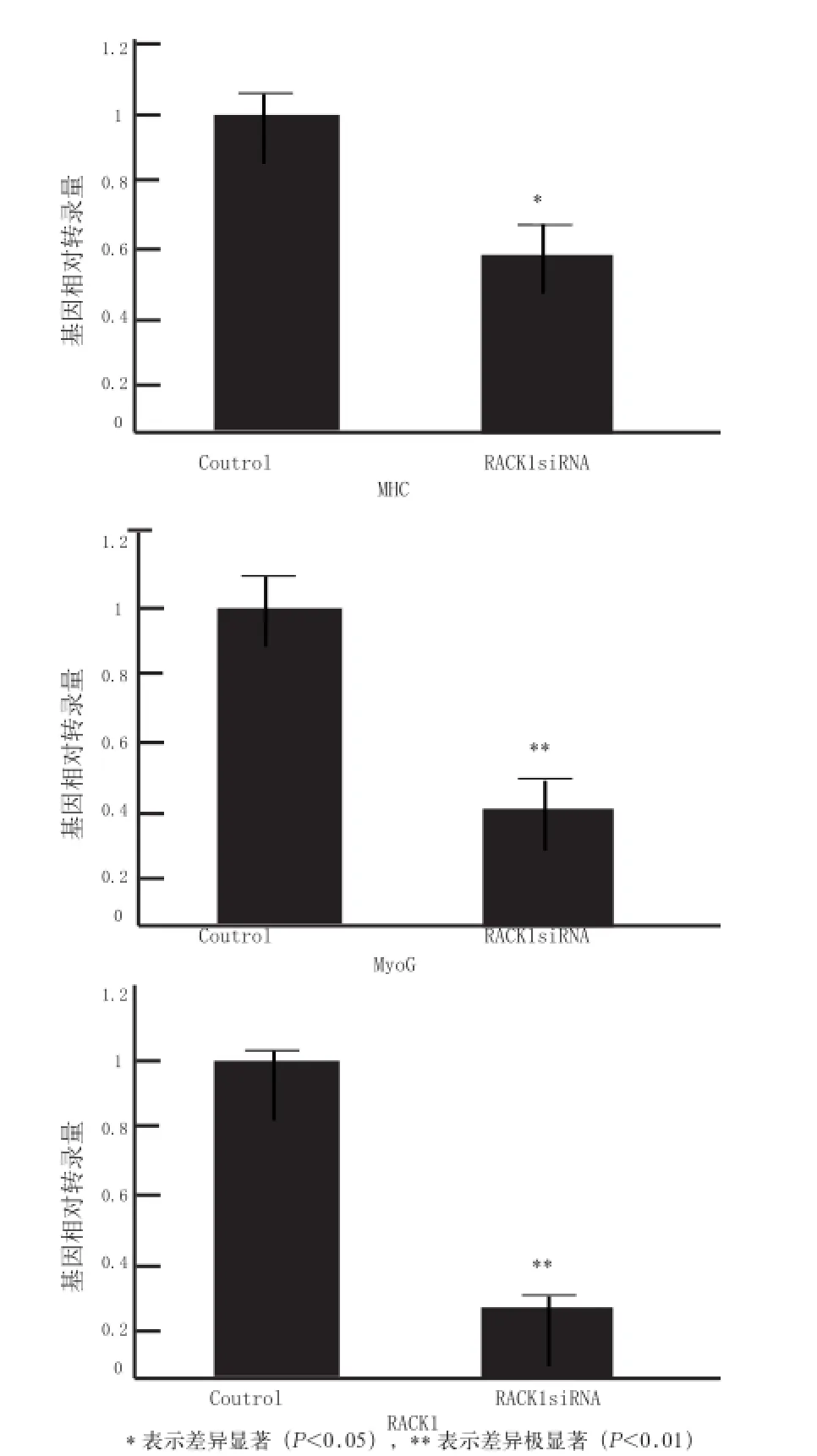
图2 干扰RACK1对MyoG、MHC基因mRNA表达的影响
2.2 干扰RACK1对MyoG和MHC基因mRNA表达的影响 分别将RACK1siRNA-2和阴性对照转染C2C12细胞,转染12 h后,将细胞的生长培养基换成分化培养基。在诱导分化48 h后,采用RT-qPCR检测RACK1、MHC、MyoG的基因转录情况。结果显示,与对照组相比,RACK1siRNA-2组细胞内源性RACK1mRNA的表达显著受到抑制(P<0.01,图2),其抑制率约为70%。此外,在对RACK1基因进行干扰后,分化标志基因MHC和MyoG的mRNA表达均显著性下调(P<0.05,图2)。
2.3 干扰RACK1对MyoG和MHC基因蛋白表达的影响 别将RACK1siRNA-2和阴性对照转染C2C12细胞,转染12 h后,将细胞的生长培养基换成分化培养基。在诱导分化72 h后,采用western blot和免疫荧光检测MHC和MyoG的蛋白表达情况。Western blot结果显示,与对照组相比,RACK1siRNA-2组的MHC和MyoG的蛋白明显下调(图 3A)。免疫荧光结果显示,与对照组相比,RACK1siRNA-2组的MHC阳性细胞明显减少,而MyoG阳性细胞的数目虽无明显增多,但部分细胞的绿色荧光强度明显减弱。这些结果表明,干扰RACK1能有效抑制C2C12分化过程中MHC和MyoG的表达。
2.4 干扰RACK1对Akt和Erk磷酸化水平的影响分别将RACK1siRNA-2和阴性对照转染C2C12细胞,转染12 h后,将细胞的生长培养基换成分化培养基。在诱导分化72 h后,采用western blot检测Akt和Erk磷酸化水平。Western blot结果显示,与对照组相比,RACK1siRNA-2组的Akt和Erk磷酸化水平均无明显差异(图4)。

图 3 干扰RACK1对MHC和MyoG蛋白表达的影响

图 4 干扰RACK1对Akt和Erk磷酸化水平的影响
3 讨 论
哺乳动物骨骼肌生长发育是一个复杂的过程,主要包括骨骼肌成肌细胞增殖、分化和多核肌管的形成。而这一过程是在生肌调节因子(MRFs)的精密调节下有序地进行。MRFs包括Myf5、MyoD、myogenin、Myf6,且这4个成员都具有一个相似的结构特征,即碱性螺旋-环-螺旋 (basic helixloop-helix, bHLH) 结构域。其中MyoG在分化早期被激活,其表达象征成肌细胞的开始。成肌细胞分化后相互融合为多核肌管,最后形成肌纤维。成熟肌纤维主要有肌球蛋白重链(MHC)组成,并且MHC决定肌纤维的类型。在骨骼肌生长发育的过程中,多种肌生成相关基因都发挥着各自的功能,构成一个复杂而精确的正负调控网络。目前已发现大量重要基因参与成肌分化过程,但成肌分化的调控机理尚未完成阐明。
RACK1在组织中广泛表达,但在不同组织和细胞中,由于结合不同信号蛋白,则发挥不同的生物功能。主要参与调控胚胎发育、细胞生长、细胞分化、增殖、凋亡、迁移等多种生物活动等[14-16]。现已发现RACK1所结合的重要信号蛋白与结构蛋白已达到数10种,如PKC、Src、integrinβ、PDE4D5、FAK、STATs、P85、IGF-I等[1-3]。Tang等[5]研究发现,通城猪和长白猪骨骼肌发育的重要时间点为胚胎期65 d,而在此关键时间点RACK1在通城猪中的表达量急剧下调。这暗示RACK1在骨骼肌发育中发挥作用,但具体功能和调控机制仍然未知。
本文研究结果显示,3条siRNA均能显著地抑制细胞内RACK1基因的表达,其中siRNA-2的干扰效率最高。通过基因干扰敲低C2C12细胞中RACK1表达后,成肌标志基因MyoG和MHC的表达在mRNA和蛋白水平均明显受到抑制,表明下调RACK1表达阻止C2C12成肌细胞分化,提示RACK1可能参与正向调控骨骼肌分化过程。
癌症相关研究发现RACK1能结合IGF-1R,影响IGFs下游PI3K/Akt、Erk/MAPK通路的激活调控细胞增殖和凋亡[17-18]。PI3K/Akt途径调控肌肉特异性基因的表达,诱导和维持肌细胞分化[19-20]。Erk1/2 MAPK信号通路促进肌细胞的增殖并抑制分化[21-22]。本研究表明,RACK1干扰组与对照组相比,成肌细胞分化后Akt和Erk1/2的磷酸化水平未见明显差异,推测RACK1可能不是通过影响PI3K/Akt和Erk/MAPK通路激活调控C2C12细胞分化。
4 结 论
综上所述,本研究通过基因干扰敲低C2C12成肌细胞内源性RACK1的表达,从而探究其对C2C12细胞分化的影响。研究结果表明,下调RACK1的表达能显著抑制成肌标志基因MyoG和MHC的表达,表明RACK1可能促进骨骼肌分化过程,但其调控机制可能与PI3K/Akt和Erk/MAPK通路无关。
[1] Adams D R, Dorit R, Kiely P A. RACK1, A multifaceted scaffolding protein: Structure and function[J]. Cell Commun Signal, 2010, 9(1): 1-24.
[2] Serrels B,Sandilands E, Frame M C. Signaling of the direction-sensing FAK/RACK1/PDE4D5 complex to the small GTPase Rap1[J]. Small Gtpases, 2011, 2(1): 54-61.
[3] Li J J, Xie D. RACK1, a versatile hub in cancer[J]. Oncogene, 2014, 34(15): 1890-1898.
[4] Volta V, Beugnet A, Gallo S,et al.RACK1 depletion in a mouse model causes lethality, pigmentation deficits and reduction in protein synthesis efficiency[J]. Cell Mol Life Sci, 2013, 70(8): 1439-1450.
[5] Tang Z, Li Y, Wan P,et al.LongSAGE analysis of skeletal muscle at three prenatal stages in Tongcheng and Landrace pigs[J].Genome Biol, 2007, 8(6): R115.
[6] Cho O H, Mallappa C, Hernández-Hernández J M,etal.Contrasting roles for MyoD in organizing myogenic promoter structures during embryonic skeletal muscle development[J]. Dev Dyn, 2015, 244(1): 43-55.
[7] Buckingham M, Rigby P W. Gene Regulatory Networks and Transcriptional Mechanisms that Control Myogenesis[J]. Dev Cell, 2014, 28(3): 225-238.
[8] Wigmore P M, Evans D J R. Molecular and cellular mechanisms involved in the generation of fi ber diversity during myogenesis[J]. Ⅰnt Rev Cytol, 2002, 216(216): 175-232.
[9] Takagaki Y, Yamagishi H, Matsuoka R. Factors involved in signal transduction during vertebrate myogenesis[J]. Ⅰnt Rev Cell Mol Biol, 2012, 296: 187-272.
[10] Nabeshima Y, Hanaoka K, Hayasaka M,et al.Myogenin gene disruption results in perinatal lethality because of severe muscle defect[J]. Nature, 1993, 364(6437): 532-535.
[11] 郭佳, 余秀锋, 伍婷,等. 金华猪和长白猪背最长肌不同肌纤维类型表达差异[J].中国畜牧杂志, 2012, 48(15): 15-18.
[12] 刘妍, 梁辉煌, 刘玉兰,等. LPS通过AKT/FOXO1信号通路诱导C2C12肌管细胞MuRF1基因转录[J].畜牧兽医学报, 2016,(2): 374-380.
[13] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-408.
[14] Vani K, Yang G, Mohler J. Ⅰsolation and cloning of a Drosophila, homolog to the mammalian RACK1 gene, implicated in PKC-mediated signalling[J]. Biochimi Biophy Acta, 1997, 1358(1): 67-71.
[15] Ashique A M, Kharazia V, Yaka R,et al.Localization of the scaffolding protein RACK1 in the developing and adult mouse brain[J]. Brain Res, 2006, 1069(1): 31-38.
[16] Liang K, Lin Y, Zhang Y,et al.Developmental expression of amphioxus GABA A, receptor-associated protein-like 2 gene[J]. Dev Genes Evol, 2004, 214(214): 339-341.
[17] Kiely P A, Sant A, O'Connor R. RACK1 is an insulin-like growth factor 1 (ⅠGF-1) receptor-interacting protein that can regulate ⅠGF-1-mediated Akt activation and protection from cell death[J]. J Biol Chem, 2002, 277(277): 22581-22589.
[18] Wang F, Osawa T, Tsuchida R,et al.Downregulation of receptor for activated C-kinase 1 (RACK1) suppresses tumor growth by inhibiting tumor cell proliferation and tumor-associated angiogenesis[J].Cancer Sci, 2011,102(11): 2007-2013.
[19] Briata P, Lin W J, Giovarelli M,et al.PⅠ3K/AKT signaling determines a dynamic switch between distinct KSRP functions favoring skeletal myogenesis[J].Cell Death Dif f er, 2012, 19(3): 478-487.
Knock-down ofRACK1Ιnhibits the Expressions of Myog and MHC Genes in C2C12 Myoblast
ZHANG Jing1*,WANG Sheng-jun1,2,Liu Yan1,2, WANG Weng-jun2, LⅠU Yu-lan1
(1. Hubei Key laboratory of Animal Nutrition and Feedscience, Wuhan Polytechnic University, Hubei Wuhan 430023, China; 2. College of lifesciences,South-Central University for Nationalities, Hubei Wuhan 430074, China)
The purpose of the study was to investigate the inf l uence of RACK1genesilencing by RNA interference (RNAi) on the expressions of two myogenic dif f erentiation markgenes (MHC and MyoG) in C2C12 myoblast. We transfected three chemically synthesized RACK1siRNA (siRNA-1,2,3) into C2C12 myoblasts, and detected the interference efficiency with RT-qPCR in order toselect thesiRNA with the highest interference efficiency. Then, we transfected the selected siRNA into C2C12 cells and induced C2C12 dif f erentiation. Ⅰn order to study the ef f ect ofRACK1gene silencing on the expressions of MHC and MyoG, we examined MHC and MyoG mRNA and protein expressions by using RT-qPCR, Western blot and immunof l uorescence methods. Ⅰn addition, the ef f ect of theRACK1silencing on the activation of pⅠ3K/Akt and Erk/MApK pathway was detected by Western blot analysis. The result showed thatRACK1-siRNA-2 had the highest interference efficiency, and its interference efficiency was approximately 70% at 48 h after the transfection. C2C12 myoblasts were transfected with siRNA-2 and induced into differentiation for 48 h and 72 h respectively. RT-qPCR showed that MHC and MyoG mRNA were significantly decreased in siRNA-2 transfected cells after 48 h of differentiation; Western blot and immunof l uorescence showed that MHC and MyoG protein were decreased after 72 h of dif f erentiation. However, no signif i cant changes in phosphorylation levels of Akt and Erk were observed. We conclude that downregulation ofRACK1by RNAi signif i cantly inhibits the expressions of MHC and MyoG, indicating thatRACK1is involved in positive regulation of C2C12 dif f erentiation.
Myoblast;RACK1; Myogenin; Myosin heavy chain; RAN interference
S814.5
A
10.19556/j.0258-7033.2017-03-106
2016-04-12;
2016-05-24
湖北省自然科学资助项目(2015CFB514);湖北省高等学校优秀中青年科技创新团队计划项目(T201508)
张晶(1985-),女,武汉人,博士,讲师,研究方向:骨骼肌发育和肌肉损伤的机制,E-mail:judyzhang1103@163.com
*通讯作者

