载10-羟基喜树碱的叶酸受体靶向相变超声造影剂的制备及一般特性
李友伟,周 薇,周 洋*,叶 鸣,周 鸿
(1.德阳市人民医院肝胆外科,四川 德阳 618000;2.重庆医科大学附属成都第二临床学院,成都市第三人民医院超声科,四川 成都 600031)
·基础与实验研究·
载10-羟基喜树碱的叶酸受体靶向相变超声造影剂的制备及一般特性
李友伟1,周 薇2,周 洋2*,叶 鸣2,周 鸿2
(1.德阳市人民医院肝胆外科,四川 德阳 618000;2.重庆医科大学附属成都第二临床学院,成都市第三人民医院超声科,四川 成都 600031)
目的 制备一种载10-羟基喜树碱(10-HCPT)的叶酸受体靶向相变纳米粒超声造影剂(FR-HCPT-PNPCA),评价其载药及在体外的相变能力、对肿瘤细胞的靶向能力等一般特性。方法 通过双步乳化法制备以脂质为壳膜材料、液态氟碳为内核,且包裹抗癌药物10-HCPT的纳米粒,采用高效液相色谱研究其药物包封率和载药量,在体外通过加热法研究其相变产生微泡的能力,并在肝癌细胞株7721细胞上研究其体外寻靶能力。结果 成功制备出载10-HCPT的靶向相变纳米粒FR-HCPT-PNPCA,其药物包封率为70.42%,载药量为20.05%。当加热至70℃时,显微镜下可以观察到明显的相变并产生微气泡,且大量纳米粒可特异性地黏附于肝癌细胞周围。结论 FR-HCPT-PNPCA载药率高,性质稳定,靶向肿瘤能力强,有望成为一种集肿瘤诊治于一体的多功能超声分子探针,具有良好的应用前景。
10-羟基喜树碱;叶酸;靶向;相变;造影剂
恶性肿瘤严重危害人类健康和生存质量,然而对于多数肿瘤,无论临床诊断技术还是现有的治疗手段,都无法取得非常满意的效果。近年来,随着分子影像学的发展,在分子水平上诊治肿瘤中,分子探针的研发有至关重要的作用[1]。作为分子影像学的重要分支,超声分子影像学同样受制于超声分子探针研制。因此,在超声微泡造影剂的基础上,各种类型的超声分子探针,如纳米分子探针、靶向分子探针、载药分子探针、相变分子探针及多模态分子探针等都得到了不同程度的研发,但却面临一些问题,如制备工艺复杂、靶标不稳定表达、载药量低、不能穿透血管内皮间隙等[2]。本研究基于课题组既往对靶向相变分子探针的研究基础[3],制备一种肿瘤细胞稳定表达、叶酸受体靶向、载10-羟基喜树碱(10-hydroxycamptothecin, 10-HCPT)的纳米粒、且具有相变能力的超声造影剂(FR-HCPT-PNPCA),并评价其特性。
1 材料与方法
1.1主要试剂与设备 成膜材料包括磷脂酰胆碱(DPPC,美国Avanti公司)、偶联叶酸的磷脂酰乙醇胺[DSPE(PEG)Folate,美国Avanti公司]、普通磷脂酰乙醇胺(DSPE,美国Avanti公司)、甘油磷脂(DPPG,美国Avanti公司)、泊洛沙姆(PF68,美国Sigma公司)、胆固醇(CH,美国Sigma公司);内核采用液态氟碳(PFH,法国Elf Atochem公司);药物为10-HCPT(成都兰贝植化科技有限公司)。
主要实验仪器包括C-MAG HS4型磁力搅拌器(德国IKA),RE-52A型旋转蒸发器(上海亚荣生化),I25型高速分散均质机(德国IKN),Vcx-130型超声破碎仪(美国Sonic公司),倒置荧光显微镜(日本 Olympus),激光共聚焦显微镜(日本Olympus),恒温水浴箱(上海一科仪器设备公司),固定温度的显微镜加热板MicroS37(澳大利亚CryoLogic公司)。
1.2 FR-HCPT-PNPCA的制备和一般性质检测 参照以往实验[2-3],将成膜材料和10-HCPT按比例用氯仿和甲醛混合液溶解,经磁力搅拌、真空旋转蒸发成膜、脱气水水合后获得半透明乳液,再以高速分散均质机(15 000 rpm,5 min)分散,同时按PFH与乳液体积比1∶8滴加PFH,最后用细胞破碎仪乳化(80% Power,100 s),获得乳白色的FR-HCPT-PNPCA乳剂。若成膜材料中不采用DSPE(PEG)Folate,即制得普通非靶向相变乳剂HCPT-PNPCA,以脱气水取代PFH制备普通靶向非相变乳剂FR-HCPT-NPCA。在成膜过程中加入少许绿色荧光染料FITC制备含绿色荧光物质的纳米粒乳剂。
将上述制备好的乳液稀释后在光镜下观察其形态及分布,并将样本送至重庆大学生物工程学院检测其粒径、电位及浓度。制备的纳米粒乳液于4℃冰箱内保存备用,用前轻微振荡混匀,保存时间小于4周。
1.3 FR-HCPT-PNPCA药物包封率和载药量的测定 将制备的样品交重庆医科大学药学院,采用高效液相色谱法测定10-HCPT在纳米粒乳液中的含量。基本设置如下:色谱柱(150.0 mm×4.6 mm,5.0 μm),流动相为乙腈∶水=25∶75,流速1 ml/min,λ=266 nm,T=35℃,进样量为10 μl。10-HCPT包封率=Cm/Ct×100%,载药量=Cm/Wt×100%,Cm为FR-HCPT-PNPCA中10-HCPT的含量;Ct为成膜时加入10-HCPT的量;Wt为成膜材料中除去10-HCPT的其他材料的总量。
1.4 FR-HCPT-PNPCA体外寻靶能力 按照常规贴壁细胞培养和传代方法,培养人肝癌7721细胞,取对数生长期的细胞,以每孔1×104的浓度接种于6孔细胞培养板内制备细胞爬片。靶向实验前以无叶酸的细胞培养液置换基础培养液继续培养3 h,加入红色荧光染料DiI对细胞膜染色,按不同分组进行以下操作:在叶酸受体靶向组加入CO60灭菌的稀释FR-HCPT-PNPCA乳液100 μl;在空白对照组加入普通HCPT-PNPCA乳剂100 μl,后在各孔内加入无叶酸的培养液1 ml,送入培养箱内孵育1 h。最后取出培养板,用灭菌PBS液反复冲洗各孔6次,加入1 ml无叶酸的培养液,于激光共聚焦显微镜下观察纳米粒与细胞的结合情况。
1.5 FR-HCPT-PNPCA的体外相变能力 将显微镜加热板置于显微镜载物台上,其中央孔对准物镜中心,将稀释的相变组FR-HCPT-PNPCA乳液及非相变组FR-HCPT-NPCA乳液滴加于载玻片,盖上盖玻片,并将其放于加热板上加热,记录加热时间和加热温度,其间动态调节聚焦观察纳米粒相变产生微气泡的过程。
2 结果
2.1 FR-HCPT-PNPCA的制备与一般性质检测 成功制备出靶向载药的FR-HCPT-PNPCA乳液,外观与非靶向HCPT-PNPCA及靶向非相变FR-HCPT-NPCA乳剂无明显差异,光镜下纳米粒形态呈折光的球形颗粒,分散性好,约8.9×109个/毫升(图1)。激光粒度仪测得其粒径为(525.48±65.73)nm,Zeta电位为(-18.52±2.86)mV。24 h后乳液出现明显分层并沉积于容器底部,但轻摇后即可混匀恢复乳液外观,且光镜下观察纳米粒的形态、大小均无明显变化。
2.2 FR-HCPT-PNPCA药物包封率和载药量的测定 采用高效液相色谱法检测获得10-HCPT样品色谱图和标准曲线,Y=128.63X-29.40,决定系数(R2)=0.996 6,将测得的色谱图中曲线下面积(即Y值)代入标准曲线公式计算获得样品中溶液浓度值(即X值),将X值分别代入包封率和载药量计算公式,获得样品包封率为70.42%,载药量为20.05%。
2.3 FR-HCPT-PNPCA体外寻靶能力 靶向组加入FR-HCPT-PNPCA孵育后,大量的绿色荧光纳米粒与染成红色的肝癌细胞特异性结合,以细胞壁游离面显著;而非靶向组加入HCPT-PNPCA后,则几乎无纳米粒与肝癌细胞黏附结合(图2)。
2.4 FR-HCPT-PNPCA的体外相变能力 光镜下动态录像观察,当温度加热至70℃后,加入相变型的FR-HCPT-PNPCA纳米粒乳液玻片,部分纳米粒体积迅速由小变大并产生微气泡,随着温度升高及时间的延长,微气泡的体积也逐渐增大甚至破裂,且可见更多纳米粒发生相变产生微泡,直至载玻片上的液滴变干。而加入非相变型的FR-HCPT-NPCA玻片上则几乎未见到微泡的产生(图3)。
3 讨论
化疗一直是治疗恶性肿瘤的重要手段,但其存在全身伤害大、用药剂量大的问题。现代医学强调对疾病的精准医疗[4],而针对肿瘤精准医疗的关键之一在于对肿瘤的及早发现,并采取合适的治疗。分子影像学的发展,有可能从分子水平诊断肿瘤,为实现肿瘤的精准医疗提供有力保障。随着超声分子影像学的诞生,利用超声微泡和超声固有的空化作用实现精准药物控释成为当今研究的热点[5-6],但普通载药超声微泡存在一些不足,如粒径大、存留时间短、靶向性能差、性质不稳定、载药能力不高等。
超声分子探针的研发很大程度上决定了超声分子影像学前进的步伐。理想的超声分子需具备以下几个特点:①粒径足够小;目前认为,肿瘤组织血管内皮间隙可达780 nm[7],粒径小于此数值的纳米粒,有可能通过血管内皮间隙到达肿瘤组织间隙;传统的超声微泡,粒径一般在微米级,所以只能作为一种血池显影剂在血管内显影,不能与肿瘤细胞“零距离”接触,达到靶向分子显影和治疗肿瘤的目的。此外,血管内的超声微泡很容易随血液循环被带走或清除,持续时间短;本研究通过简单的双步乳化的工艺成功制备出一种靶向载药的纳米粒FR-HCPT-PNPCA,其粒径约500 nm,可能通过内皮间隙在肿瘤细胞周围聚集;②可增强超声显影;超声造影主要采集微泡在超声作用下共振产生的二次谐波信号,因此,超声微泡的应用使得超声造影技术飞速发展。因此,超声分子探针需粒径在纳米级的气泡,但纳米微泡产生的谐波信号多不尽如人意,加上纳米微泡制作工艺复杂,使超声分子探针的研究面临瓶颈;为此,有学者[2,8]采用纳米液滴相变的方法解决粒径(纳泡)和显影(微泡)的矛盾;采用生物相容性好的液态氟碳为核心,以脂质、硅壳、白蛋白或高分子材料为壳膜材料等制备纳米粒,经注射后可通过血管内皮间隙,且此纳米粒在一定频率、峰值负压的超声作用下,可在原位相变产生微泡,达到增强超声显影的目的。本实验中采用的PFH[2],其沸点约56℃,介于全氟戊烷(PFP,29℃)和全氟辛溴烷(PFOB,146℃)之间,制备的纳米粒在加热到70℃后,可发生明显的相变并产生微泡,从而增强超声显影;③靶向性能好;要实现超声分子探针的靶向性能,必须选取合适的靶点。目前,较多的肿瘤靶向手段集中在肿瘤血管内皮细胞异常表达的物质,如血管内皮生长因子(vascular endothelial growth factor, VEGF)及受体、整合素αvβ3、细胞间黏附分子ICAM-1等,还不能真正地靶向肿瘤细胞。有研究[9]发现,叶酸受体在大部分恶性肿瘤组织,如卵巢癌、鼻咽癌、肝癌、肺癌组织中高度表达,且叶酸受体表达水平越高,肿瘤细胞分化越差,而在正常组织中几乎不表达。叶酸是天然存在的小分子物质,无免疫原性,因此,将叶酸用作靶向修饰配体,可特异性地与细胞表面的叶酸受体结合,在肿瘤的诊断、靶向药物、基因治疗等多方面有良好的应用前景。本研究中制备FR-HCPT-PNPCA用到的壳膜材料含有耦联叶酸的磷脂,在体外实验中,可较好地靶向肝癌细胞。
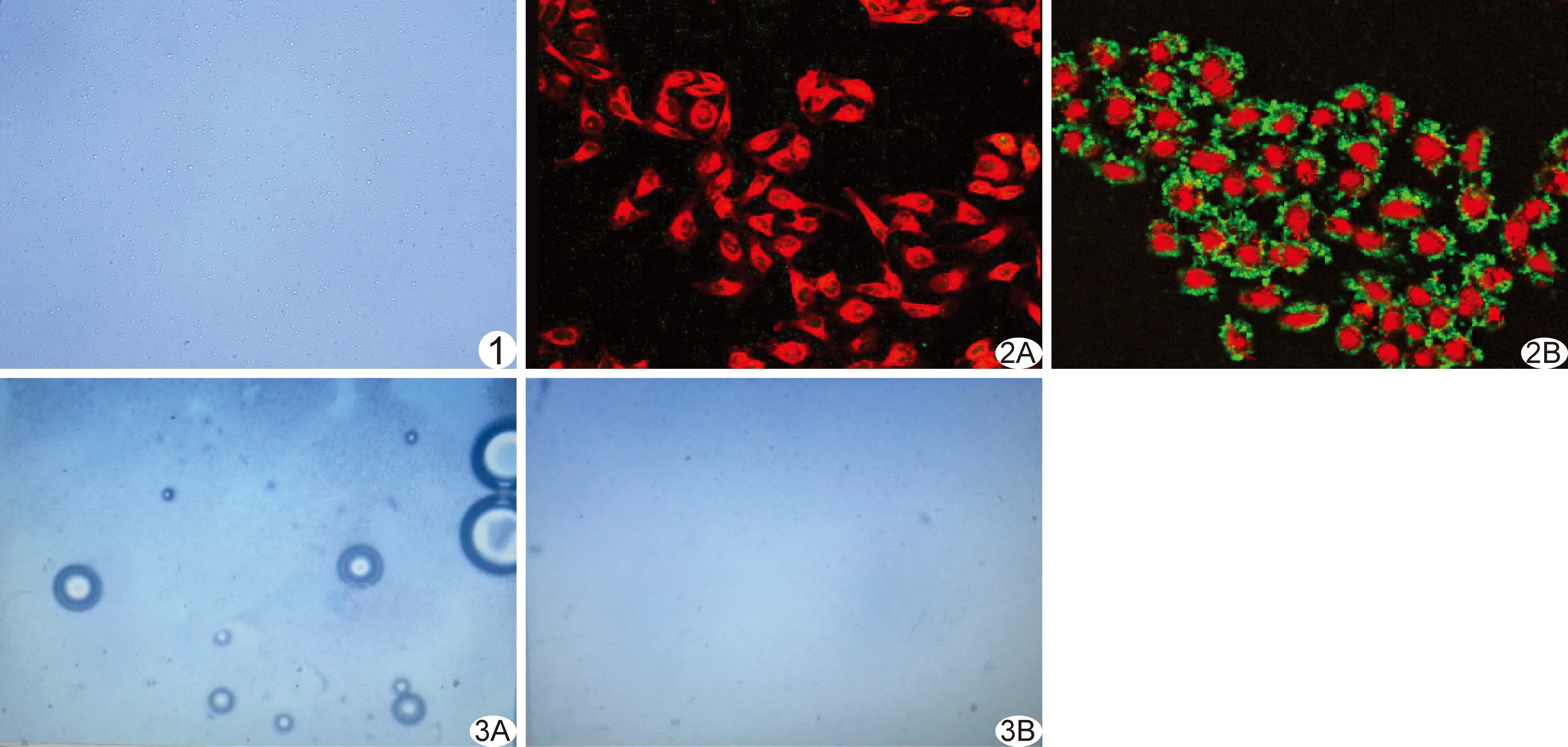
图1 FR-HCPT-PNPCA纳米粒光镜图(×1 000) 纳米粒形态规则,分布均匀 图2 FR-HCPT-PNPCA相变图(×1 000) 加入纳米粒孵育后于激光共聚焦显微镜下观察,非靶向组肝癌细胞(红色)周围未见纳米粒黏附(A),而靶向组可见到大量绿色荧光的纳米粒聚集黏附在肝癌细胞表面(B) 图3 FR-HCPT-PNPCA相变图(×400) 随着温度增加至70℃,相变组(A)可见明显的纳米粒相变,随微气泡的产生和增大,普通非相变组(B)则未见相变和气泡的产生
对于肿瘤治疗,药物化疗仍然是不可或缺的手段。肿瘤靶向给药系统(targeted drug delivery system, TDDS)通过某些特殊载体将化疗药物定向输送至靶组织,并局部释放药物作用于肿瘤细胞,而不影响非靶区的正常细胞功能,从而提高疗效、减少全身毒副作用[5]。将化疗药物如紫杉醇在制备过程中包载于壳膜,利用超声靶向破坏微泡(ultrasound-targeted microbubble destruction, UTMD)技术控制药物释放,被认为是一种非常有前景的控释药物的方法。但由于载体的空间有限,其载药量较低,无法满足临床所需的剂量。羟基喜树碱是目前治疗多种恶性肿瘤疗效较好的化疗药物,相比于其他抗肿瘤药物,其所需药物剂量低(4~6 mg/d)[6,10-11],可弥补脂质超声微泡自身载药量有限的缺陷,在利用UTMD技术治疗中更具优势。本研究制备的包载10-HCPT的纳米粒,具有较高的包封率(70.42%)和载药量(20.05%),可达到肿瘤治疗剂量。
本研究综合各种超声分子探针的优势,成功制备出一种叶酸受体靶向、包载化疗药物10-HCPT、具有相变能力的纳米粒FR-HCPT-PNPCA乳液,有望成为一种多功能的超声分子探针。本课题组将进一步进行该分子探针的体内相变显影和体内外释药实验,以及治疗裸鼠肝癌移植瘤的研究,为进入临床应用奠定基础。
[1] Sanna V, Pala N, Sechi M. Targeted therapy using nanotechnology: Focus on cancer. Int J Nanomedicine, 2014,9:467-483.
[2] Zhou Y, Wang Z, Chen Y, et al. Microbubbles from gas-generating perfluorohexane nanoemulsions for targeted temperature-sensitive ultrasonography and synergistic HIFU ablation of tumors. Adv Mater, 2013,25(30):4123-4130.
[3] 周洋,郑元义,冉海涛,等.叶酸受体靶向液态氟碳纳米粒造影剂的制备及体外寻靶实验研究.中国医学影像技术,2012,28(1):52-54.
[4] 杭渤,束永前,刘平,等.肿瘤的精准医疗:概念、技术和展望.科技导报,2015,33(15):14-21.
[5] 杨世艳,何兵,李明星.载药微泡研究进展.中国中西医结合影像学杂志,2015,13(1):92-95.
[6] Li P, Zheng Y, Ran H, et al. Ultrasound triggered drug release from 10-hydroxycamptothecin-loaded phospholipid microbubbles for targeted tumor therapy in mice. J Control Release, 2012,162(2):349-354.
[7] Cai WB, Yang HL, Zhang J, et al. Theoptimized fabrication of nanobubbles as ultrasound contrast agents for tumor imaging. Sci Rep, 2015,5:13725.
[8] Rapoport N, Nam KH, Gupta R, et al. Ultrasound-mediated tumor imaging and nanotherapy using drug loaded, block copolymer stabilized perfluorocarbon nanoemulsions. J Control Release, 2011,153(1):4-15.
[9] Wang F, Chen Y, Zhang D, et al. Folate-mediated targeted and intracellular delivery of paclitaxel using a novel deoxycholic acid-O-carboxymethylated chitosan-folic acid micelles. Int J Nanomedicine, 2012,7:325-337.
[10] 唐琴,朱深银,常淑芳,等.两种相变型多功能纳米粒的制备及体外特性比较.中国介入影像与治疗学,2016,13(10):636-641.
[11] 赵红雲,梅浙川,郑元义,等.液态氟碳纳米粒液-气相变治疗肝癌的体外实验.中国介入影像与治疗学,2015,12(2):114-117.
Preparation and characteristics of 10-hydroxycamptothecin loaded folate-receptor targeted phase-change contrast agent
LIYouwei1,ZHOUWei2,ZHOUYang2*,YEMing2,ZHOUHong2
(1.DepartmentofHepatobiliarySurgery,thePeople'sHospitalofDeyang,Deyang618000,China;2.DepartmentofUltrasound,theSecondAffiliatedClinicalHospitalofChongqinngMedicalUniversity,theThirdPeople'sHospitalofChengdu,Chengdu600031,China)
Objective To prepare a 10-hydroxycamptothecin (10-HCPT) loaded folate-receptor targeted phase-change contrast agent (FR-HCPT-PNPCA), and to study the general characteristics including drug loading, phase changing and targeting capability in vitro. Methods Using a method of two-step emulsification, the phase-change nanoparticles loading anticancer drug (10-HCPT) with lipids shell and liquid pefluorocarbon core were prepared. The entrapment efficiency and the drug-loading amounts were studied by high performance liquid chromatography, and the phase transition of the nanoparticles after heating was observed. The targeting ability was evaluated on liver cancer cell line 7721 in vitro. Results The FR-HCPT-PNPCA, with a drug encapsulation rate of about 70.42% and drug loading amounts of about 20.05%, was prepared successfully. When being heated to 70℃, obvious phase changing and microbubbles generating could be observed under microscope. In addition, a large amount of FR-HCPT-PNPCA particles could adhere specifically around the 7721 cells. Conclusion The prepared FR-HCPT-PNPCA, which has a stable characteristic and high performance of drug loading and tumor targeting, is expected to become a promising multifunctional molecular ultrasound probe for diagnosis and treatment of tumor.
10-hydroxycamptothecin; Folate; Target; Phase change; Contrast media
国家自然科学基金青年基金项目(81401433)、四川省卫计委科研项目(130416)。
李友伟(1973—),男,四川广安人,硕士,副主任医师。研究方向:肝癌的多学科诊治。E-mail: 2729044075@qq.com
周洋,重庆医科大学附属成都第二临床学院,成都市第三人民医院超声科,600031。E-mail: hansenzy@126.com
2016-10-17
2017-01-11
R445.1; R-332
A
1672-8475(2017)03-0169-04
10.13929/j.1672-8475.201610017