腹部肿瘤术后出血的血管造影表现及栓塞治疗
刘 鹏,朱 旭,徐海峰,王晓东,曹 广,郭建海,高 嵩,朱林忠,陈 辉
(北京大学肿瘤医院暨北京市肿瘤防治研究所介入治疗科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
腹部肿瘤术后出血的血管造影表现及栓塞治疗
刘 鹏,朱 旭,徐海峰,王晓东,曹 广,郭建海,高 嵩,朱林忠,陈 辉*
(北京大学肿瘤医院暨北京市肿瘤防治研究所介入治疗科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
目的 探讨腹部肿瘤外科术后出血的血管造影表现,评价介入栓塞治疗的安全性和有效性。方法 回顾分析腹部肿瘤外科术后出血69例患者的临床资料、血管造影表现和栓塞治疗情况,评价栓塞治疗效果、休克指数<1.0、1.0~1.5、>1.5时血管造影和栓塞止血情况及并发症情况。结果 对69例共进行88例次血管造影,血管造影阳性率75.00%(66/88),行介入栓塞治疗67例次,止血成功49例次(49/67,73.13%);休克指数1.0~1.5时,血管造影阳性率达89.19%(33/37),栓塞止血成功率77.42%(24/31)。8例患者介入止血术后1个月内死亡。结论 介入栓塞止血治疗安全、有效,可作为腹部肿瘤术后出血的首选治疗方法。止血时应关注休克指数,尽早选择血管造影和栓塞治疗;在血管造影为阴性结果时,经验性栓塞治疗并不能为患者带来更大的获益。
腹部;肿瘤;外科手术;出血;血管造影术;介入治疗
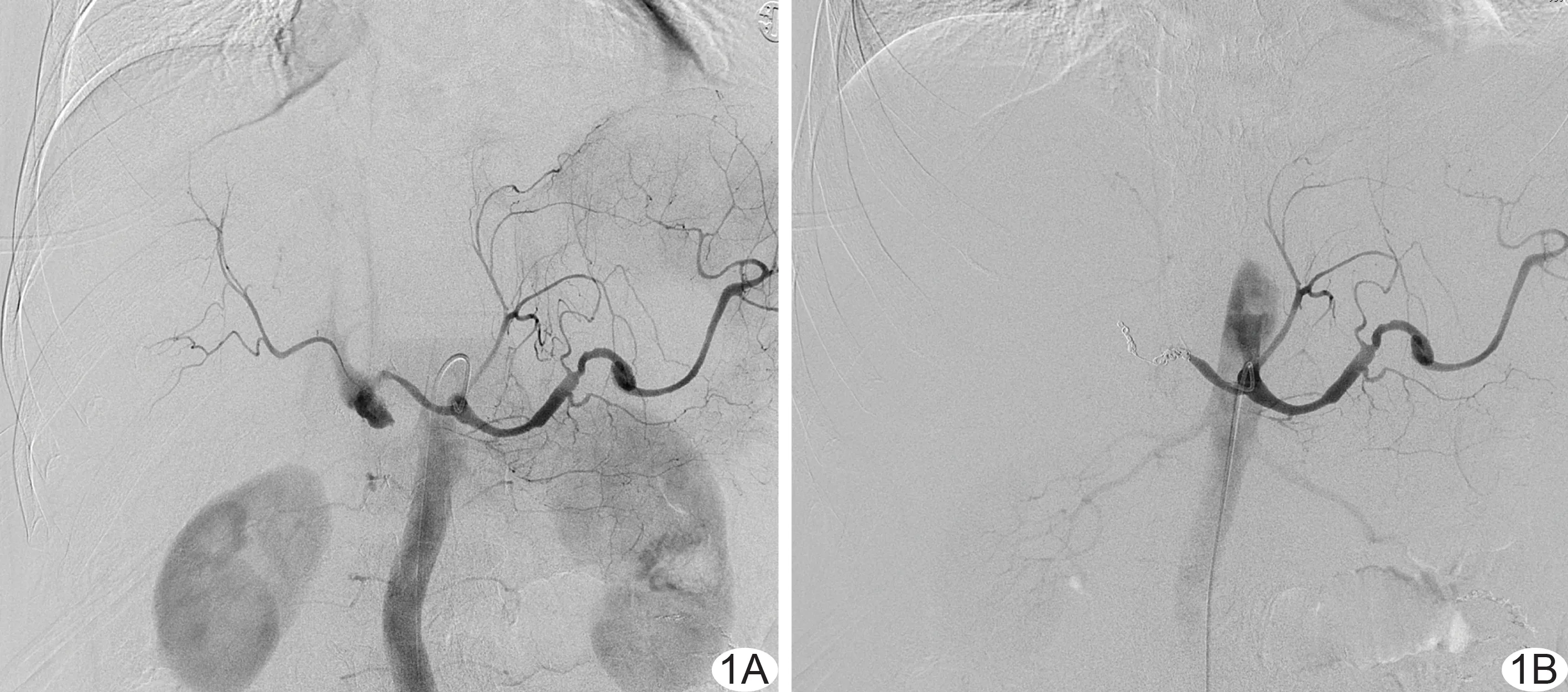
图1 患者男,64岁,胆管癌术后出血 A.术前造影示胃十二指肠动脉出血,对比剂外溢; B.栓塞后造影表现为对比剂外溢消失,胃十二指肠动脉主干栓塞
随着外科技术的进步和相关辅助治疗手段的发展,腹部肿瘤(主要包括胃、十二指肠、肝胆、胰腺、结直肠肿瘤等)的外科切除适应证不断扩大,围手术期死亡率明显降低。但出血作为外科术后的严重并发症其发生率仍处于较高水平[1]。肿瘤患者术后出血一旦发生常进展迅速,严重危及患者生命,如上腹部肿瘤的经典术式胰十二指肠切除术,术后出血的发生率为4%~16%,死亡率高达11%~54%[2]。采用血管内介入技术即血管造影及栓塞术,既可准确寻找出血血管、直接栓塞止血,又可为再次手术提供相关依据[3]。本研究回顾性分析腹部肿瘤患者外科术后出血的临床资料、血管造影及介入栓塞止血情况,探讨介入止血治疗的有效性、安全性和治疗的最佳时机。
1 资料与方法
1.1一般资料 收集2010年1月—2015年12月间我院因腹部肿瘤术后出血而行介入治疗的患者69例,男48例,女21例,年龄26~83岁,中位年龄62岁,其中胰腺肿瘤27例,胃癌20例,胆系肿瘤11例,小肠肿瘤7例,肝癌2例,结肠癌2例。
1.2 方法 采用GE Inova4100血管造影机,导管和相应导丝,非离子型对比剂,微弹簧圈(Cook,型号18-6-5、18-6-2、18-5-2、18-3-3),PVA颗粒(直径100、300、500 μm),明胶海绵颗粒(直径150~350、350~560、560~710、710~1000 μm)等。
对所有患者均完善术前检查,建立静脉通路,必要时吸氧、输血、给予止血药物及支持治疗,心电、血压、血氧等监测。患者取平卧位,常规消毒、局部麻醉,经股动脉穿刺,置入导管行腹腔动脉、肠系膜上/下动脉等造影(帧频3~6帧/秒,当呼吸不能配合时增至 7.5帧/秒),确定出血相关责任血管,选用适当规格微弹簧圈栓塞止血,必要时结合PVA或明胶海绵颗粒补充栓塞,栓塞后再次造影确认止血效果。术后继续治疗相关出血因素,持续生命体征监测至术后72 h,密切观察病情变化,发现异常及时处理。
1.3 效果判定 术后第1、2、3和7天复查血常规、血生化等,1个月复查腹部CT/MRI。术后72 h内无再次出血为止血成功;72 h内再次出血患者,如血管造影或手术确认原部位再次出血,则认为本次介入止血失败,如确认其他部位出血而原部位无出血,则认为止血成功。分析患者在休克指数<1.0、1.0~1.5、>1.5时血管造影、栓塞止血情况。
1.4统计学分析 采用SPSS 17.0统计分析软件,对未见明显出血征象患者接受经验性栓塞和未接受经验性栓塞的再出血率行列联表χ2检验。P<0.05为差异有统计学意义。
2 结果
对69例患者共行88例次血管造影,造影后进行栓塞治疗67例次,11例患者进行2次以上血管造影,栓塞止血成功49例次(49/67,73.13%)。早期出血(≤5天)6例,迟发出血(>5天)63例。
患者血管造影直接征象表现为对比剂外溢,共52例次,其中48例次行栓塞治疗(图1),栓塞止血成功率77.08%(37/48),其中18例次同时伴随间接征象。14例次仅见间接征象,表现为假性动脉瘤形成、动脉管壁不光滑、局限性扩张、交通支形成等;22例次血管造影未见明确出血征象,其中9例次依据手术情况推测责任血管,行经验性栓塞,止血成功率55.56%(5/9)。血管造影征象与栓塞止血效果见表1。
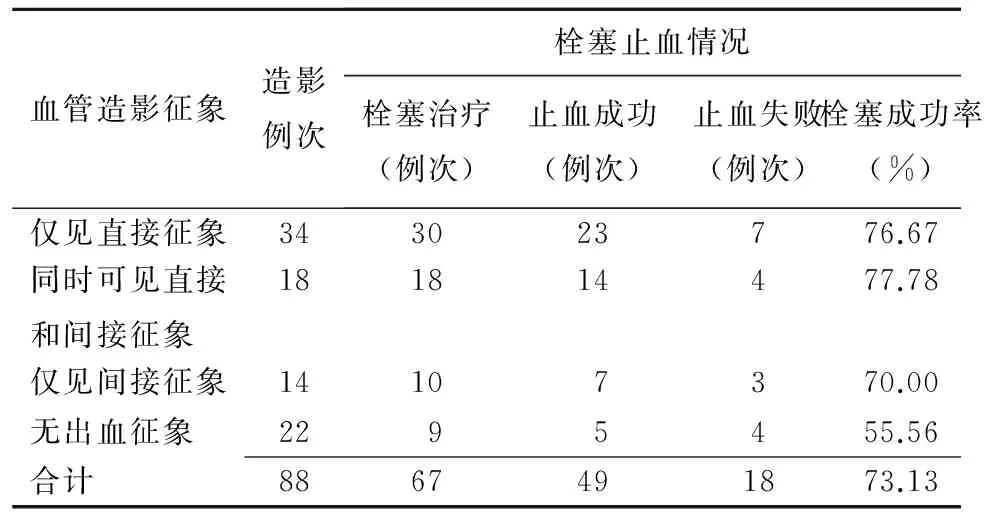
表1 血管造影征象与栓塞止血效果
88例次血管造影中,腹腔出血52例次,消化道出血19例次,混合型出血17例次(同时腹腔及消化道出血),其中混合性出血血管造影阳性率94.12%(16/17),栓塞成功率81.25%(13/16)。
血管造影阳性共66例次(66/88,75.00%),相关责任血管中胃十二指肠动脉出血22例次(22/66,33.33%),其余出血责任血管依次为肝总动脉主干9例次,肝固有动脉主干8例次,脾动脉7例次,肠系膜上动脉4例次,胃左动脉4例次,腹腔动脉主干3例次,肝左动脉3例次,膈下动脉3例次,胰十二指肠动脉2例次,肝右动脉1例次。
22例次未见明确出血征象的患者中9例次进行经验性栓塞,其中再出血4例次,无再出血5例次;未行经验性栓塞的13例次中,再出血6例次,无再出血7例次;行经验性栓塞与未行经验性栓塞患者再出血率差异无统计学意义(χ2=0.006,P=1.00)。
不同休克指数时血管造影阳性率、进行栓塞治疗的成功率(包括血管造影阴性栓塞止血成功病例)见表2。

表2 不同休克指数时血管造影阳性率和
52例患者未见明显并发症,行肝动脉栓塞患者可出现肝功能一过性损伤,多于5~7天后恢复。7例行肝动脉栓塞患者于CT复查中发现肝脏区域性灌注减低,考虑为栓塞后肝梗死,于术后3个月内恢复。1例出现过敏性皮疹。1例出现术后感染,经治疗后好转。8例介入术后1个月内死亡,其中1例术后当天出现急性严重溶血,第3天继发多脏器功能衰竭死亡;4例因无法止血死亡,其中2例为腹腔动脉出血,1例为胃左动脉出血,1例为肠系膜上动脉出血;另3例合并腹腔感染,成功止血后10~21天死于再出血、感染或多脏器功能衰竭。
3 讨论
手术是恶性肿瘤的根治性治疗手段之一,而出血是常见的并发症,按出血时间分可分为早期出血(≤5天)和延迟出血(>5天)[4]。早期出血主要与外科技术有关,如动脉结扎不彻底、病灶残端处理不当等,多发生于术后24~48 h。而迟发出血多发生于术后2周内,出血原因较多,如腹腔感染、胰瘘、肠瘘、凝血功能障碍等。本组早期出血6例,3例血管造影阳性,其中2例因出血血管为动脉主干而需手术止血,经手术确认为结扎缝线脱落。有研究[4-5]报道,尽快确定早期出血血管有助于尽早进行介入治疗;迟发出血(>5天)63例,主要由于术后并发症,如胰瘘、肠瘘等导致腹腔感染,感染侵蚀相邻动脉进而导致出血。
有学者[6]认为消化系统出血的首选诊治方法为内镜,但对于外科手术后的出血,原因多是相关动脉的损伤,往往不能通过内镜止血。本组腹腔出血(52例次)及混合出血(17例次)占所有术后出血患者的78.41%(69/88)。通过血管造影可明确大部分患者的出血原因和部位。有报道[7]血管造影诊断出血的阳性率高达82%~95%,本组造影阳性率略低(66/88,75.00%),可能与本组对可疑出血患者进行介入诊治较积极有关。
血管造影和栓塞被推荐为非静脉曲张性消化道出血的一线诊断和治疗方案[8],其有创伤小、安全、疗效确切的特点,应成为外科术后出血的首选治疗方法,尤其对于无腹腔感染的患者。对于合并腹腔感染的患者,轻度感染,可选择介入止血+抗感染治疗;对于重度腹腔感染患者,建议先介入止血,为外科清创赢得时间。
由于术后血管解剖位置改变,血管造影确定出血相关血管有时较困难,但依据手术部位进行初步判断,只要插管到位,并通过增加摄影帧数、术中经引流管冲洗等手段,判断出血位置及主要相关动脉的来源并不难[9]。其中假性动脉瘤的正确辨识较重要,表现为对比剂自载瘤动脉进入假性瘤体内、呈喷射状或对比剂滞留时间较长,静脉期不消退,最常发生于胃十二指肠动脉[10]。有学者[11]认为在不影响脏器主要功能的情况下,对可疑靶血管进行经验性栓塞可以起到止血目的。
本研究未见明确出血征象的患者中,行经验性栓塞和未行经验性栓塞再出血率的差异无统计学意义,提示经验性栓塞无太大临床价值,但由于病例数较少,还需更多病例进一步检验。
血管造影诊断出血的条件是持续出血大于0.5 ml/min。单纯以血管造影诊断,出血量越多,造影阳性的可能越大,但此时患者的生命体征较差。休克指数[12]是临床判断出血情况的常用指标,休克指数=心率/收缩压,0.5为正常,1.0为轻度休克,失血约20%~30%,>1.5为严重休克,失血约30%~50%。本研究发现当患者处于严重休克时(休克指数>1.5),血管造影的阳性率固然可以达到100%(7/7),但有2例患者因严重休克反而不能进行栓塞治疗,而患者生命体征平稳时(休克指数<1),血管造影阳性率和止血成功率略低,但对出血患者的诊治应更加积极,不宜过于考虑血管造影的阳性结果而延误时机,尤其当休克指数接近1.0时。
动脉栓塞最严重并发症是肠管缺血梗死,发生率为3%~8%[13],本研究未见该类患者。肝梗死是常见的缺血性肝损伤,尤其是存在门静脉狭窄或缺乏代偿的肝动脉时[14]。本组7例患者于介入术后复查中发现肝脏区域性灌注减低,考虑为栓塞后出现的肝段梗死,为完全栓塞肝总动脉或肝固有动脉后出现,但于术后3个月内恢复正常,提示只要门静脉通畅,该并发症不会导致严重事件。1例出现术后皮疹,可能与对比剂过敏有关。1例死于术后急性溶血,考虑可能与介入栓塞应用的铂金微弹簧圈过敏有关[15],但有待进一步探讨。
综上所述,血管内介入技术在上腹部肿瘤手术后近期出血性疾病的应用中定位准确、方法简单、疗效确切、并发症少,是一种安全、有效的治疗手段。笔者认为在介入止血治疗中,治疗的时机选择十分重要,应在患者一般情况尚稳定的情况下尽早积极介入治疗,在血管造影为阴性结果时,经验性栓塞并不能为患者带来更大的获益。
[1] Dagi TF. The management of postoperative bleeding. Surg Clin North Am, 2005,85(6):1191-1213.
[2] Beyer L, Bonmardion R, Marciano S, et al. Results of non-operative therapy for delayed hemorrhage after pancreaticoduodenectomy. J Gastrointest Surg, 2009,13(5):922-928.
[3] 徐海峰,朱旭,陈辉,等.胰十二指肠术后出血的血管造影表现和介入治疗.中华医学杂志,2013,93(1):55-57.
[4] Fujii Y, Shimada H, Endo I, et al. Management of massive arterial hemorrhage after pancreatobiliary surgery: Does embolotherapy contribute to successful outcom? J Gastrointest Surg, 2007,11(4):432-438.
[5] Eckardt AJ, Klein F, Adler A, et al. Management and outcomes of haemorrhage after pancreatogastrostomy versus pancreatojejunostomy. Br J Surg, 2011,98(11):1599-1607.
[6] 冯春,周平红.内镜止血治疗在消化道出血中的临床应用.中华胃肠外科杂志,2014,17(8):839-840.
[7] Zhou CG, Shi HB, Liu S, et al. Transarterial embolization for massive gastrointestinal hemorrhage following abdominal surgery. World J Gastroenterol, 2013,19(40):6869-6875.
[8] Zhang J, Zhu X, Chen H, et al. Management of delayed post-pancreaticoduodenectomy arterial bleeding: Interventional radiological treatment first. Pancreatology, 2011,11(5):455-463.
[9] 彭志康,刘亚洪,卢蔚芳,等.消化道出血的血管造影诊断与介入治疗的相关问题探讨.中国介入影像与治疗学,2012,9(2):110-113.
[10] Lee JH, Hwang DW, Lee SY, et al. Clinical features and management of pseudoaneurysmal bleeding after pancreatoduodenectomy. Am Surg, 2012,78(3):309-317.
[11] Ripoll C, Baares R, Beceiro I, et al. Comparison of transcatheter arterial embolization and surgery for treatment of bleeding peptic ulcer after endoscopic treatment failure. J Vasc Interv Radiol, 2004,15(5):447-450.
[12] Rady MY, Smithline HA, Blake H, et al. A comparison of the shock index and conventional vital signs to identify acute, critical illness in the emergency department. Ann Emerg Med, 1994,24(4):685-690.
[13] Ramaswamy RS, Choi HW, Mouser HC, et al. Role of interventional radiology in the management of acute gastrointestinal bleeding. World J Radiol, 2014,6(4):82-92.
[14] Cho SK, Kim SS, Do YS, et al. Ischemic liver injuries after hepatic artery embolization in patients with delayed postoperative hemorrhage following hepatobiliary pancreatic surgery. Acta Radiol, 2011,52(4):393-400.
[15] Clague GA, Mcgann G, Gilbert H. An unusual allergy to platinum embolization coils. Cardiovasc Intervent Radiol, 2012,35(1):215-216.
Angiographic manifestations and embolization for post-operative hemorrhage in abdominal tumors
LIUPeng,ZHUXu,XUHaifeng,WANGXiaodong,CAOGuang,GUOJianhai,GAOSong,ZHULinzhong,CHENHui*
(DepartmentofInterventionalTherapy,PekingUniversityCancerHospital&Institute,KeyLaboratoryofCarcinogenesisandTranslationalResearch[MinistryofEducation],Beijing100142,China)
Objective To discuss the angiographic manifestations of hemorrhage after surgical resection of abdominal tumors, and to evaluate the safety and efficacy of interventional embolization therapy. Methods For 69 patients with postoperative hemorrhage, the clinical data, angiographic manifestations and embolization procedures were retrospective analyzed. The effect of embolization, angiography and embolization in different shock index and the complications were evaluated. Results A total of 69 patients underwent angiography 88 times, the positive rate was 75.00% (66/88). All of 67 cases underwent embolization, hemostasis was successful in 49 cases (49/67, 73.13%). When the shock index between 1.0 and 1.5, the angiographic positive rate reached 89.19% (33/37), and the success rate of hemostasis was 77.42% (24/31). A total of 8 patients died within one month after the intervention therapy. Conclusion Interventional embolization is a safe and effective technique for the treatment of hemorrhage after abdominal surgery. Angiography and embolization treatment should be as early as possible, and pay attention to the shock index. When the results of angiography is negative, embolization without purpose dose not lead to greater benefits for patients.
Abdomen; Neoplasms; Surgical procedures, operative; Hemorrhage; Angiography; Interventional therapy
刘鹏(1978—),男,河北廊坊人,硕士,主治医师。研究方向:恶性肿瘤及并发症的介入治疗。E-mail: dr.liu@163.com
陈辉,北京大学肿瘤医院暨北京市肿瘤防治研究所介入治疗科 恶性肿瘤发病机制及转化研究教育部重点实验室,100142。
E-mail: chh2321@126.com
2016-10-11
2016-12-11
R735; R816
A
1672-8475(2017)03-0143-04
10.13929/j.1672-8475.201610008