黄曲霉侵染后花生胚发育动态及抗感病相关种质群体结构
闫彩霞+张浩+李春娟+赵小波+王娟+单世华


摘要:為明确黄曲霉(Aspergillus flavus L.)侵染后花生(Arachis hypogaea)种仁的细胞学变化及抗黄曲霉相关种质的群体结构,将黄曲霉菌接种于高抗侵染种质J11和高感病种质泉花10号上,制成石蜡切片,数码显微镜下观察籽仁结构变化。结果显示,与抗侵染种质相比,黄曲霉侵染对感病种质的胚细胞组织破坏更严重,其发生远早于黄曲霉在种皮上的定殖。根据46个SSR位点的等位变异矩阵,利用Structure 2.3.3软件,采用基于贝叶斯数学模型的聚类方法对48个抗感黄曲霉相关材料进行群体结构检测,将供试材料划分为两大类4个亚群,分别命名为POP1、POP2、POP3和POP4,各亚群包含的材料数依次为8、13、9和15,另有3份材料属于混合亚群。利用NTSYS-pc 2.l0e以UPGMA法对全部种质进行PCoA分析,分组结果与群体结构中亚群划分结果比较吻合,两种分组结果均与种质的抗性特点有明显的相关性。
关键词:花生;黄曲霉;显微结构;群体结构;PCoA分析
ZTFLH:S435.652 文献标识码:A
Abstract: To clarify the cytological change of peanut seeds after Aspergillus flavus L. infection and population structure of 48 resistant-related genotypes, A. flavus was inoculated into high-resistant peanut genotype J11 and susceptible peanut genotype Quanhua 10, and then the paraffin section of seeds were observed under a digital microscope. The results showed that the tissues of embryo cells of susceptible genotype were more seriously damaged than those of resistant genotype, and the cell disintegration and nutrient loss occurred earlier than the colonization of A. flavus in seed coat. Using the allele array of 46 SSR loci covering peanut genome and Bias mathematical model, 48 genotypes were divided into four conservative subpopulations named POP1, POP2, POP3 and POP4, which contained 8, 13, 9 and 15 accessions respectively, and the other 3 accessions belonged to mixed subpopulation. By UPGMA clustering method of NTSYS software, principal component analysis divided all accessions into four quadrants, the result was basically in accordance with the composition of subpopulations. Two grouping results were both obviously correlated with the resistant characteristics of peanut genotypes.
Key words: Peanut; Aspergillus flavus; Microstructure; Population structure; PCoA analysis
ZTFLH:S435.652; Document code:A
黄曲霉毒素(aflatoxin)主要是由黄曲霉菌(Aspergillus flavus L.)侵染花生、玉米、大米、大豆以及坚果类寄主后产生的一类次级代谢产物,具有极强的毒性和致癌特性[1-4],严重威胁食品安全和人类健康。我国是世界上花生黄曲霉毒素污染较为严重的国家。中国农业科学研究院油料作物研究所对全国22个省市区的花生仁和花生油进行了黄曲霉毒素检测,结果花生仁污染率为26.3%,花生油的污染率为47.3%[5]。黄曲霉毒素对花生的污染主要发生在两个阶段:一是在收获前,土壤中发育荚果受黄曲霉菌侵染并产毒;二是在收获后的干燥、贮藏及加工阶段。花生结荚期遭遇干旱、高温天气,尤其是当种子含水量降至31%以下以及温度为28~30.5℃时,荚果很容易被黄曲霉菌侵染[6,7]。花生荚果的成熟程度和破损程度也与黄曲霉毒素污染有很大关系,不成熟的、较小的、过熟的以及昆虫引起的受伤荚果,黄曲霉毒素的污染程度显著高于完整荚果[8]。花生收获后,含水量逐渐下降,当荚果含水量降至12%~30%时,极易感染黄曲霉(高度危险期),毒素污染程度与荚果干燥时间、贮藏花生含水量呈正相关[9]。
国内外多年研究结果表明,花生对黄曲霉毒素污染的抗性主要有两种类型:一种是基于种皮结构及生化成分的抗性,即抗侵染,黄曲霉菌在具有这种抗性的花生上很难侵染和定殖;另一种是抗产毒,即在黄曲霉菌侵染后抑制其产生毒素,该抗性与花生的种皮及胚均有关系[10,11]。显微和超显微观察显示,抗性品种细胞壁较厚、表皮细胞间结合紧密、栅栏组织细胞层较密和厚、裂缝和气孔较少等;感病品种的种皮细胞壁相对较薄、细胞间结合较疏松、裂缝和气孔较大[12, 13]。此外,品种的抗性与种脐的结构有一定的关系,通常抗性品种的种脐较小且关闭,而感病品种种脐较长且开放[14]。抗性品种种皮蜡质层较厚,渗透性低,具有较多的木质素和酚类化合物,在荚果的中心区域有密集的木质化细胞,在正常的情况下不易破损[15-17],而感病品种则反之。
不同花生品种或种质对黄曲霉侵染抗性的差异以及表现方式为抗黄曲霉种质资源的筛选提供了理论依据和研究基础。Gopalan[18]首先在世界范围内鉴定出了第一个抗黄曲霉产毒花生种质US26。Mixon和Rogers[19]最早报道了两个抗黄曲霉侵染的花生种质P1337394F和P1337409,种子侵染率在5%以下。Mixon[20]在1986年又鉴定出GFA-l、GFA-2、AR-1、AR-2、AR-3、AR-4等6个抗侵染花生种质。Pua等[21]报道了4个抗侵染花生种质ACC63、CES48-30、Celebes和UplPN4。Mehan等[22]发掘出UF71513、Ah7223、J11、Var.27、RMP12等近20份抗侵染花生种质。Wilson等[23]鉴定出低产毒花生品种Tifton-8。Waliyar[24]证实了花生J11、55-437、ICGV81707、ICGV87094、ICGV87110的田间侵染抗性。Xiao等[25]鉴定出两个产毒量较低的花生种质91322、91048。以上品种均是由田间侵染鉴定获得的,受环境影响较大,耗时耗力且易对环境造成污染。分子标记及基因组测序技术的发展为花生黄曲霉抗性筛选和鉴定提供了有力的研究手段。Hong等[26]鉴定到5个和抗黄曲霉侵染高度相关的SSR标记,其中标记pPGSseq19D9能区分所有的抗感品种。黄莉等[27]检测到16个SSR位点与黄曲霉侵染病情指数、黄曲霉产毒量相关联,表型变异解释率为5.23%~17.19%。Wang等[28]比较了收获后黄曲霉侵染的抗感花生品种的转录组表达模式,得到了842个防御相关基因。
到目前为止,有关抗感黄曲霉花生超微结构差异的研究主要集中于种皮,且未施加任何处理,针对侵染后花生胚的发育动态、抗病种质的群体结构、抗黄曲霉与抗旱、抗旱与抗其他真菌病的关系等的研究均鲜见报道。本研究利用数码显微镜观察黄曲霉菌侵染后花生胚细胞的显微结构变化、SSR标记检测抗感黄曲霉相关种质的群体结构以及利用PCoA分析抗病种质间的遗传关系,从组织病理学和群体分化角度探讨花生对黄曲霉的抗性机制,为花生抗病育种提供有价值的抗源材料。
1 材料與方法
1.1 试验材料
1.1.1 细胞显微结构观察材料 试验对象为高抗黄曲霉侵染花生种质J11和高感黄曲霉侵染花生种质泉花10号(Quanhua10),种仁表面用70%乙醇均匀消毒,无菌水冲洗,种植于盛有灭菌土壤的花盆中,25~30℃温室培养。
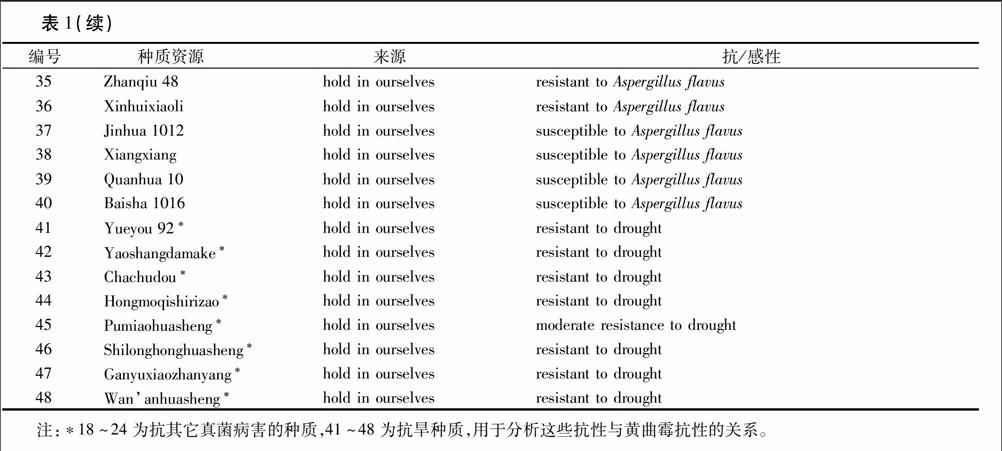
1.1.2 群体结构分析材料 选用国内外已鉴定的48份抗感黄曲霉相关种质为材料(包括7份抗其它真菌和8份抗旱种质,见表1),每份资源材料选取3粒种子,水培法生长至三片真叶出现,剪取三片幼叶液氮研磨,CTAB法提取基因组DNA备用,工作浓度为30 ng/μL。
1.2 试验方法
1.2.1 黄曲霉菌的培养和侵染 产黄曲霉毒素菌株A. flavus 2810来自福建农林大学油料作物研究所,在察氏培养基上30℃培养7 d后,用无菌水冲洗,配制成浓度为1×106 个/mL的孢子悬浮液,接种玉米粕,待玉米粕长满绿色的黄曲霉菌后备用。将J11和泉花10号花生材料分别分试验组和对照组,每组10株,分别种植在不同的鉴定池中,收获前30 d开始对试验组和对照组花生植株分别进行干旱处理,试验组于处理15 d后拨开根周土壤,将玉米粕均匀洒在植株基部,5 d后再接种1次,之后每隔3 d从植株基部取花生荚果一次,每次5粒,共3次,取后直接投入10%戊二醛中保存备用。对照组不做任何接种处理,取样时间和方式与试验组相同。
1.2.2 细胞显微结构研究的样品制备和观察 剥取试验组和对照组的花生种仁,迅速投入广口瓶中采用10%戊二醛进行前固定,乙醇梯度(80%、95%、100%)脱水,二甲苯: 100%乙醇(1:1)透明,熔点为54~56℃的切片石蜡透蜡2次,包埋,切片,二甲苯脱蜡,乙醇梯度(100%、95%、80%、50%)复水,1‰苏木素和1%曙红染色,乙醇梯度(95%、100%)脱水,二甲苯透明,最后封片。在Leica DMS1000数码显微镜下放大40倍观察。
1.2.3 SSR标记的多态性与群体结构分析
46个多态性高、条带单一的多态性标记用于分析48份抗感黄曲霉及相关种质的遗传多样性[29],其引物序列及所在连锁群见表2。利用Quantityone 4.6.2软件获得目的条带的分子量,根据SSR重复单元进行矫正,确定每一位点在不同材料中的等位变异,形成等位变异矩阵。利用软件Stucture 2.3.3进行基于贝叶斯(Bayesian Clustering)数学模型的亚群划分,估测群体结构,并计算材料相应的Q值[30]。采用Admixed Model估计最佳群体数K,取值范围为1~10,参数Iterations设为50 000,Burnin-period设为50 000,每个K 值重复运行3次,然后依据似然值最大原则选取一个合适的△K 值。
1.2.4 种质的主成分分析
PCR扩增产物电泳结果以“0,1”方式统计,即在相同迁移率位置上,有带的赋值为1,无带赋值为0,建立“0,1”数据阵。利用NTSYS-pc 2.l0e软件以UPGMA法(类平均法)进行PCoA分析。
2 结果与分析
2.1 黄曲霉侵染对花生胚细胞显微结构的影响
从图1可以看出,黄曲霉侵染后,抗病种质J11和感病种质泉花10号的胚表皮细胞完整而连续,无明显差异,但内部的胚细胞却发生了显著变化。侵染后3、6 d及9 d,J11胚细胞壁和细胞膜依然比较完整,脂肪粒成团聚集存在;而泉花10号的细胞壁和细胞膜则逐渐裂解,脂肪粒大量流失,侵染后9 d,部分细胞的脂肪粒已完全消失。由此看出,在花生胚表皮出现肉眼可见的黄曲霉定殖之前,籽仁内部的细胞结构和化学成分已发生了质变。收获后花生籽仁筛选以及种质抗病性的判断不能以表皮症状为依据,而要以胚组织的结构变化来判断。
2.2 SSR标记在基因组上的分布及其多态性
46个多态性SSR标记中,除7个来自其他连锁图谱或未定位外,其余标记分布于16个不同的连锁群上,LG13、LG14、LG19、LG20、LG21等5个连锁群上各有1个,LG6上分布最多,为7个,其余2~5个不等(图2),覆盖较为均匀。标记的多态性信息含量(PIC值)见于闫彩霞等[31]的研究结果,这些标记的变异丰富且在基因组的分布较为均匀,比较适合进行种质的群体结构分析。
2.3 抗感黄曲霉相关种质的群体结构分析
根据48个抗感黄曲霉相关材料46个SSR位点的等位变异矩阵,利用Structure 2.3.3软件,采用基于贝叶斯数学模型的聚类方法对全部种质进行群体结构检测,亚群数由最大似然值对应的△K值确定,结果表明,供试材料的确存在群体结构。当K=2时,△K出现最大峰值,似然值最大(图3),因此判断,供试材料可划分为两大类(图4);而当K=4的时候,△K又出现了一个较高的峰值,表明这48份材料可进一步划分成4个亚群,分别命名为POP1、POP2、POP3和POP4(图3、5)。
2.4 种质的亚群划分
成员概率(Membership Probabilities)≥0.5的材料被划分到相应的亚群,成员概率<0.5的材料划为混合亚群,每一份材料的划分信息见图5。各亚群包含的材料数依次为8、13、9和15,只有3份材料属于混合亚群,分别为香乡、泉花10号和茶杵豆,其中香乡和泉花10号均为POP2和POP3的混合亚群,茶杵豆为POP1和POP2的混合亚群。从整体来看,这些种质的群体结构非常理想。
分析亚群组成发现,其亚群划分与材料的地理来源及生长习性无明显关系,而与其抗病性呈一定相关性。例如,POP1的8份材料中,有AR-1、AR-2及ICGV87110共3份抗黄曲霉种质,以及红膜七十日早、蒲庙花生、石龙红花生、万安花生及赣榆小站秧共5份抗旱种质;POP2的13份材料中,有PI337409F、ICGV87094、ICGV92243、ICGV94379、ICGV94434、ICGV95440及新会小粒共7份抗侵染种质,91048和91322共2份低产毒种质,瑶上大麻壳和粵油92共2份抗旱种质,还有金花1012和白沙1016共2份高感种质;POP3的9份材料中,包含有Tiffrunner、C11-2-39、C209-6-60、C724-25-22、C156-47和C76-16共6份抗其它真菌种质,US26和Tifton-8共2份低产毒种质,以及抗黄曲霉种质湛秋48;POP4则包含材料3~14、16、17和18共15份抗侵染种质,以及抗根腐病(Thielariopsis basicola)的PERRY。
2.5 主成分(PCoA)分析
从图6可以看出,在0坐标轴上,将所有种质划分成4个象限,其中第Ⅰ和第Ⅲ象限集中了群体结构分析中POP1的全部种质,第Ⅳ象限集中了POP3中几乎全部种质,第Ⅰ和第Ⅱ象限集中了POP2和POP4 的几乎全部种质。属于POP1和POP2混合亚群的茶杵豆则处于4个象限的交汇处。香乡与泉花10号处于第Ⅳ象限中。综上所述,当坐标轴为0时,主成分分析的分组结果与群体结构中亚群划分结果是比较吻合的,也证实了48份材料的分群是比较可靠的。
3 结论与讨论
3.1 黄曲霉侵染对花生籽仁的影响
花生籽仁是花生收获的主要目标产物,决定着花生产量和品质的形成,但花生籽仁在生长过程中容易受到黄曲霉等病菌的侵染,特别是后期遭遇干旱或生长过程中遭遇间歇性干旱。从本试验结果可以看出,侵染后9 d,抗病种质的胚细胞膜依然比较完整,脂肪粒聚集成团,而感病种质的胚细胞膜开始裂解,脂肪粒流失。以前的研究认为种皮是花生抵御黄曲霉侵染的第一道屏障,收获后花生种仁的筛选或者是抗感黄曲霉种质的鉴定均是以种皮是否有无黄曲霉侵染或定殖为依据,但实际上种仁内部也就是胚细胞的解体、化学物质的渗漏早已开始,抗病基因的表达此时也迅速增强[32]。关于种仁脂肪、蛋白质等化学物质的组成、性质是否改变,以及黄曲霉毒素的含量变化还需要进一步确定。
3.2 群体结构分析
本研究将全部材料划分为两大类4个亚群,亚群间分化系数(Fst)为1.239~1.347,分组结果与其抗性基本一致,而与材料的地理来源无明显关系。Kameswara等[33]利用73个SSR标记评价美国微核心种质的72份花生材料,发现其遗传距离为0.088~0.254,聚类分析发现其类群划分是基于亚种分类和植物学类型。利用同样的材料,Wang等[34]和Belamkar等[35]先后进行了研究,发现美国核心种质存在群体结构,可划分为4个主要的亚群,亚群划分与2个变种和4个植物学类型有关。Naito等[36]将日本花生种质分成了多粒型亚群以及多粒型和珍珠豆型的混合亚群。这些研究与本研究结论并不一致,因此需要对本研究材料的植物学类型做进一步划分。本研究中香乡和泉花10号均为POP2和POP3的混合亚群,这与之前的聚类结果也是非常一致的[31],证明其遗传基础较为复杂,Peng等[37]在107份美国微核心种质和31个育成花生品种中也发现了类似情况。
3.3 干旱与抗黄曲霉及抗黄曲霉与抗其他真菌病害的关系
本研究选用在全基因组范围分布较为均匀的46个多态性SSR标记对48份抗感黄曲霉花生种质、抗其它真菌类种质及抗旱种质进行群体结构及PCoA分析,将这些种质划分为4个亚群和四个象限,可以看出,抗其它真菌类的种质几乎全部划分到POP3和第Ⅳ象限中,表明黄曲霉菌虽然也属于真菌范畴,但其抗病机理不同,是由不同的抗病基因控制的[32];8份抗旱种质和抗黄曲霉种质主要集中于第Ⅰ和第Ⅱ象限,表明抗黄曲霉与干旱有一定关系。Waliyar等[38]和Sudhakar等[39]的研究也证实在干旱条件下,会阻止植物抗毒素产生,而有利于黄曲霉菌生长,从而导致黄曲霉毒素产生[40-42]。但从亚群组成上看,抗旱种质全部划分到POP1和POP2中,抗黄曲霉种质则主要分布于POP2和POP4中,并不一致,表明在大田中干旱虽然是黄曲霉毒素污染的主要诱因,但其也受干旱发生阶段、频率、地温或气温等其他因素的影响[43]。
参考文献:
[1] Hall A J, Wild C P. Liver cancer in low and middle income countries: prevention should target vaccination, contaminated needles and aflatoxins [J]. British Medical Journal, 2003, 326: 994-995.
[2] Turner P C, Mendy M, White H, et al. Hepatitis B infection and aflatoxin biomarker levels in Gambian children [J]. Tropical Medicine & International Health, 2000, 5: 837-841.
[3] Wild C P, Hall A J. Primary prevention of hepatocellular carcinoma in developing countries [J]. Mutation Research, 2000, 462: 381-383.
[4] Wogan G N. Aflatoxin as a human carcinogen [J]. Hepatology, 1999, 30(2): 573-575.
[5] 廖伯寿. 花生[M]. 武汉: 湖北科学技术出版社, 2003: 25-26.
[6] Sander T H, Cole R J, Blankenship P D, et al. Aflatoxin concentration of peanuts from plants drought stressed in pod or root zones [J]. Peanut Science, 1993, 20: 5-8.
[7] Wu L X, Ding X X, Li P W, et al. Aflatoxin contamination of peanuts at harvest in China from 2010 to 2013 and its relationship with climatic conditions[J]. Food Control, 2016, 60:117-123.
[8] 雷永,王圣玉,李栋等. 花生抗青枯病种质对黄曲霉菌产毒的抗性反应[J]. 中国油料作物学报, 2004, 26(1): 69-71.
[9] Dorner J W, Richard J. Effect of application of nontoxigenic strains of Aspergillus flavus and A. parasiticus on subsequent aflatoxin contamination of peanuts in storage [J]. Journal of Stored Products Research, 2002, 38: 329-339.
[10] Zambettakis C H, Waliyar F, Bockelee M A, et al. Results of four years of research on resistance of groundnut varieties to Aspergillus flavus [J]. Oleagineux, 1981, 36(7): 377-385.
[11] Shan S H, Wang H X, Li C J, et al. Research of seed testa structure and storage material of peanut germplasm with different resistance to A. flavus [J]. Agricultural Sciences in China, 2006, 5(6): 478-482.
[12] Zambettakis C H, Bockelee M A, Waliyar F, et al. Varietal differences in groundnut sensitivity to contamination by A. flavus in the field and in artificial conditions [J]. Oleagineux, 1977, 32(8/9): 377-383.
[13] 周桂元, 梁炫強, 李一聪,等. 抗黄曲霉花生种皮纹理超微结构的研究[J]. 中国油料作物学报, 1999, 21(1):17-19.
[14] 梁炫强, 周桂元, 潘瑞炽,等. 花生种皮蜡质和角质层与黄曲霉侵染和产毒的关系[J]. 热带亚热带植物学报, 2003, 11(1):11-14.
[15] Laprade J C, Bartz J A, Norden A J, et al. Correlation of peanut seed coat surface wax accumulations with tolerance to colonization by Aspergillus flavus [J]. Proceedings of the American Peanut Research and Education Association, 1973, 5(1): 89-94.
[16] Vance C P, Kirk T K, Sherwood R T, et al. Lignifications as a mechanism of disease resistance [J]. Annual Review Phytopathol, 1980, 18: 259-288.
[17] Hua S T, Grosjean O K, Baker J L. Inhibition of aflatoxin biosynthesis by phenolic compounds [J]. Letters in Applied Microbiology, 1999, 29: 289-291.
[18] Gopalan C. Studies on aflatoxin [C]//Nutrition Document: Aflatoxin/19.P.A.G (WHO/FAO/UNICEF). Meeting-Geneva, 1966: 7.
[19] Mixon A C, Rogers K M. Peanut accessions resistance to seed infection by Aspergillus flavus [J]. Agronomy Journal, 1973, 65(4): 560-562.
[20] Mixon A C. Reducing Aspergillus species infection of peanut seed using resistant genotypes [J]. Journal of Environmental Quality, 1986, 15(2): 101-103.
[21] Pua A R, Medalla E C. Screening for resistance to Aspergillus flavus invasion in peanut [C]//Seventh anniversary and annual convention of the pest control council of the Philippines. 1986: 8-10.
[22] Mehan V K, McDonald D, Rajagopalan K. Resistance of peanut genotypes to seed infection by Aspergillus flavus in field trials in India [J]. Peanut Science, 1987, 14(2): 17-21.
[23] Wilson D M, Branch W D, Beaver R W, et al. Screening peanut genotypes for resistance to aflatoxin accumulation [C]//Proceeding of the American peanut research and education society. 1990: 22-23.
[24] Waliyar F. Aspergillus flavus and A. niger contamination of groundnut in Niger [C]//Proceedings of the American peanut research and education society. 1990: 22-32.
[25] 肖達人, 王圣玉, 张洪玲. 花生抗黄曲霉产毒快速鉴定法[J]. 中国油料作物科学, 1999, 21(3): 72-76.
[26] 洪彦彬, 李少雄, 刘海燕,等. SSR标记与花生抗黄曲霉性状的关联分析[J]. 分子植物育种, 2009, 7(2): 360-364.
[27] 闫彩霞, 张廷婷, 单世华,等. 花生种皮抗黄曲霉相关基因PnLOX2的表达分析[J]. 花生学报, 2009, 38(4): 26-30.
[28] 黄莉, 任小平, 张晓杰, 等. ICRISAT花生微核心种质农艺性状和黄曲霉抗性关联分析[J]. 作物学报, 2012, 8(6): 935-946.
[29] Wang H, Penmetsa RV, Yuan M, et al. Development and characterization of BAC-end sequence derived SSRs, and their incorporation into a new higher density genetic map for cultivated peanut (Arachis hypogaea L.) [J]. BMC Plant Biology, 2012, 12(1): 10.
[30] Pritchard J, Przeworski M. Linkage disequilibrium in humans: models and data[J]. The American Journal of Human Genetics, 2001, 69: 1-14.
[31] 闫彩霞,张浩,张廷婷,等. 抗感黄曲霉花生种质遗传多样性评价与指纹图谱构建[J]. 山东农业科学, 2016, 48(1): 1-6.
[32] Wang H, Lei Y, Wan L, et al. Comparative transcript profiling of resistant and susceptible peanut post-harvest seeds in response to aflatoxin production by Aspergillus flavus[J]. BMC Plant Biology, 2016, 16(1): 54.
[33] Kameswara R K, Mark D B, Gloria B, et al. Molecular characterization of the U.S. peanut mini core collection using microsatellite markers[J]. Crop Science, 2007, 47(4): 1718-1727.
[34] Wang ML, Sukumaran S, Barkley N A, et al. Population structure and marker–trait association analysis of the US peanut (Arachis hypogaea L.) mini-core collection[J]. Theoretical and Applied Genetics, 2011, 123(8): 1307-1317.
[35] Belamkar V, Selvaraj M G, Ayers J L, et al. A first insight into population structure and linkage disequilibrium in the US peanut mini core collection[J]. Genetic, 2011, 139(4): 411-429.
[36] Naito Y, Suzuki S, Iwata Y, et al. Genetic diversity and relationship analysis of peanut germplasm using SSR markers[J]. Breeding Science, 2008, 58(3): 293-300.
[37] Peng Z, Gallo M, Tillman B L, et al. Molecular marker development from transcript sequences and germplasm evaluation for cultivated peanut (Arachis hypogaea L.) [J]. Molecular Genetics & Genomics, 2015: 1-19.
[38] Waliyar F, Reddy S V, Subramaniam K, et al. Importance of mycotoxins in food and feed in India[J]. Aspect Appl. Biol., 2003, 68: 1-8.
[39] Sudhakar P, Lathat P, Babitha M, et al. Relationship of drought tolerance traits with aflatoxin contamination in groundnut[J]. Indian J. Plant Physiol., 2007, 12: 261-265.
[40] Craufurd P Q, Prasad P V V, Waliyar F, et al. Drought, pod yield, preharvest Aspergillus infection and aflatoxin contamination on peanut in Niger[J]. Field Crops Res., 2006, 98: 20-29.
[41] Latha P, Sudhakar P, Sreenivasulu Y, et al. Relationship between total phenols and aflatoxin production of peanut genotypes under end of- season drought conditions[J]. Acta Physiol. Plant, 2007, 29: 563-566.
[42] Girdthai T, Jogloy S, Vorasoot N, et al. Heritability of, and genotypic correlations between, aflatoxin traits and physiological traits for drought tolerance under end of season drought in peanut (Arachis hypogaea L.) [J]. Field Crops Res., 2010, 118: 169-176.
[43]Cole R J, Sanders T H, Dorner J W, et al. Environmental conditions required to induce preharvest aflatoxin contamination of groundnut: Summary of six years research [C]//McDonald D, Mehan V K. Aflatoxin contamination of groundnut: Proc. Int. Workshop. ICRISAT, India, 1989:279-287.

