碳硫复合材料制备锂硫电池的研究进展
林鸿鹏,王娜,方新荣,宋晓娜,邓耀明,武俊伟
( 1.东莞市迈科新能源有限公司,广东 东莞 523800;2.哈尔滨工业大学(深圳) 材料科学与工程学院, 深圳 518101)
1 引言
由于不可再生能源的消耗,储量逐渐减少,以及化石能源的使用带来一系列的环境污染等问题,我们需要研究新型无污染的可再生能源来改变这一现状,来替代目前所使用的能源供应体系。因此,新能源的开发利用是人类不断探究的重要课题。在人们对新能源开发的探究过程中,锂离子电池在储能方面表现非常出色[1-3],广泛地应用于便携式电子设备、电动汽车、能源储存系统等领域。经过这么多年的开发与改进,传统锂离子电池的能量密度已经接近理论极限[4]。与传统锂离子电池相比,锂硫电池具有更高的能量密度和比容量,与人类需求更为贴近[5-7]。理论上锂硫电池能量密度大约是2600Wh·kg-1,是目前已商业化电池的10倍[8]。其理论比容量可以达到1673mAh ·g-1,远远高于传统的锂离子电池[9-11]。除此之外,硫在自然界中大量存在,原材料成本极低,并且在充放电过程中无有害物质产生,无毒无污染,属于环境友好型材料[12]。上述几方面的巨大优势,使锂硫电池成为了新一代极具开发前景的锂二次电池,将为新兴技术产业的崛起起到非常关键的作用[13,14]。
2 锂硫电池综述
2.1 锂硫电池介绍
硫是处于元素周期表中第三周期VI A族的非金属元素,其单质在常温下是斜方硫(菱形硫),是以S8环状分子形式存在的黄色固体。锂硫电池的高能量密度和高比容量源于S8分子中S-S键的断裂和重新键合[15, 16]。目前研究的锂硫电池正极材料大多是将硫与多孔碳材料、碳纳米管、石墨烯、金属氧化物、导电聚合物等复合所得,负极材料采用锂片。其正负极结构和充放电过程如图1所示。锂硫电池充放电的反应方程式如式1-1、1-2所示:
正极: S8+ 16Li++ 16e-= 8Li2S
(1-1)
负极: 16Li = 16Li++ 16e-
(1-2)
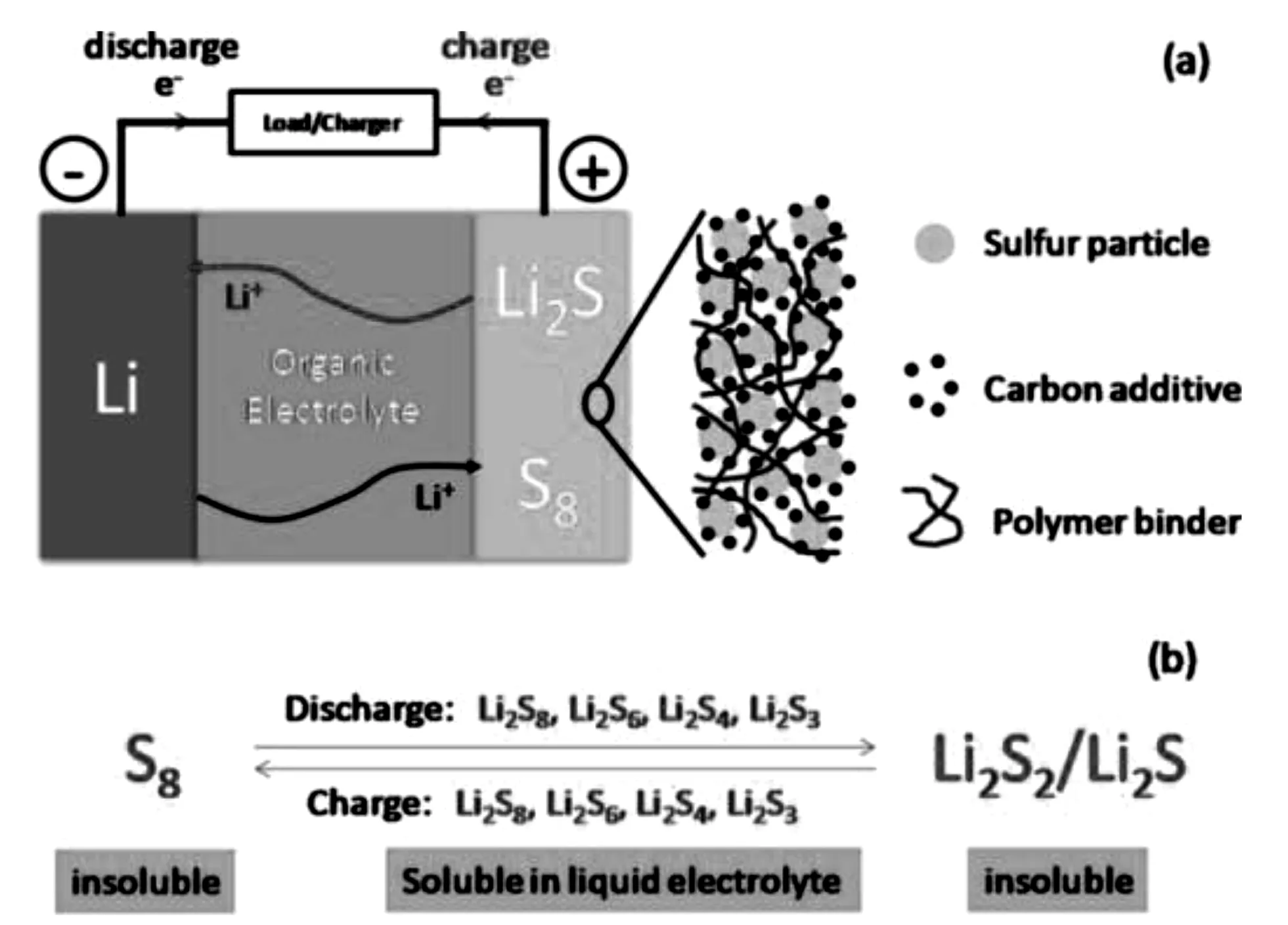
图1 锂硫电池正负极结构及充放电反应示意图[17]Fig.1 Comparison of reaction for charging and discharging and structure of anode and cathode of lithium-sulphur battery[17]
放电时,正极的硫经过多步反应逐步还原为Li2S。在还原过程中会有诸多中间产物生成,如Li2S8,Li2S6,Li2S4等。这些中间产物在反应过程中会溶解到锂硫电池的醚类电解液当中。在正极反应中,一个硫原子还原得到两个电子,根据硫的相对原子质量可以计算出其理论比容量为1673mAh·g-1。锂硫电池的电解质多采用双三氟甲烷磺酰亚胺锂(LiTFSI)为锂盐,DOL/DME为溶剂,并在其中加入1 wt%的硝酸锂来抑制飞梭效应。锂硫电池充放电曲线及过程产物如图2所示[18]。众多关于锂硫电池的研究认为,为了使放电过程中产生的Li2S2和Li2S固体均匀分散在电极中,使得更多的硫能够参与反应,理想的正极材料需要在充放电过程中保持结构的稳定性。
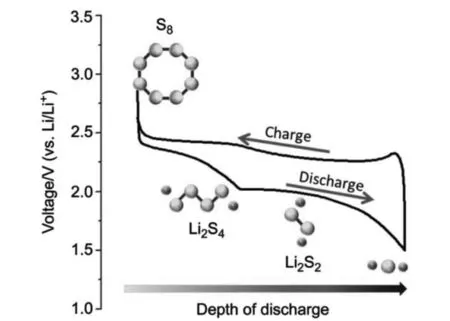
图2 锂硫电池充放电曲线及充放电过程中的产物[18]Fig.2 Curve of charging and discharging for lithium-sulphur battery and production[18]
2.2 锂硫电池存在的主要问题
锂硫电池较高的理论比容量是基于锂金属和硫单质之间复杂的氧化还原反应而来,其中间产物包括多种聚硫化锂 (Li2Sn, n=2~8)化合物。锂硫电池目前面临着几类重大的挑战:(1)硫作为锂硫电池的正极材料导电性很差,需添加其他材料增强导电性;(2)锂硫电池中硫的利用率较低,并且循环性能差;(3)正极材料完全放电后的产物是Li2S,会引起正极很大的体积变化;(4)充放电过程中的中间产物Li2Sn会溶解在电解液当中并且穿透隔膜造成穿梭效应,降低了库伦效率。
硫单质在室温条件下是绝缘体,其电导率仅为 5×10-30S·cm-1。除此之外,正极材料的最终产物硫化锂在室温下同样是绝缘体,其电导率为 10-14S·cm-1[19]。导电性能差的硫和硫化锂会增加正极材料从集流体上得失电子的难度,降低利用率及倍率性能。为了解决硫正极导电性差的问题,在材料制备时需要添加导电剂。一般采用乙炔黑、科琴黑等[20]。这些导电剂和活性物质充分接触后,可以缩短电子和离子的扩散路径。在电池的充放电过程中,硫化锂会沉积在正极材料的表面,增加电池的极化。在大倍率充放电循环过程中,电池的电压会迅速下降,使正极的硫无法完全反应转化为硫化锂,降低电池的比容量[21]。
在锂硫电池充放电时,会产生中间产物多硫化锂Li2Sn,而锂硫电池采用的电解液为DOL/DME体系,多硫化锂会溶解在电解液当中[22],穿透隔膜到达负极并且与负极的锂发生反应。这种反应被称为“飞梭效应”。一方面飞梭效应会减少正极材料活性物质,降低电池容量,增加自放电的同时降低库伦效率;另一方面在负极产生难溶于电解液的硫化锂,腐蚀钝化负极表面。飞梭效应是影响锂硫电池容量衰减、循环性能差的最主要因素[23]。
硫单质在室温下的密度是2.07g·cm-3,而锂硫电池放电的最终产物硫化锂的密度是 1.66g·cm-3,且由于放电过程中正极材料的质量是不断增加的,导致正极材料在完全放电后体积膨胀约为76 %。在长时间的充放电循环过程中,正极不断地收缩膨胀会导致电极结构坍塌,降低循环寿命[24]。
3 碳硫复合材料制备锂硫电池的研究进展
在研究锂硫电池正极材料中发现,使用碳材料作为单质硫的载体来提高锂硫电池的导电性能和循环性能的方法最多。因为单质硫的熔点仅有115.2 ℃,沸点仅为444.6 ℃,较低的熔点与沸点使气相沉积和热处理方法无法在制备碳/硫复合正极材料中使用[25],因此制备碳/硫复合材料的主要方法是将硫与碳材料混合均匀,在保护气氛中加热到155 ℃,此时硫呈现出熔融的液态且粘度最低,因此可以浸入到碳材料的孔隙当中,这种方法称为熔融扩散法[26]。其中碳材料的微孔具有毛细管作用,可以使硫与中间产物多硫化锂被电极吸附,有利于两者的固定。目前应用较广的碳材料有介孔碳、多孔碳球、碳纳米管、石墨烯等[27]。
3.1 介孔碳/硫复合材料
介孔碳材料是一种常见的非硅基的介孔材料,孔径范围在2nm~50nm之间。介孔碳材料有巨大的比表面积和孔容,因此在催化剂载体、电极材料、储氢方面应用广泛。与传统的介孔硅相比,介孔碳的孔形状更为多样,孔道结构可调整。介孔碳还具有很高的稳定性,且合成简单容易操作。在近十年来,很多研究者详细研究了介孔碳的孔径、孔容、载硫量、对碳表面进行修饰等对锂硫电池性能的影响。利用介孔碳比表面积和孔容大的优势,成功地将硫与介孔碳材料复合制备成正极材料,并获得了不错的效果。
2009年加拿大Nazar小组[28]首次成功地将有序介孔碳材料CMK-3作为载硫基体的碳材料,如图3所示。这种介孔碳材料的结构非常规则,其中的碳棒非常有序地排列。碳棒的直径和间隙宽度均很小,分别为6.5nm和3nm。除此之外每个碳棒之间还有更小的碳纳米棒将其连接起来,增加了介孔碳CMK-3的结构稳定性。正是由于介孔碳CMK-3结构规则性,因此在与硫复合的过程中熔融的硫能够更好地浸入到介孔碳的孔隙当中。通过这种方法得到的碳/硫复合材料载硫量达到70wt%。他们还将介孔碳/硫复合材料外包覆一层聚乙二醇以提升复合材料的电化学性能。测试的结果显示经包覆聚乙二醇之后材料的首次比容量和循环性能得到了很大的提高。

图3 CMK-3结构示意图[28] Fig.3 The structure diagram of CMK-3[28]
2011年Li等[29]采用了四种不同孔径的介孔碳材料(22nm,12nm,7nm和3nm)作为硫载体。实验表明介孔碳的孔径、孔容越大,其正极材料的含硫量就越高。孔容大小不一的四种介孔碳载满硫之后,发现性能差别不大。当介孔碳材料并没有全部载满硫而是留有相对空间时,就可以解决正极材料放电过程中的体积膨胀问题。并且通过在外层包覆高分子导电聚合物(如PEDOT、PSS)可以有效地抑制多硫化锂过多地溶解在电解液中的问题。
He[30]等使用软模板法,使用三嵌段共聚物F127作为模板制备介孔碳材料,成功制备出新型介孔碳BMC-1。该介孔碳具有双峰孔径分布,其孔径的峰分别在2nm出和5.6nm处,比表面积可以达到2300m2·g-1,孔容可以达到2cm3·g-1。将介孔碳BMC-1与硫按质量比1∶1复合后,在1C的充放电倍率下首次放电容量995mAh·g-1,100次循环后比容量依然保持在550mAh·g-1。
2014年Li[31]等利用硅溶胶中的二氧化硅作为模板,淀粉作为碳源,通过溶胶凝胶法成功地制备了生物质碳源介孔碳。该介孔碳具有很高的比表面积(949.85m2·g-1)和极大的孔容(3.14cm3·g-1)。其制备过程如图4所示。将该材料与单质硫复合之后可以得到含硫量为81.29wt%的介孔碳/硫复合材料。将这种介孔碳/硫材料制备锂硫电池,可以得到非常良好的电化学性能,其中0.5C倍率下其初始比容量达到了922mAh·g-1,循环100圈之后比容量高达683mAh·g-1。在1C的充放电倍率下循环300圈之后比容量依然剩余483mAh·g-1。
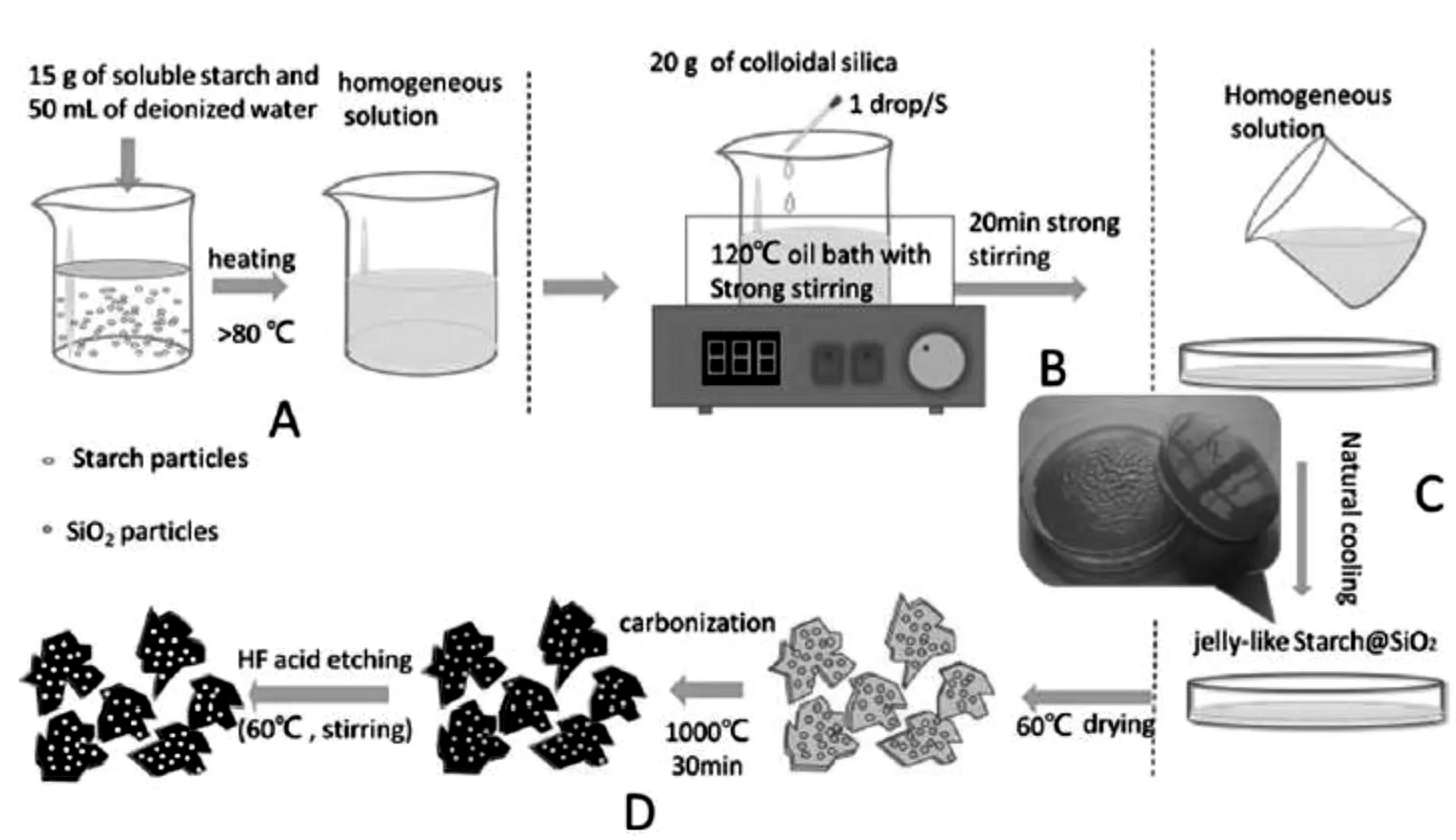
图4 生物质碳源介孔碳的制备过程[31]Fig.4 Preparation process of biomass carbon source Ordered mesoporous carbons[31]
3.2 多孔碳球/硫复合材料
在锂硫电池的充放电过程中,正极材料的体积膨胀与是锂硫电池面临的一个重要问题。为了解决这一问题,研究者们开始研究将空心的多孔碳球与单质硫复合制备复合材料。Jayaprakash[32]制备了具有中空结构的多孔碳球,其除了可以提高载硫量之外,还可以为正极材料在放电过程中的体积膨胀提供空间。多孔碳球壁上具有孔径为3nm的孔隙,在一定程度上避免了多硫化锂在电解液中过多的溶解,同时还可以作为离子通道。将空心的多孔碳球与硫复合,得到了载硫量为69.75 wt%的多孔碳球/硫复合材料。当正极的极片面密度为3mg·cm-2时,在0.5C的充放电倍率下,电池首圈充放电比容量达到 1071 mAh·g-1。100圈循环之后放电比容量仍然剩余有974mAh·g-1,达到初始比容量的91 %。在3C的高充放电倍率下,首圈放电比容量仍然高达450mAh·g-1。
Zhang等[33]利用正硅酸乙酯的水解得到粒径为纳米级别的二氧化硅颗粒,使用酚醛树脂作为碳源,制备了中空多孔碳球。将此多孔碳球与硫复合之后,得到含硫量为50.2wt%的多孔碳球/硫复合物。此种材料电化学性能良好,在0.05C倍率下充放电其初始比容量可以达到1450mAh·g-1,在循环50次之后比容量依然剩余由1357mAh·g-1。在0.5C的倍率下循环30次之后比容量剩余800mAh·g-1。
3.3 碳纳米管/硫复合材料
由于碳纳米管具有中空结构,其中的电子和离子具有较短的传输路径,因此可以通过升华硫与碳纳米管复合制备正极材料[34-36]。Zheng等[34]通过采用阳极氧化铝作为模板,制备出了空心碳纤维管材料。碳纤维管的长度约为200nm。碳纤维管负载硫之后,可以增强碳/硫导电性能,即使不用集流体和粘结剂,也可以在锂硫电池中正常使用。
2012年Xin等[35]进行了在多壁碳纳米管(MWCNTs)负载一层孔径约为0.5nm的微孔碳(MPC)的研究。因为单质硫的S8分子较大,无法进入到微孔当中,因此其微孔中容纳的硫不是环形的S8分子,而是硫的小分子Sn(n = 2~4)。因为微孔对于充放电过程中具有限制作用,因此这种材料在充放电的过程放电平台较低,约为1.9V。虽然电压有所下降,但是这种材料具有非常良好的循环和倍率性能,并且可以使用1M LiPF6/(EC/DMC)体系的电解液。在0.1C的充放电倍率下,锂硫电池的首次放电比容量高达1670 mAh·g-1,在经过200次循环后,比容量依然保持有1149mAh·g-1。在大倍率 5C的充放电倍率下,经过200次循环后比容量仍然保持有800mAh·g-1。
Chen等[36]制备出一种新型的多壁碳纳米管/硫复合正极材料。先将硫与MWCNTs混合均匀,通过在155 ℃时加热的方法在MWCNTs外面沉积一层厚度为10nm~20nm的硫,之后将样品球磨,使得此复合材料成为一种具有相互编织结构的多孔碳球。此种材料制备的电池在300mA·g-1的电流密度下循环100圈后放电比容量剩余有1000mAh·g-1。在电流密度增大至1000mA·g-1时,循环200圈后的放电比容量依然剩余有650mAh·g-1。因此可以看出将这种复合材料具有良好的循环和倍率性能。
3.4 石墨烯/硫复合材料
石墨烯是一种具有特殊二维纳米结构的单层石墨材料。由于石墨烯具有非常良好的导电性以及极大的比表面积,因此被广泛地应用于储能材料当中,在锂硫电池中的应用也颇为常见。
具有二维纳米结构的石墨烯,可以制备石墨烯包覆的材料。Wang等[37]通过使用表面活性剂Triton X-100,成功地用过硫酸钠与盐酸反应制备出经过PEG修饰的微米硫。然后将氧化石墨烯用炭黑修饰之后包覆在微米硫颗粒上,制备出氧化石墨烯包覆微米硫颗粒的复合材料。外层包覆修饰的氧化石墨烯和PEG不但可以缓冲充放电过程的体积膨胀,还可以阻止多硫化锂在电解液中的溶解和扩散。使用这种复合材料制备的材料在0.5C充放电倍率下经过100圈循环比容量剩余600mAh·g-1,其中后90个循环容量损耗仅为13%。Wang等[38]通过水热法制备了具有氮掺杂的3D石墨烯,其中氮来源于反应中的氨水。这种氮掺杂3D石墨烯具有三维多孔结构。将其与单质硫复合,可以得到含硫量为87.6wt%的石墨烯/硫复合材料。此种三维结构具有良好的电子和离子传导性,电化学性能优异,能缓解充放电过程中的体积膨胀。在充放电测试中,该复合材料在 600mA·g-1电流密度下循环145圈容量依然剩余有800mAh·g-1,可以看出其具有非常好的循环性能。
Rong等[39]发现由于氧化石墨烯上正负电荷相互吸引,因此在离子型溶液中会自主收缩。利用这一特点,他们制备出核壳结构的石墨烯/硫复合材料。其中包覆层的厚度可以通过调节氧化石墨烯的浓度来控制,并且可以通过这种方法来调节硫的含量。当使用载硫量为50wt%的石墨烯/硫复合材料作为正极时,在充放电过程中循环1000圈之后比容量剩余800mAh·g-1,平均每个循环的容量衰减率仅为0.02%,循环性能良好。
Li等[40]使用加热的方法,将石墨烯浸入到熔融的硫当中,得到石墨烯/硫复合材料。之后再用氧化石墨烯对这种复合材料进行包覆,得到载硫量为 63wt%的复合材料。此种材料倍率性能优异。在充放电测试过程中,在200mA·g-1电流密度下,电池首圈放电比容量达到1290mAh g-1,100圈循环后比容量仍然剩余928mAh·g-1。在 1600mAh·g-1电流密度下,200次循环后比容量保持在 667mAh g-1。
4 结论
本篇文章调查了锂硫电池正极材料最新的研究进展。为了解决锂硫电池的诸多问题,研究者们采用了很多策略,其中将硫与碳材料复合成为了一种行之有效的方法。使用各种碳材料作为单质硫载体可以提高碳/硫材料导电性能和循环性能。碳材料中的微孔具有毛细管作用,可使活性物质硫与中间产物多硫化锂被电极吸附,有利于两者的固定。经过不断地探究,碳硫纳米复合材料的比容量和充放电倍率有了很大提升。
锂硫电池在过去十年实现了重大改进,但挑战仍然存在。锂硫电池依然面临电导率低、锂离子扩散性差、硫化锂难以激活、循环性能差等问题。除此之外,关于锂硫电池的研究是基于连续充放电测试得到的结果,与实际的间歇性循环工作模式不同,因此还缺乏关于锂硫电池实际应用方面的数据。且在锂硫电池的制备中,负极采用金属锂,因而在充放电过程中不可避免会产生锂枝晶从而增加安全风险。因此,关于锂硫电池的研究工作仍需继续,逐步解决其所面临的诸多挑战,才能使得锂硫电池得到实际应用及大面积推广。
[1] 李伟, 姚岑, 吴兴隆, 等. 高比能锂-硫电池研究进展[J]. 分子科学学报, 2013, 29(6): 448-460.
[2] Barchasz C, Leptrtre J, Alloin F, et al. New Insights Into the Limiting Parameters of the Li/S Rechargeable Cell[J]. Journal of Power Sources, 2012, 199: 322-330.
[3] Guo C, Li C. A Self-Assembled Hierarchical Nanostructure Comprising Carbon Spheres and Graphene Nanosheets for Enhanced Supercapacitor Performance[J]. Energy & Environmental Science, 2011,4(11): 4504-4507.
[4] Lee J, Zhao Y, Thieme S, et al. Sulfur-Infiltrated Micro- and Mesoporous Silicon Carbide-Derived Carbon Cathode for High-Performance Lithium Sulfur Batteries[J]. Advanced Materials, 2013, 25: 4573-4579.
[5] Cao Y, Li X, Aksay I, et al. Sandwich-Type Functionalized Graphene Sheet-Sulfur Nanocomposite for Rechargeable Lithium Batteries[J]. Physical Chemistry Chemical Physics, 2011, 13(17): 7660-7665.
[6] Huang J, Liu X, Zhang Q, et al. Entrapment of Sulfur in Hierarchical Porous Graphene for Lithium-Sulfur Batteries with High Rate Performance from -40℃ to 60℃[J]. Nano Energy, 2013, 2(2): 314-321.
[7] Huang C, Xiao J, Shao Y, et al. Manipulating Surface Reactions in Lithium-Sulfur Batteries Using Hybrid Anode Structures[J]. Nature Communications, 2014,5: 3015-3021.
[8] Wang J, Yang J, Xie J, et al. Sulfur-Carbon Nano-Composite as Cathode for Rechargeable Lithium Battery Based on Gel Electrolyte[J]. Electrochemistry Communications, 2002, 4(6): 499-502.
[9] Yan Y, Yin X, Xin S, et al. High-Safety Lithium-Sulfur Battery with Prelithiated Si/C Anode and Ionic Liquid Electrolyte. Electrochimica Acta, 2013, 91: 58-61.
[10] Sun F, Wang J, Chen H, et al. Bottom-Up Catalytic Approach Towards Nitrogen-Enriched Mesoporous Carbons/Sulfur Composites for Superior Li-S Cathodes[J]. Scientific Reports, 2013, 2328: 16199-16207.
[11] Song M, Cairns E, Zhang Y. Lithium/Sulfur Batteries with High Specific Energy: Old Challenges and New Opportunities[J]. Nanoscale, 2013, 5: 2186-2204.
[12] Lin Z, Liu Z, Fu W, et al. Phosphorous Pentasulfide as a Novel Additive for High-Performance Lithium-Sulfur Batteries[J]. Advanced Functional Materials, 2013, 23(8): 1064-1069.
[13] Yang Z, Guo J, Das S, et al. In Situ Synthesis of Lithium Sulfide-Carbon Composites as Cathode Materials for Rechargeable Lithium Batteries[J]. Journal of Materials Chemistry A, 2013, 1(4): 1433-1440.
[14] Yin Y, Xin S, Guo Y, et al. Lithium-Sulfur Batteries: Electrochemistry, Materials, and Prospects[J]. Angewandte Chemie International Edition, 2013, 52: 2-18.
[15] 张会平, 叶李艺, 杨立春. 氯化锌活化法制备木质活性炭研究[J]. 材料科学与工艺, 2006, 14(1): 42-45.
[16] 胡玥, 刘彦军. 导电高分子聚噻吩及其衍生物的研究进展[J]. 材料导报, 2006, 20(1): 64-68.
[17] Manthiram A, Fu Y, Su Y S. Challenges and prospects of lithium-sulfur batteries[J]. Accounts of Chemical Research, 2013, 46(5): 1125-1134.
[18] Yang Y, Zheng G, Misra S, et al. High-Capacity Micrometer-Sized Li2S Particles as Cathode Materials for Advanced Rechargeable Lithium-Ion Batteries[J]. Journal of the American Chemical Society, 2012, 134(37): 15387-15394.
[19] Ryu H, Ahn H, Kim K, et al. Self-Discharge Characteristics of Lithium/Sulfur Batteries Using TEG/DME Liquid Electrolyte[J]. Electrochimica Acta, 2006, 52(4): 1563-1566.
[20] Li X, Cao Y, Qi W, et al. Optimization of Mesoporous Carbon Strctures for Lithium-Sulfur Battery Applicati-ons[J]. Journal of Materials Chemistry, 2011, 4(8):2878-2883.
[21] Liang C, Dudney N, Howe J. Hierarchically Structured Sulfur/Carbon Nanocomposite Material for HighEner-gy Lithium Battery[J]. Chemistry of Materials, 2009, 21(19): 4724-4730.
[22] Zhang C, Wu H, Yuan C, et al. Confining Sulfur in Double-Shelled Hollow Carbon Spheres for Lithium-Sulfur Batteries[J]. Angewandte Chemie International Edition, 2012, 51(38):9592-9595.
[23] Chen J, Zhang Q, Shi Y, et al. A Hierarchical Architecture S/Mwcnt Nanomicrosphere with Large Pores for Lithium Sulfur Batteries[J]. Physical Chemistry Chemical Physics, 2012, 14(16): 5376-5382.
[24] Xiao Z, Yang Z, Nie H, et al. Porous carbon nanotubes etched by water steam for high-rate large-capacity lithium-sulfur batteries[J]. Journal of Materials Chemistry A, 2014, 2(23): 8683-8689.
[25] Jin K, Zhou X, Zhang L, et al. Sulfur/Carbon Nanotube Composite Film as a Flexible Cathode for Lithium-Sulfur Batteries[J]. Journal of Physical Chemistry C, 2013, 117(41): 21112-21119.
[26] Diao Y, Xie K, Xiong S, et al. Analysis of Polysulfide Dissolved in Electrolyte in Discharge-Charge Process of Li-S Battery[J]. Journal of the Electrochemical Society, 2012, 159(4): A421-A425.
[27] Huang J, Zhang Q, Peng H, et al. Ionic Shield for Polysulfides towards Highly-Stable Lithium-Sulfur Batteries[J]. Energy & Environmental Science, 2014, 7(1): 347-353.
[28] Ji X, Lee K, Nazar L. A Highly Ordered Nanostructured Carbon-Sulphur Cathode for Lithium-Sulphur Batteries[J]. Nature Materials, 2009, 8: 500-506.
[29] Li X, Cao Y, Qi W, et al. Optimization of Mesoporous Carbon Structures for Lithium-Sulfur Battery Applications[J]. Journal of Materials Chemistry, 2011, 21(41): 16603-16610.
[30] He G, Ji X, Nazar L. High C Rate Li-S Cathodes: Sulfur Imbibed Bimodal Porous Carbons[J]. Energy Environmental Science, 2011, 4(8): 2878-2883.
[31] Li J, Qin F, Zhang L, et al. Mesoporous Carbon from Biomass: One-Pot Synthesis and Application for Li-S Batteries[J]. Journal of Materials Chemistry A, 2014, 2: 13916-13922.
[32] Jayaprakash N, Shen J, Moganty S, et al. Porous Hollow Carbon@Sulfur Composites for High-Power Lithium-Sulfur Batteries[J]. Angewandte Chemie International Edition, 2011, 123: 6026-6030.
[33] Zhang K, Zhao Q, Tao X, et al. Composite of Sulfur Impregnated in Porous Hollow Carbon Spheres as the Cathode of Li-S Batteries with High Performance[J]. Nano Research, 2013, 6(1): 38-46.
[34] Zheng G, Yang Y, Cha J, et al. Hollow Carbon Nanofiber-Encapsulated Sulfur Cathodes for High Specific Capacity Rechargeable Lithium Batteries[J]. Nano Letters 2011, 11(10): 4462-4467.
[35] Xin S, Gu L, Zhao N H, et al. Smaller Sulfur Molecules Promise Better Lithium-Sulfur Batteries[J]. Journal of the American Chemical Society, 2012, 134(45): 18510-18513.
[36] Wu F, Magasinski A, Yushin G. Nanoporous Li2S and MWCNT-Linked Li2S Powder Cathodes for Lithium-Sulfur and Lithium-Ion Battery Chemistries[J]. Journal of Materials Chemistry A, 2014, 2(17): 6064-6070.
[37] Wang H, Yang Y, Liang J, et al. Graphene-Wrapped Sulfur Particles as a Rechargeable Lithium-Sulfur Battery Cathode Material with High Capacity and Cycling Stability[J]. Nano Letters, 2011, 11(7): 2644-2647.
[38] Wang C, Su K, Wan W, et al. High Sulfur Loading Composite Wrapped by 3D Nitrogen-Doped Grapheme as a Cathode Material for Lithium-Sulfur Batteries[J]. Journal of Materials Chemistry A, 2014, 2(14): 5018-5023.
[39] Rong J, Ge M, Fang X, et al. Solution Ionic Strength Engineering as a Generic Strategy to Coat Grapheme Oxide (GO) on Various Functional Particles and Its Application in High-Performance Lithium Sulfur Batteries[J]. Nano Letters, 2013, 14(2): 473-479.
[40] Li N, Zheng M, Lu H, et al. High-rate lithium-sulfur batteries promoted by reduced graphene oxide coating.[J]. Chemical Communications, 2012, 48(34):4106-4108.

