大鲵皮明胶提取及其性质分析
金文刚,陈德经,耿敬章,裴金金
1(陕西理工大学 生物科学与工程学院,陕西省资源生物重点实验室,陕西 汉中,723000)2(大连工业大学 国家海洋食品工程技术研究中心,辽宁 大连, 116034)3(陕西理工大学 大鲵研究所,陕西 汉中,723000)
大鲵皮明胶提取及其性质分析
金文刚1,2,3*,陈德经1,3,耿敬章1,裴金金1
1(陕西理工大学 生物科学与工程学院,陕西省资源生物重点实验室,陕西 汉中,723000)2(大连工业大学 国家海洋食品工程技术研究中心,辽宁 大连, 116034)3(陕西理工大学 大鲵研究所,陕西 汉中,723000)
为有效利用大鲵加工副产物鲵皮,研究了从鲵皮中提取明胶的工艺条件及其部分性质。鲵皮经碱酸预处理后,以提取率为指标,通过单因素试验和正交试验优化了明胶提取的工艺参数。结果表明:鲵皮明胶最适提取条件为温度60 ℃,超声功率400 W、提取时间7 h,料液比1∶9(g∶mL),明胶提取率可达13.76%。鲵皮明胶中甘氨酸、脯氨酸、谷氨酸和丙氨酸含量相对较高,约占总氨基酸的50%,该明胶在234 nm 处有最大紫外吸收,黏度为3.3 mPa·s,凝冻强度Bloom值为216 g。
大鲵;明胶;紫外光谱;凝冻强度; 氨基酸
大鲵俗称娃娃鱼,是世界上现存最大的两栖动物,被列入我国二级水生野生保护动物名录[1]。大鲵是一种食用和药用价值极高的动物,不但肉质细嫩、味道鲜美、营养价值高,而且肌肉、内脏、骨骼、表皮及分泌物均可入药[2]。近年来大鲵人工养殖已经实现产业化,子二代大鲵数量和产量在我国贵州、湖北、陕西、湖南、广西、四川等地形成了一定规模,在部分地区已发展成为一项新兴产业,在促进产区农民增收等方面发挥了重要作用。2015年6月,农业部发布的《养殖大鲵及其标识技术规程》正式实施,标志着国家许可养殖大鲵进行出售、开发利用和进入市场领域。
随着大鲵资源深加工及开发利用日益受到关注,相关的研究报道越来越多。如,王立新等[3]对大鲵肌肉、尾脂常规营养成分、氨基酸组成和脂肪酸组成进行分析,李莉等[4]分析了大鲵肌肉和鲵皮营养成分,研究表明大鲵肉、尾脂和鲵皮具有较高的营养价值;胡云峰等[5]研究了不同比例气体成分对气调小包装冷鲜大鲵分割肉品质的影响,发现10% O2+70% CO2+20% N2比例的气体成分保鲜效果最好,能有效延缓大鲵肉的色泽下降及汁液流失率与挥发性盐基氮含量的升高,抑制微生物的生长繁殖,使大鲵肉保持较好的感官品质;陈曦等[6]研究了大鲵皮肤黏液药膏对大鼠皮肤烫伤的治疗作用,发现该药膏具有促进大鼠烫伤创面愈合的效果。王立锋等[7]从大鲵皮肤分泌物中分离纯化到一个具有较强阳离子特征的碱性肽,对革兰氏阴性菌、阳性菌和真菌均具有较强的抗菌活性;GUO等[8]和KONG等[9]从大鲵皮肤腺分泌物中分离到了生理活性物质(包括活性肽、糖肽等),徐伟良等[10]从大鲵皮肤黏液提取纯化了糖蛋白,发现该糖蛋白对人肺癌细胞A549具有明显的抑制作用;鲍九枝和余可锋以大鲵肉为原料,采用酶法制备了大鲵肉活性肽,并开发了运动饮料[11]。
明胶是一种通过胶原蛋白热变性、部分水解获得的高分子质量水溶性蛋白,被广泛应用于改善食品结构、提高食品保水性和稳定性[12]。明胶作为胶原的衍生产物,主要从动物的结缔组织或表皮组织中的胶原经变性转化,再经适当温度提取出来的水溶性物质,它的主要结构与胶原相近。通常人们都是使用猪、牛、的皮和骨提取胶原蛋白和明胶。但随着疯牛病、口蹄疫和禽流感等畜禽疾病的爆发,人们对陆生动物胶原制品的安全性产生质疑。另外,由于宗教和习俗等原因,有些人群对畜禽胶原蛋白制品存在禁忌[13],水产动物源明胶制品被认为是较为安全的来源之一。
大鲵皮肤厚实,胶质含量丰富,是胶原蛋白及明胶的理想来源。李莉等[14]通过响应面优化了酶法提取大鲵皮胶原蛋白的工艺条件;顾赛麒等[15]分别提取了大鲵皮酸溶性胶原蛋白和酶溶性胶原蛋白,并对其各项理化性质进行了研究,得出大鲵皮胶原蛋白为I型胶原蛋白;李林格等[16]以木瓜蛋白酶水解大鲵皮酶溶性胶原蛋白,制备了大鲵皮胶原蛋白肽,发现该肽具有保护乙醇诱导小鼠肝损伤的作用。然而从大鲵皮中提取明胶的研究尚未见报道。为此,本文以养殖大鲵加工副产物鲵皮为原料,经预处理后利用超声波辅助热水浸提明胶,以提取率为评价指标,在单因素试验基础上,采用正交试验优化明胶提取工艺参数,并分析鲵皮明胶的部分理化性质,为其后续应用研究提供依据。
1 材料与方法
1.1 原料与试剂
试验原料:养殖大鲵,购自汉中市龙头山水产养殖开发有限公司养殖基地。大鲵宰杀后运回实验室,剥下鲵皮,去除皮上的残肉,冲洗干净,剪成0.5 cm×0.5 cm小片,沥干,置于聚乙烯袋后于-18 ℃冰箱中备用。
主要试剂:无水乙酸,NaOH,国药集团化学试剂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
KQ-500DE型台式数控超声波清洗器,昆山市超声仪器有限公司;LGJ-10B型冷冻干燥机,北京四环仪器有限公司;pHS-3C型精密pH计,上海雷磁仪器厂;LD4-2A型离心机,北京雷勃尔离心机有限公司;HWS-12型电热恒温水浴锅,上海一恒科学仪器有限公司; L-8900氨基酸自动分析仪,日立公司;紫外可见分光光度计,美国Thermo公司;SNB-2型数字式黏度计,上海精科天美仪器有限公司;CT3质构仪,美国Brookfield公司。
1.3 实验方法
1.3.1 鲵皮预处理
[17]中鱼皮预处理方法,略做调整。准确称取一定质量鲵皮,按照1∶10 (g∶mL)浸泡于0.05 mol/L NaOH溶液中,连续搅拌6 h,每隔2 h更换碱液,去除杂蛋白和色素,之后用流水洗至中性。然后将经碱处理过的鲵皮按照1∶10 (g∶mL)浸泡于0.1 mol/L乙酸,于4 ℃连续搅拌24 h,每隔12 h更换一次酸液,使鲵皮充分溶胀,酸处理后鲵皮在流水下洗至中性,用于明胶提取。
1.3.2 明胶提取
工艺流程:一定质量的预处理鲵皮,加去离子水于烧杯中,置于超声波清洗器热水浴中,提取一定的时间,过滤,收集滤液,4 000 r/min离心10 min,减压浓缩后冷冻干燥,得到白色物质,研磨后即得鲵皮明胶。
明胶提取率参照文献[18]进行计算:
(1)
1.3.3 单因素试验
准确称取一定质量预处理后的鲵皮,分别考察提取温度(40、50、60、70、80 ℃)、超声功率(100、200、300、400、 500 W)、时间(2、4、6、8、10 h)和料液比(1∶4、1∶6、1∶8、1∶10、1∶12)对明胶提取率的影响。
1.3.4 正交试验设计
根据单因素试验结果,以明胶提取率为指标,对提取温度、超声功率、提取时间和料液比4个因素设计L9(34)正交试验,各因素及水平见表1。

表1 正交试验因素水平表
1.3.5 鲵皮明胶紫外光谱
将提取到的明胶样品溶解于0.5 mol/L乙酸溶液中,配制成1 mg/mL的明胶溶液,用紫外分光光度计在200~400 nm 近紫外光区以120 nm/min的速度进行扫描。
1.3.6 鲵皮明胶氨基酸组成
准确称取一定量的明胶,置于水解管底部,缓慢加入5 mL的6 mol/L盐酸,抽真空,维持20 min后,在酒精喷灯上封口,110 ℃水解 24 h 后,蒸干盐酸,用去离子水稀释,定容到10 mL容量瓶中得水解液,采用氨基酸自动分析仪测定。
1.3.7 鲵皮明胶凝冻强度测定
按照AOAC明胶强度的标准测试方法,配制66.7 g/L的明胶溶液,65 ℃水浴加热20 min搅拌使之充分溶解,然后将样品转入冻力瓶中,室温冷却15 min,10 ℃冷却16 h,CT3质构仪测定其凝冻强度。质构仪参数设置如下:测试类型选择压缩,负载单元选择1 000 g,测试速度0.50 mm/s,返回速度0.50 mm/s,压缩距离4 mm,触发力4.5 g,探头选择TA10(圆柱形,直径12.7 mm,长35 mm),探头下压后最大负载即为凝冻强度Bloom值。
1.3.8 明胶的黏度
配制66.7 g/L的明胶,60 ℃水浴加热使之充分溶解,置于SNB-2型数字式黏度计转盘之下,采用1号转子,调转速为30 r/min,开动电机,待旋转平衡,读数显示稳定后读取黏度值。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取温度对明胶提取率的影响
固定超声功率300 W, 料液比1∶10和提取时间6 h,考察不同提取温度对明胶提取率的影响,结果见图1。
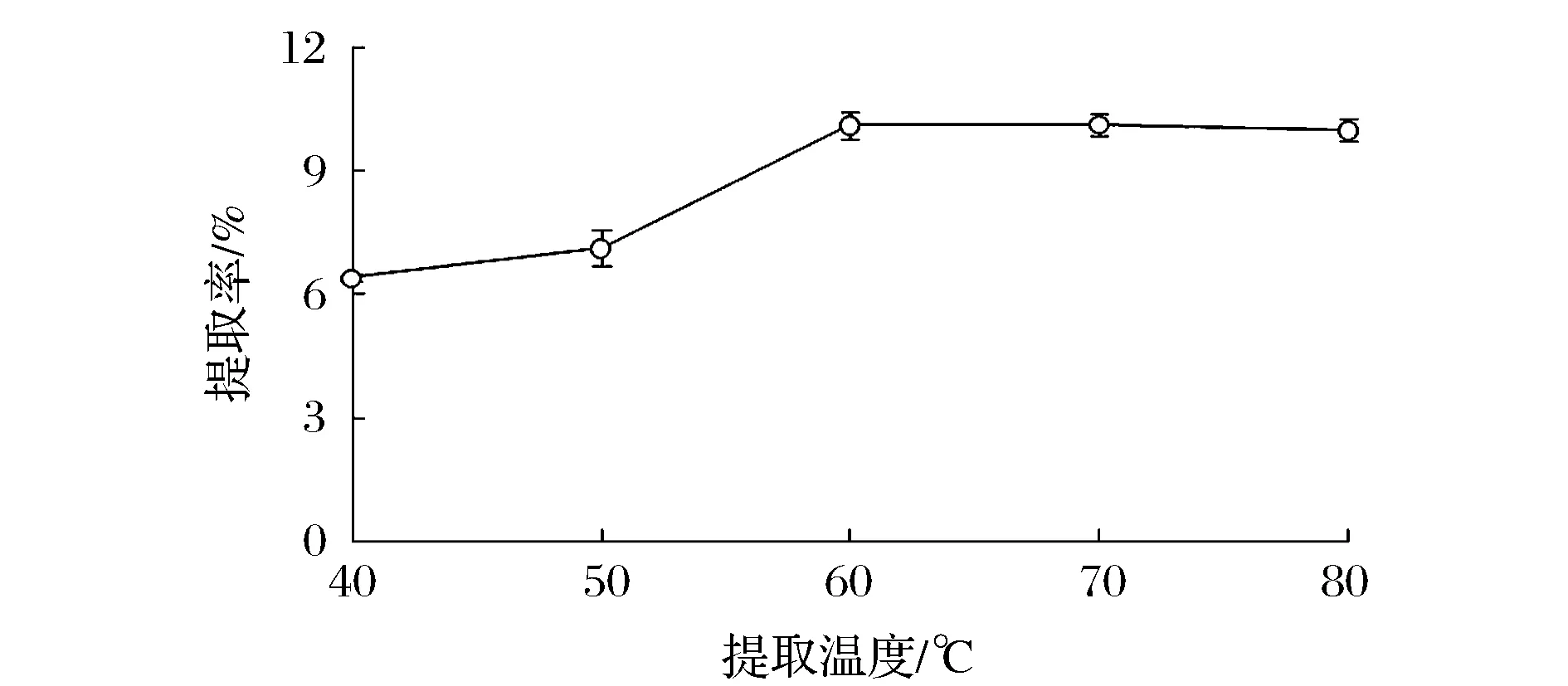
图1 提取温度对明胶提取率的影响Fig.1 Effect of temperature on yield of extracted gelatin
当鲵皮充分溶胀后,升高温度可以有效断裂胶原蛋白分子三螺旋结构区域的次级键,胶原蛋白发生一定程度的降解后,才能以明胶的形式溶于水中。升高温度可以加速胶原蛋白的降解,从而促进明胶的溶出。但是提取温度过高可引起明胶的次级水解,使明胶的黏度和凝胶强度下降[19]。由图1可看出,在40~60 ℃内,随着温度升高,明胶提取率逐渐增加,60 ℃明胶提取率最大,而60 ℃以后,明胶提取率趋于稳定。因此,选择60 ℃做为后续明胶提取温度。
2.1.2 超声功率对明胶提取率的影响
固定提取温度60 ℃, 料液比1∶10和提取时间6 h,考察不同超声功率对明胶提取率的影响,结果见图2。
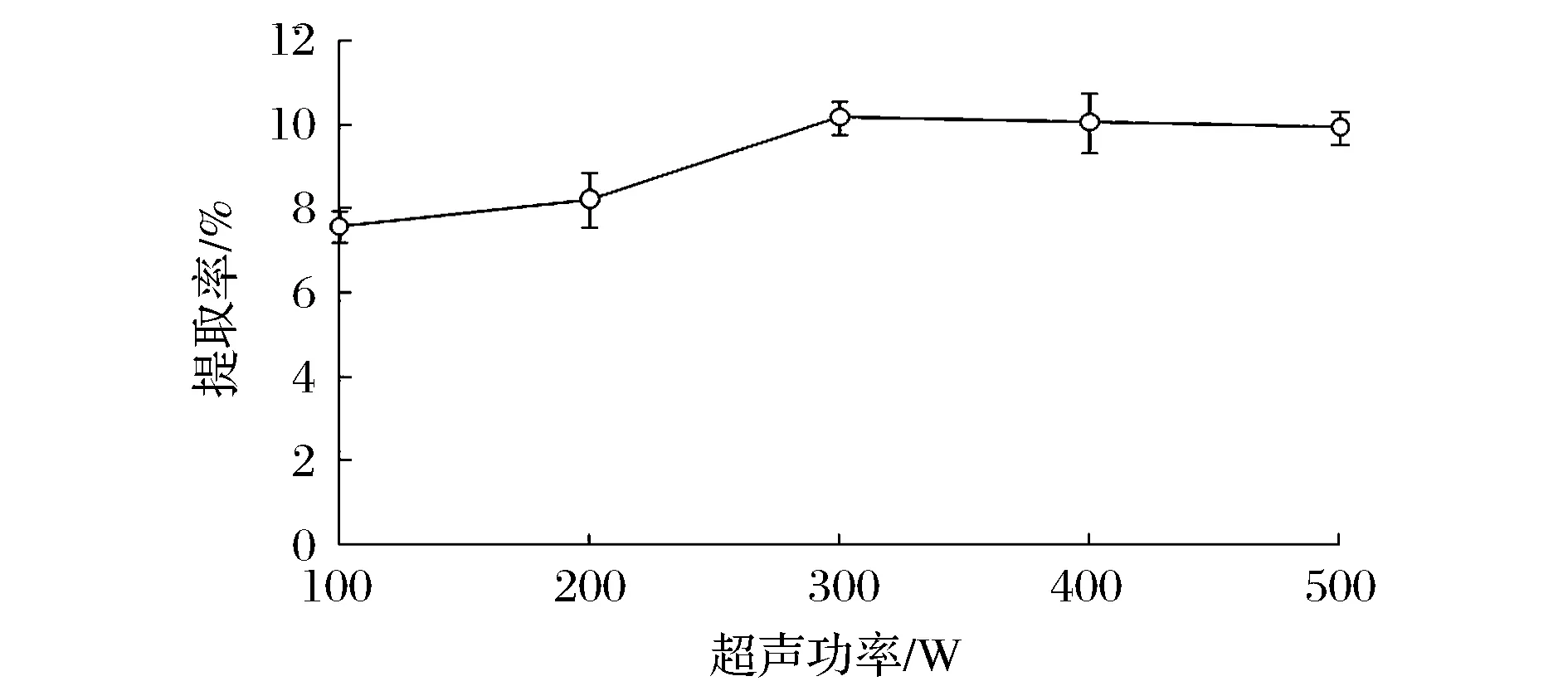
图2 超声功率对明胶提取率的影响Fig.2 Effect of ultrasonic power on yield of extracted gelatin
超声波具有机械和空化效应,有利于提取液中溶质的溶出。由图2可看出,在100~300 W内,随着超声功率的增加,明胶提取率逐渐增大,超声功率为300 W时提取率最大,可能由于超声波的机械和空化效应促使鲵皮中明胶更多的溶出;而超声功率为300 W以后,明胶提取率趋于稳定并略有下降。因此,选择300 W做为后续明胶提取的超声功率。
2.1.3 提取时间对明胶提取率的影响
固定超声功率300 W,提取温度60 ℃和料液比1∶10,考察不同提取时间对明胶提取率的影响,结果见图3。
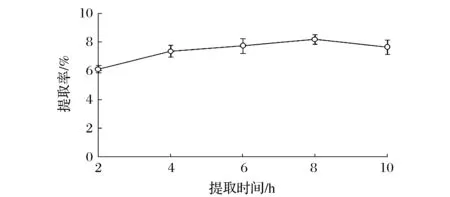
图3 提取时间对明胶提取率的影响Fig.3 Effect of time on yield of extracted gelatin
由图3可看出,在2~8 h内,随着提取时间的延长,明胶提取率逐渐增大。提取8 h时,明胶提取率最大,而8 h以后,明胶提取率略有下降,这与王珊珊等人在提取真鳕鱼骨明胶过程中,提取时间8 h前后的变化趋势一致[19]。本研究提取4 h后,尽管明胶提取率变化趋势较平缓,但是8 h时提取率最大,之后提取率略有下降。综合考虑,选择8 h做为后续明胶的提取时间。
2.1.4 料液比对明胶提取率的影响
固定提取时间8 h,超声功率300 W和提取温度60 ℃,考察不同料液比对明胶提取率的影响,结果见图4。

图4 料液比对明胶提取率的影响Fig.4 Effect of skin water ratio on yield of extracted gelatin
由图4可看出,随着料液比的增加,明胶提取率呈现先增加后趋于稳定的趋势。当料液比为1∶8时,明胶提取率最大,表明提取溶剂的量增加可以提高提取液中明胶的浓度,有利于鲵皮中明胶的溶出,但是使用过多的提取溶剂会造成后续浓缩干燥过程中能耗的增加,不利于实际生产[20]。因此,选择1∶8做为后续明胶提取的适宜料液比。
2.2 正交试验结果
在单因素试验基础上,以明胶提取率为指标,对提取温度、超声功率、提取时间和料液比4个因素设计L9(34)正交试验,结果见表2。
由表2正交试验极差分析结果可知,影响大鲵皮明胶提取率的各因素主次关系为超声功率B>提取温度A>料液比D>提取时间C。超声功率对明胶得率影响最显著,提取时间对明胶得率影响相对最小。从各因素各水平下,提取率的均值K可获知,鲵皮明胶提取的最佳组合为A2B3C1D3,即提取温度60 ℃,超声功率400W,提取时间7h,料液比1∶9。在此优化工艺条件下提取明胶,最终提取率为13.76%。KTARI等[18]提取的斑马鲶鱼皮明胶,提取率为14.8%,较本文提取的鲵皮明胶提取率高一些,可能是原料特性或者预处理条件造成的,今后可通过其他手段如酶法进一步提高明胶得率。
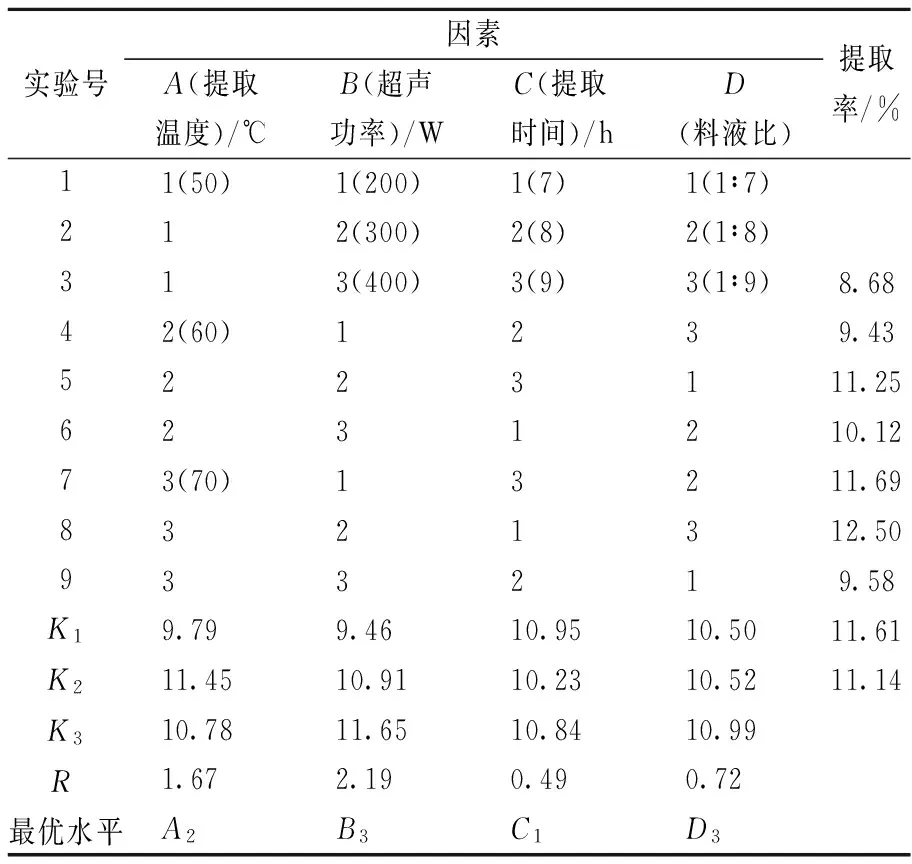
表2 正交试验结果表
2.3 鲵皮明胶的紫外吸收光谱
通常蛋白质在280 nm 处有较强的紫外吸收,因为蛋白分子中含有能吸收一定紫外波长光的紫外生色基团,例如苯丙氨酸、色氨酸、酪氨酸等芳香族氨基酸。由图5 可见,本研究提取的鲵皮明胶,最大吸收波长为234 nm,符合明胶的特征吸收波长范围,主要是电子的N→л*和N→σ*跃迁所产生[19]。
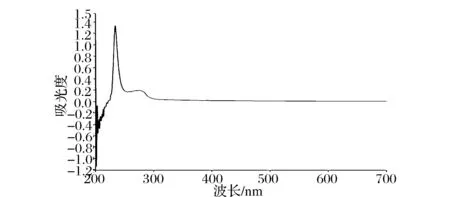
图5 鲵皮明胶的紫外吸收光谱Fig.5 UV spectrophotometry of skin gelatin
大鲵皮明胶在280 nm 处吸收较少,说明样品只含有少量芳香族氨基酸,可以初步判断所提取的明胶具有较高的纯度。顾赛麒等[15]分别提取了大鲵皮酶溶性胶原蛋白和酸溶性胶原蛋白,得到的最大紫外吸收波长分别为232 nm和233 nm。另外,李林格和曲敏[15]的研究结果表明,大鲵皮胶原蛋白和胶原蛋白肽均在234 nm存在紫外特征吸收峰。由于明胶是一种通过胶原蛋白热变性、部分水解获得的高分子质量水溶性蛋白,因此上述鲵皮胶原蛋白和胶原肽的紫外光谱研究结果与本研究鲵皮明胶的紫外吸收特性较为接近。
2.4 明胶的氨基酸组成
明胶的氨基酸组成是其重要的营养指标,很多研究对明胶的氨基酸组成进行了测定。表3显示了鲵皮明胶的氨基酸组成。

表3 大鲵皮明胶氨基酸组成分析
从表3中可看出,甘氨酸、脯氨酸、谷氨酸和丙氨酸是鲵皮明胶的主要氨基酸,含量分别为20.17%,12.09%, 8.79%和8.54%,约占到总氨基酸的50%,而鲵皮明胶中胱氨酸和蛋氨酸含量相对较少。顾赛麒等[15]分析了鲵皮胶原蛋白氨基酸组成特点,发现酸溶性胶原蛋白和酶溶性胶原蛋白中甘氨酸含量最高,其次是谷氨酸、脯氨酸、羟脯氨酸,这与本研究鲵皮明胶氨基酸组成结果较为类似。一般来讲,多数明胶中甘氨酸是其主要氨基酸,脯氨酸和羟脯氨酸作为胶原的特征氨基酸在明胶中含量也较高[18],尽管本研究未检测鲵皮明胶羟脯氨酸含量,但是甘氨酸和脯氨酸含量已经占到总氨酸的32.26%。
2.5 明胶黏度和凝冻强度
明胶的黏度和凝胶强度是反映明胶品质的重要特性指标。食品工业中使用明胶通常都要求其具有一定的黏度和凝冻强度,用途不同,对其要求会有所差别。本文对提取的鲵皮明胶的黏度和凝冻强度也进行了测定,并和国家标准GB6783—2014《食品添加剂 明胶》凝冻强度值进行了对比,结果如表4所示。

表4 大鲵皮明胶的黏度和凝冻强度
研究表明,不同来源明胶的凝冻强度会有一定差异,总体可分为低Bloom值(<150)、中等Bloom值(150~220)和高Bloom值(>220),造成明胶黏度和凝冻强度差异的原因,除取决于原料及处理方式外,更多的受到提取条件的影响[18, 21]。本研究中大鲵皮明胶黏度值为3.3 mPa·s,大于鱼糜加工副产物提取的明胶黏度值(1.9 mPa·s)[21]和非洲胡子鲶鱼皮明胶黏度值(2.05~2.85 mPa·s)[22],但是低于斑马鲶鱼皮明胶黏度值(4.8 mPa·s)[18];大鲵皮明胶凝冻强度Bloom值为216 g,大于鱼糜加工副产物明胶的Bloom值(62.9 g)[21]和斑马鲶鱼皮明胶Bloom值(170 g)[18],但是小于非洲胡子鲶鱼皮明胶Bloom值(234 g)[22]。本研究提取的鲵皮明胶,其黏度和凝冻强度介于中等范围,今后可通过适当改性、修饰和复配来改善明胶性能,以满足不同的工业需要。
3 结论
在单因素试验的基础上,采用正交试验确定了大鲵皮提取明胶的最佳工艺条件:提取温度60 ℃,超声功率400 W,提取时间7 h,料液比1∶9,明胶提取率可达13.76%。经紫外光谱扫描,该明胶在234 nm 处有最大吸收,明胶中甘氨酸、脯氨酸、谷氨酸和丙氨酸含量相对较高。鲵皮明胶黏度值为3.3 mPa·s,凝冻强度Bloom值为216 g,达到食用明胶的基本要求。
参考文献
[1] ZHOU Z Y, GENG Y, LIU X X, et al. Characterization of a ranavirus isolated from the Chinese giant salamander (Andriasdavidianus, Blanchard, 1871) in China[J]. Aquaculture, 2013, 384-387(2):66-73.
[2] CHEN L J, TAO F Y, LU Q B. Advances in research of Chinese giant salamander[J]. Journal of Shanghai Fisheries University, 2003(12):110-114.
[3] 王立新,郑尧,艾闽, 等. 中国大鲵肌肉、尾脂营养成分分析与评价[J]. 西北农林科技大学学报(自然科学版),2011, 39(2):68-73.
[4] 李莉,顾塞麒,王锡昌, 等. 人工养殖大鲵肌肉和鲵皮营养成分分析及评价[J]. 食品工业科技,2012,33(24):385-387.
[5] 胡云峰, 路敏, 胡晗艳, 等. 气调包装对冷鲜人工养殖大鲵分割肉货架品质的影响[J]. 食品与发酵工业,2015, 41(5): 199-202.
[6] 陈曦,王杨科,陈德经. 大鲵皮肤和黏液抑菌效果及其中药膏制剂对烫伤的影响[J]. 中药药理与临床,2012(5):111-113.
[7] 王利峰,李学英,王大忠. 大鲵皮肤分泌液中抗菌肽的鉴定及生物活性研究[J]. 中国生化药物杂志,2011, 32(4):269-272.
[8] GUO W T, AO M Z, LI W, et al. Major biological activities of the skin secretion of the Chinese giant salamander, andrias davidianus[J]. Zeitschririft Fur Nanaturforschung Section C-A Journal of Biosciences, 2012, 67(1-2): 86-92.
[9] KONG L A, WU X, LUO B R, et al. Glycopeptides isolated from skin glands secretion of Andrias davidianus[J]. Glycobiology, 2010, 20(11): 1 503.
[10] 徐伟良, 陈德经, 刘宇, 等. 大鲵皮肤黏液糖蛋白的提取纯化及抗肺癌活性研究[J]. 中国生化药物杂志,2015,35(8):44-47.
[11] 鲍九枝, 余可锋. 响应面优化大鲵肉活性肽制备及运动饮料开发[J]. 食品工业,2014, 35(11):175-178.
[12] GOMEZ-GUILLEN M C, GIMENEZ B, LOPEZ-CABALLERO M E, et al. Functional and bioactive properties of collagen and gelatin from alternative sources: a review[J]. Food Hydrocolloids, 2011, 25(8):1 813-1 827.
[13] ZHOU P, MULVANEY S J, REGENSTEIN J M. Properties of Alaska pollock skin gelatin: a comparison with tilapia and pork skin gelatins[J]. Journal of Food Science, 2006, 71(6): C313-C321.
[14] 李莉, 顾赛麒, 王锡昌, 等. 响应面法优化酶法提取大鲵皮胶原蛋白工艺[J]. 中国水产科学, 2013, 20(4): 876-883.
[15] 顾赛麒, 李莉, 王锡昌, 等. 人工养殖大鲵皮胶原蛋白的性质研究[J]. 食品科学, 2014, 35(9): 74-79.
[16] 李林格, 曲敏. 大鲵皮胶原蛋白肽的结构特征性及其对乙醇诱导肝损伤小鼠的保护作用[J]. 食品工业科技,2014, 35(8): 340-343.
[17] NAGARAJAN M, BENJAKUL S, PRODPRAN T, et al. Characteristics and functional properties of gelatin from splendid squid (Loligoformosana) skin as affected by extracted temperature[J]. Food Hydrocolloids, 2012, 29(2): 389-397.
[18] KTARI N, IRIDI M, NASRI R, et al. Characteristics and functional properties of gelatin from zebra blenny (Salariabasilisca) skin[J]. LWT-Food Science and Technology, 2014, 58(2): 602-608.
[19] 王珊珊,单银银,李志皓,等. 真鳕鱼骨明胶的提取工艺及性质研究[J]. 食品与发酵工业,2012, 38(7): 152-156.
[20] 肖枫,朱文学. 响应面法优化超声辅助热水提取黄河鲤鱼鱼鳞明胶工艺[J]. 食品科学,2013, 34(22): 101-105.
[21] NORZIAH M H, KEE H Y, NORITA M. Response surface optimization of bromelain-assisted gelatin extraction from surimi processing wastes[J]. Food Science, 2014, 5: 9-18.
[22] ALFARO A T, BILUCA F C, MARQUETTI C M, et al. African catfish (Clariasgariepinus) skin gelatin: Extraction optimization and physical-chemical properties[J]. Food Research International, 2014, 65: 416-422.
Study on extraction and property of skin gelatin from giant salamander
JIN Wen-gang1,2,3*, CHEN De-jing1,3, GENG Jing-zhang1, PEI Jin-jin1
1(Key Laboratory of Bio-resources of Shaanxi Province, School of Bioscience and Engineering,Shaanxi Sci-Tech University, Hanzhong 723000,China)2(National Engineering Research Center of Seafood, Dalian Polytechnic University, Dalian 116034,China)3(Institute of Giant Salamander, Shaanxi Sci-Tech University, Hanzhong 723000,China)
In order to utilize the by-products skin of giant salamander during processing, the skin gelatin extraction process and its properties were investigated. Skin was first treated by alkaline-acid pre-treatment, then using yield as the index, extraction process parameters were optimized by single-factor experiment and orthogonal experiment. Results showed that the optimum conditions for gelatin from the skin were as follows: the extraction temperature 70 ℃, ultrasonic power 400 W, extraction time 7 h, and the ratio of skin to water 1∶9, with a maximum gelain yield of 13.76%. The skin gelatin of giant salamander contained relatively high content of glycine, proline, glutamic acid and alanine, which are about 50% of the total amino acids. The skin gelatin exhibited the maximum UV absorbance at 234 nm, viscosity of 3.3 mPa·s and gel strength bloom value of 216 g.
giant salamander; gelatin; ultraviolet spectrum; gel strength; amino acid
10.13995/j.cnki.11-1802/ts.201702029
博士,讲师(本文通讯作者,E-mail:jinwengang@nwafu.edu.cn)。
陕西省教育厅重点项目(15JS020);陕西省重点实验室后补助项目(2015SZS-15-01)
2016-06-12,改回日期:2016-07-18

