HPLC法分析山西不同大豆品种皂醇含量
王卫东,赵巧玲,高春燕,郭春绒,赵晋忠,杜维俊,岳爱琴*
(1.山西农业大学 文理学院, 山西 太谷 030801; 2.山西农业大学 农学院,山西 太谷 030801)
HPLC法分析山西不同大豆品种皂醇含量
王卫东1,赵巧玲1,高春燕1,郭春绒1,赵晋忠1,杜维俊2,岳爱琴2*
(1.山西农业大学 文理学院, 山西 太谷 030801; 2.山西农业大学 农学院,山西 太谷 030801)
[目的]评价不同粒重、种皮颜色和生态类型大豆材料中皂醇含量的差异性,筛选高皂醇含量基因型大豆材料,为大豆高皂醇含量品种选育和机理研究提供理论依据。[方法]以具有代表性生态类型的72个大豆品种(系)为材料,用HPLC法对大豆皂醇含量进行了测定。[结果]供试大豆品种总皂醇含量变异范围为0.92~4.02 mg·g-1;小粒型材料皂醇A、皂醇B和总皂醇含量显著高于中粒型和大粒型材料;黑色种皮大豆材料皂醇A和总皂醇含量显著高于黄色和绿色;野生大豆材料皂醇A和总皂醇含量显著高于栽培种;不同组织胚中皂醇A、皂醇B和总皂醇含量最高,种皮最低。[结论]不同大豆品种皂醇含量差异显著,且小粒、黑色、野生大豆材料中皂醇含量最高。
大豆; 皂苷; 皂醇; HPLC
大豆皂苷属于三萜类齐墩果酸型皂苷,目前已发现54种大豆皂苷[1]。大豆皂苷主要由苷元(皂醇A和B)连接一个或两个糖链组成[2,3]。大豆皂苷具有多种对人体有益的生理功能[4~6],如降血脂、防癌、抗癌和增强免疫等生理活性[7~11]。
大豆皂苷通过酸、微生物和酶水解为大豆苷元即大豆皂醇A和B[12](图1)。近年来研究表明,大豆皂醇的生物活性高于大豆皂苷,且大豆皂醇B的生物活性最高[13]。大豆皂醇和大豆皂苷具有不同的生理功能,如皂醇具有抗血小板凝集、预防和治疗免疫疾病、抑制HT-29结肠癌细胞的生长等生理活性[14~18]。大豆皂苷具有苦涩味,但水解为大豆皂醇后苦涩味显著降低[19]。由于大豆皂苷种类多,结构复杂,缺乏各类皂苷的标准品,检测大豆皂苷各组分含量有一定的困难,对大豆皂醇A和B的含量进行测定则较容易。因此,本研究利用高效液相色谱(High Performance Liquid Chromatography,HPLC)法对大豆皂醇A和B的含量进行研究。
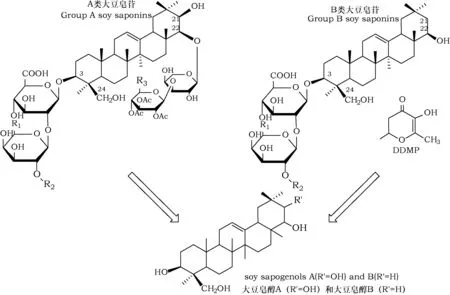
图1 大豆皂苷的水解示意图Fig.1 The hydrolysis of soyasaponin
Kim等[20]对来源于中国、美国、韩国3个国家大豆材料的大豆皂醇A和B含量进行测定,发现中国大豆材料中皂醇含量最高,但我国对不同大豆材料皂醇A和B含量的研究尚无报道。因此本研究选用山西72个大豆品种(系)种质为材料,通过HPLC法测定不同材料种子和不同组织中大豆皂醇A和皂醇B含量,旨在明确不同品种、不同组织大豆皂醇A和皂醇B的变异范围,以期挖掘大豆皂醇含量的特异种质资源,为大豆功能保健食品的开发以及品质 育种改良(提高大豆皂醇B含量,降低皂醇A含量)提供优异材料。
1 材料与方法
1.1 供试材料
试验材料为适宜山西种植的72份大豆材料,详见表1。种子用震动球磨仪GT200粉碎后备用。鼓粒期取野生大豆材料SNWS38的根、茎和叶,经冷冻干燥后,用震动球磨仪GT200粉碎后备用。
1.2 试验方法
1.2.1 大豆皂苷提取液的制备
准确称取0.4 g样品置于离心管中,加入30 mL的80%乙醇,漩涡震荡仪上震荡2 min,室温下浸提24 h,3 000 r·min-1离心10 min,取上清,室温下避光保存。
1.2.2 大豆皂苷的水解
参照Jane等[21]人水解方法,对其做了进一步的改进。取20 mL的提取液于旋转蒸发仪37 ℃旋干,75 ℃水浴锅中水解195 min,使之充分水解,用0.22 μm 的微孔滤膜过滤。
1.2.3 皂醇含量的测定
采用高效液相色谱法测定大豆种子皂醇含量。大豆皂醇A和B标准品均购自美国Sigma公司, 色谱纯。
采用Agilent 12600高效色谱仪和ZORBAX SB-C18(5 μm,25 cm×4.6 mm)色谱柱进行定量分析。流动相A为0.1%的乙酸乙腈溶液,流动相B为0.1%乙酸水溶液;洗脱梯度为:0~10 min,55%A;10~20 min,55%~60%A;20~30 min,60%A;30~50 min,60%~70%A;50~60 min,70%A;60~65 min,70%~55%A;流速1.0 mL·min-1,检测波长为205 nm,柱温30 ℃,进样量30 μL,运行65 min。
表1 本研究所用的大豆材料来源
Table 1 The resource of Soybean variety used in the research
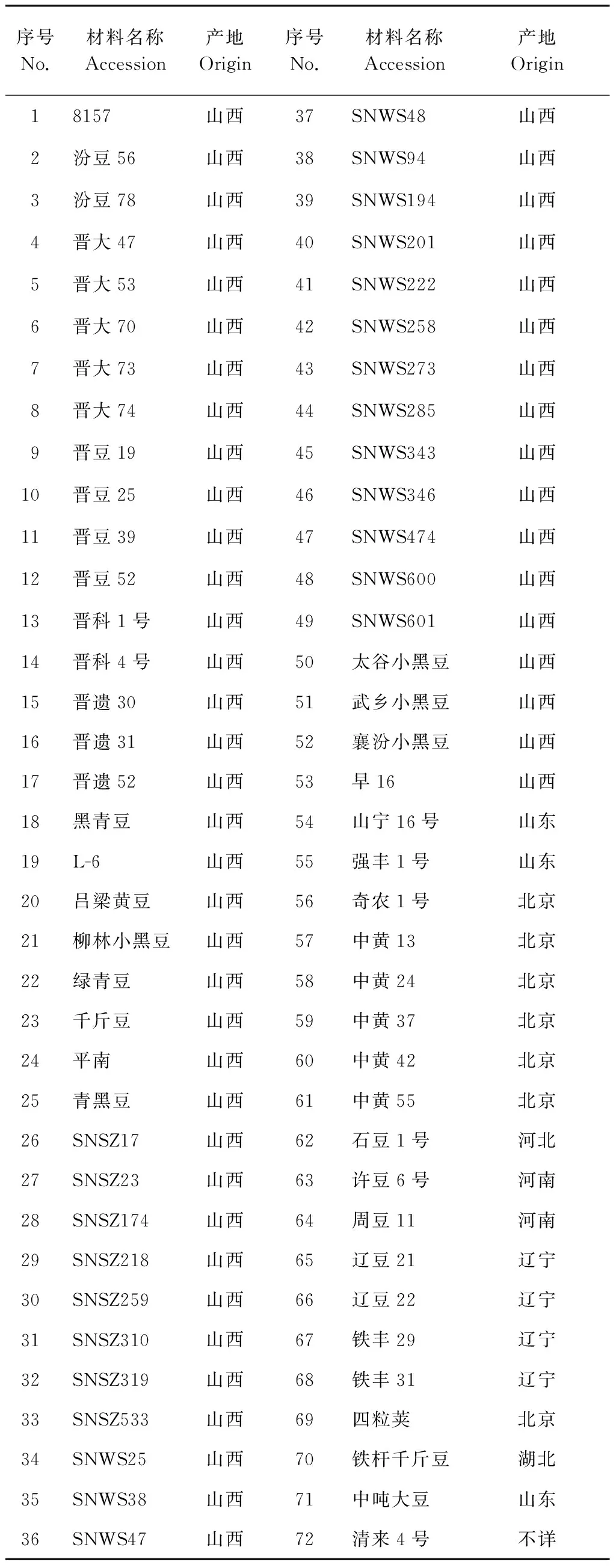
序号No.材料名称Accession产地Origin序号No.材料名称Accession产地Origin18157山西37SNWS48山西2汾豆56山西38SNWS94山西3汾豆78山西39SNWS194山西4晋大47山西40SNWS201山西5晋大53山西41SNWS222山西6晋大70山西42SNWS258山西7晋大73山西43SNWS273山西8晋大74山西44SNWS285山西9晋豆19山西45SNWS343山西10晋豆25山西46SNWS346山西11晋豆39山西47SNWS474山西12晋豆52山西48SNWS600山西13晋科1号山西49SNWS601山西14晋科4号山西50太谷小黑豆山西15晋遗30山西51武乡小黑豆山西16晋遗31山西52襄汾小黑豆山西17晋遗52山西53早16山西18黑青豆山西54山宁16号山东19L-6山西55强丰1号山东20吕梁黄豆山西56奇农1号北京21柳林小黑豆山西57中黄13北京22绿青豆山西58中黄24北京23千斤豆山西59中黄37北京24平南山西60中黄42北京25青黑豆山西61中黄55北京26SNSZ17山西62石豆1号河北27SNSZ23山西63许豆6号河南28SNSZ174山西64周豆11河南29SNSZ218山西65辽豆21辽宁30SNSZ259山西66辽豆22辽宁31SNSZ310山西67铁丰29辽宁32SNSZ319山西68铁丰31辽宁33SNSZ533山西69四粒荚北京34SNWS25山西70铁杆千斤豆湖北35SNWS38山西71中吨大豆山东36SNWS47山西72清来4号不详
准确称取大豆皂醇标准品皂醇A和B各1.0 mg,溶于1.0 mL甲醇,配成1.0 g·L-1的储备液。将各储备液逐级稀释为50、100、150、200、250、300 mg·L-1的标准溶液。回归方程分别为:YA=19.841 37X,R2=0.9973,线性范围为0~300 mg·L-1,YB=21.362 9X,R2=0.997 3;线性范围为0~300 mg·L-1。利用回归方程计算皂醇A和皂醇B的含量,总皂醇含量为皂醇A和皂醇B含量之和。
采用 SPSS 22.0 统计软件对测定数据进行统计分析,并利用 Pearson 相关分析对皂醇各组分进行相关分析。
2 结果与分析
2.1 大豆皂醇含量的分析
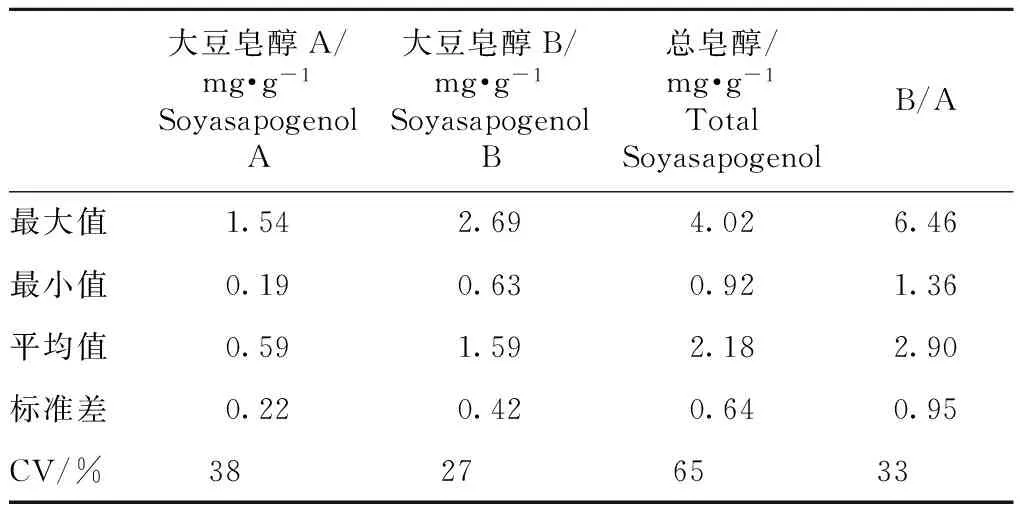
用HPLC法对供试材料大豆种子中大豆皂醇含量进行分析测定,结果表明不同品种大豆种子中总皂醇、皂醇A和B含量差异较大。供试材料种子中皂醇A、皂醇B和总皂醇的变异范围分别为0.19~1.54 mg·g-1、0.63~2.69 mg·g-1和0.92~4.02 mg·g-1,其中晋科4号总皂醇含量最低,野生大豆材料SNWS38总皂醇含量最高(谱图见图2)。大豆皂醇B和A的比值的变异范围为1.36~6.46(表2)。
表2 不同大豆品种皂醇A和大豆皂醇B含量分析
Table 2 Analysis on the content of soyasapogenol A and B in soybean varieties
大豆皂醇A/mg·g-1SoyasapogenolA大豆皂醇B/mg·g-1SoyasapogenolB总皂醇/mg·g-1TotalSoyasapogenolB/A最大值1.542.694.026.46最小值0.190.630.921.36平均值0.591.592.182.90标准差0.220.420.640.95CV/%38276533
2.2 不同粒重类型大豆皂醇含量分析
对不同粒重类型种子中大豆皂醇含量进行分析,结果表明大豆皂醇A、B和总皂醇含量依次为小粒型(<13 g)>中粒型(13~24 g)>大粒型(>24 g)。小粒型材料种子中大豆皂醇A、B和总皂醇含量分别为0.77、1.86和2.63 mg·g-1。小粒、中粒型材料种子中大豆皂醇A、B含量显著高于大粒型大豆材料;小粒型材料种子中总皂醇含量显著高于中粒型和大粒型材料(图3)。
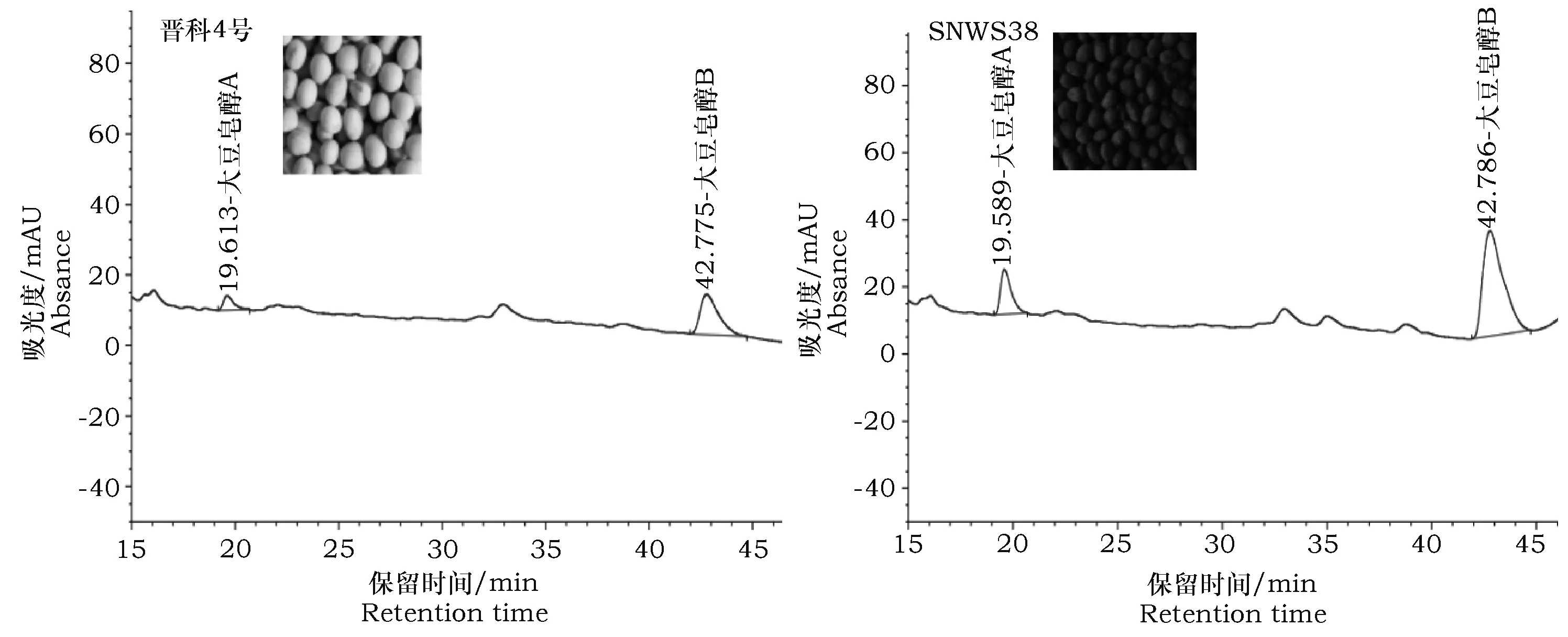
图2 晋科4号和SNWS38液相色谱图Fig.2 High performance liquid chromatography (HPLC) figure of JinKe 4 and SNWS38
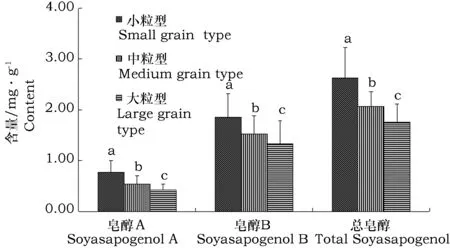
图3 不同粒重类型大豆皂醇含量分析Fig.3 Statistical analysis of soyasapogenol content in different seed weight types 注:不同小写字母表示差异显著(P<0.05),下同。Note:Different small letters show significant difference at the 0.05 level, the same below.
2.3 不同种皮颜色大豆材料皂醇含量的分析
对不同种皮颜色大豆材料种子中大豆皂醇含量进行分析,结果表明不同种皮颜色大豆材料皂醇A、B及总皂醇含量差异显著,依次为黑色类型>绿色类型>黄色类型(图4)。黑色种皮类型大豆材料皂醇A、B和总皂醇含量最高,分别为0.76、1.86、2.62 mg·g-1;黄色类型材料皂醇A、B和总皂醇含量最低,分别为0.51、1.47、1.98 mg·g-1。黑色种皮类型大豆材料皂醇A含量和总皂醇含量显著高于黄色类型和绿色类型。黄色种皮大豆材料皂醇A、B和总皂醇含量与绿色类型差异均不显著。
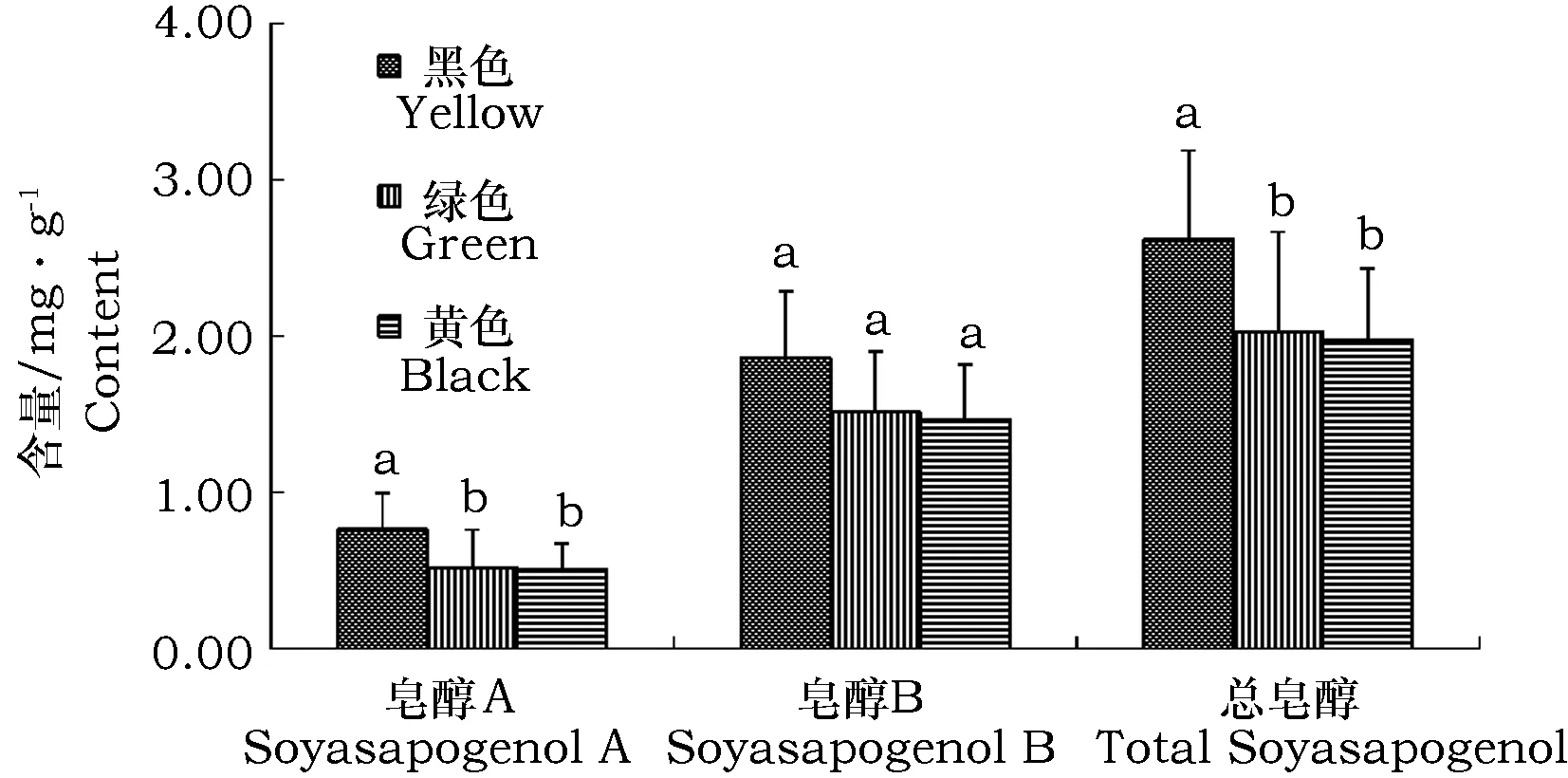
图4 不同种皮颜色大豆材料皂醇含量分析Fig.4 Statistical analysis on the content of soyasapogenol in different color types of soybeans
2.4 野生、半野生、栽培大豆材料皂醇含量分析
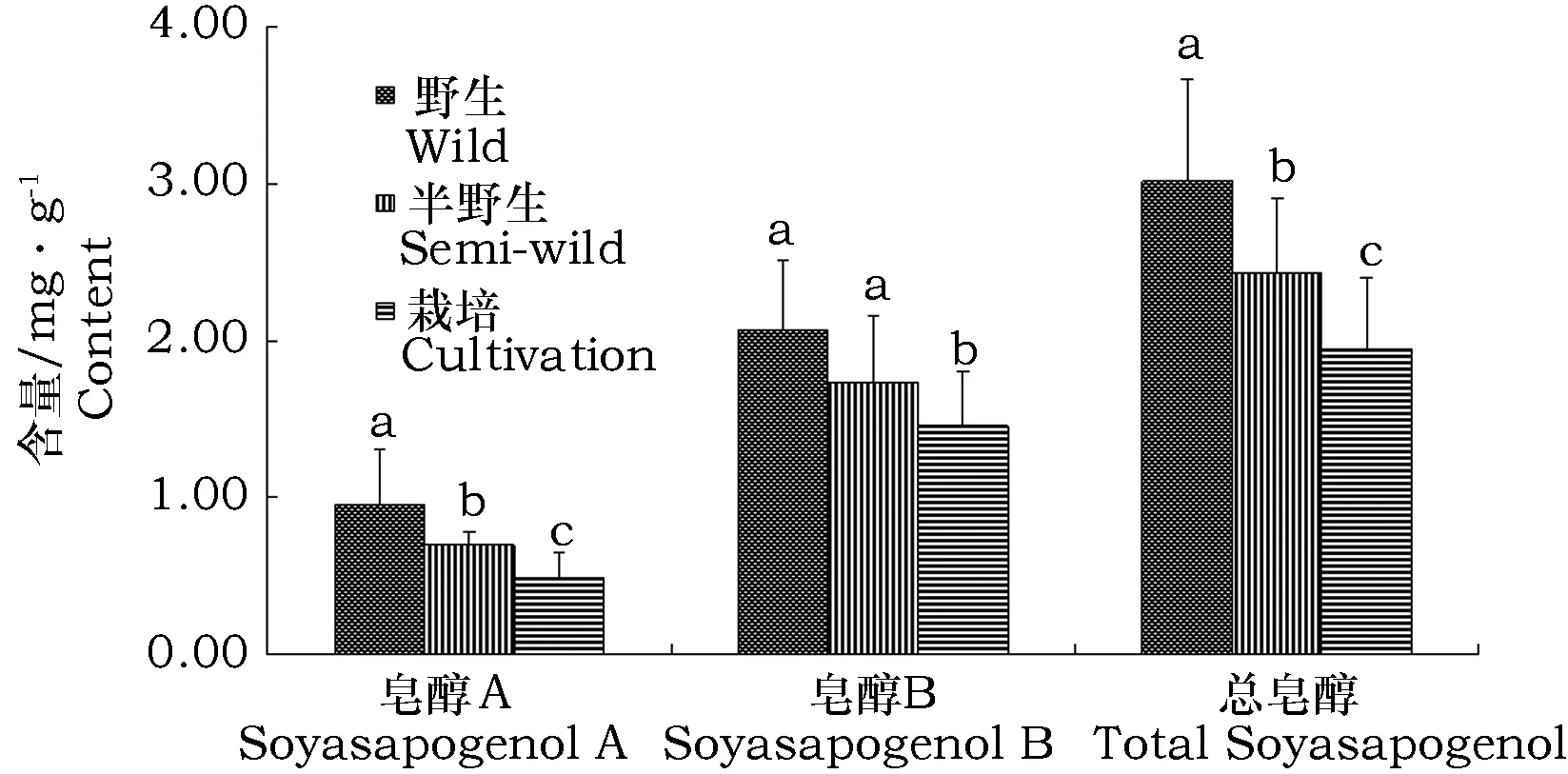
图5 野生、半野生和栽培大豆材料种子中大豆皂醇含量分析Fig.5 Statistical analysis of soyasapogenol content in Wild, Semi-wild and Cultivated Soybean seed
不同生态类型大豆材料总皂醇和皂醇A含量差异显著,依次为野生>半野生>栽培(图5)。野生、半野生大豆材料皂醇B含量显著高于大豆栽培品种,而野生和半野生大豆材料之间差异不显著。
2.5 大豆皂醇含量与籽粒性状的相关分析
分析大豆皂醇A、B和总皂醇含量之间及其与籽粒性状的相关性,结果表明大豆皂醇A、B与总皂醇含量呈极显著正相关,其中皂醇B与总皂醇含量相关系数达0.952(表3)。粒长、粒宽、子叶重和胚重与大豆皂醇A、B和总皂醇含量均呈极显著负相关。
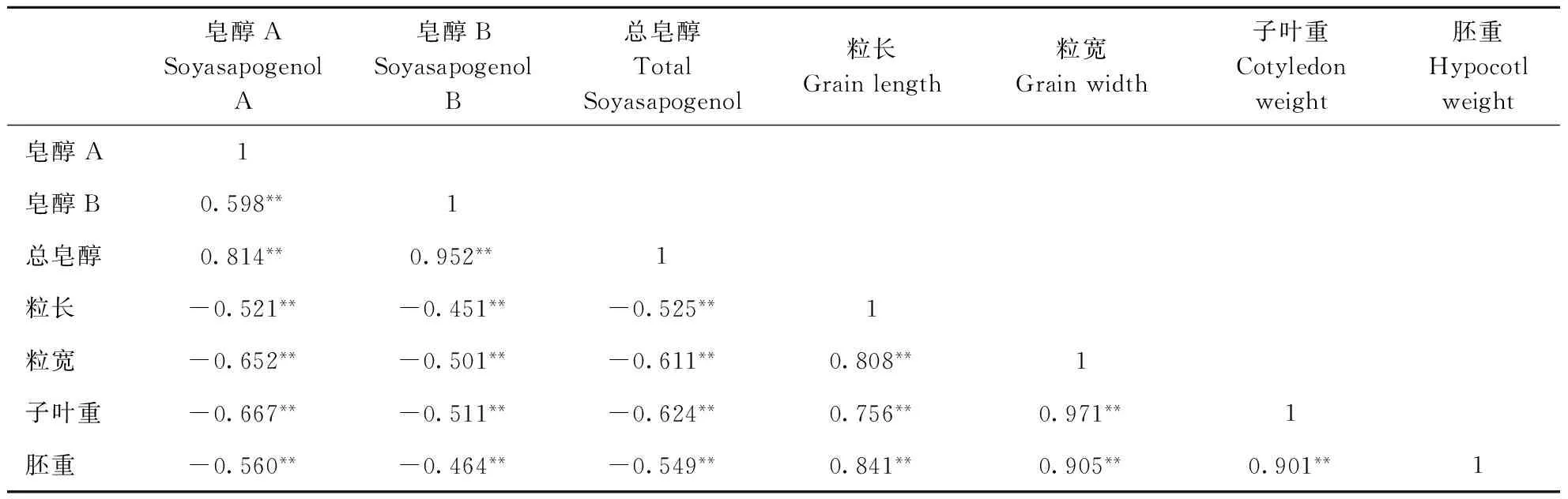
表3 大豆皂醇A和B与总量的相关性分析
注:*表示差异性达显著水平(P<0.05);**表示差异达极显著水平(P<0.01)。
Note:* represent significant differencesd level at the 0.05 level,**show significant differencesd level at the 0.01 level.
2.6 不同组织中大豆皂醇含量分析
对大豆材料SNWS38不同组织中皂醇A、皂醇B和总皂醇含量进行了分析,结果表明不同组织间皂醇含量差异显著。胚中皂醇A、皂醇B和总皂醇含量分别为11.52、9.13和20.64 mg·g-1,远远高于其他组织中的含量,种皮中皂醇含量最低,仅为0.22 mg·g-1(表4)。子叶中皂醇B含量与皂醇A的比值为2.64,胚中比值仅为0.79。
表4 不同组织中皂醇含量分析
Table 4 Analysis of soyasapogenol content in different tissues of soybean
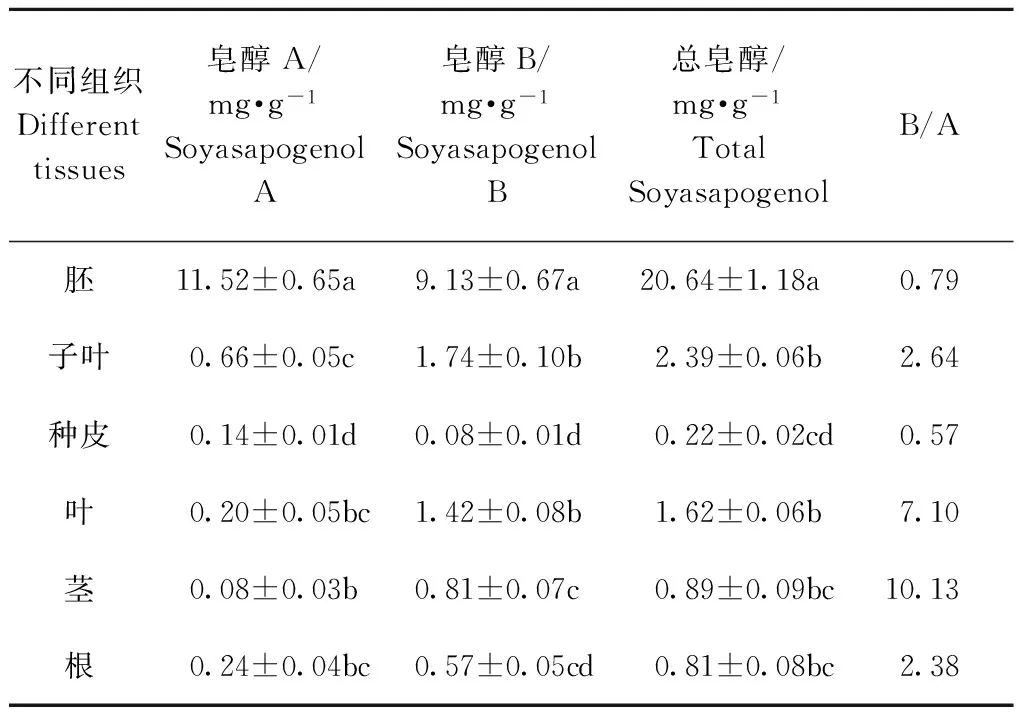
不同组织Differenttissues皂醇A/mg·g-1SoyasapogenolA皂醇B/mg·g-1SoyasapogenolB总皂醇/mg·g-1TotalSoyasapogenolB/A胚11.52±0.65a9.13±0.67a20.64±1.18a0.79子叶0.66±0.05c1.74±0.10b2.39±0.06b2.64种皮0.14±0.01d0.08±0.01d0.22±0.02cd0.57叶0.20±0.05bc1.42±0.08b1.62±0.06b7.10茎0.08±0.03b0.81±0.07c0.89±0.09bc10.13根0.24±0.04bc0.57±0.05cd0.81±0.08bc2.38
3 讨论与结论
大豆[GlycinemaxL. Merr.]是重要的油料和经济作物,大豆籽粒除含有人类食用的植物蛋白质和油脂外[22],还富含许多对人体有益的生物活性物质如大豆异黄酮、大豆皂苷等[23]。
大豆皂苷是大豆生长发育过程中的重要次生代谢产物之一,具有许多对人体有益的生理功能,同时也是导致大豆食品苦涩味的主要原因之一[4~6,24]。大豆皂苷的水解产物为大豆皂醇A和大豆皂醇B,大豆皂醇的生物活性高于大豆皂苷,并且可以降低大豆制品的苦涩味[19]。因此本研究通过对山西不同生态类型大豆材料种子中大豆皂苷水解产物皂醇含量进行分析,有助于我们了解山西不同大豆种质皂醇变异范围,对今后大豆品质改良具有重要意义。本研究结果显示,参试品种籽粒中总皂醇平均值为2.18 mg·g-1,显著高于Vasantha Rupasinghe等[25]利用HPLC法对加拿大大豆品种籽粒中总皂醇的测定含量(2.00 mg·g-1),同时高于Kim等[20]对来自美国和韩国大豆品种籽粒中总皂醇含量,本研究测定总皂醇含量的变异范围也比较大(0.92~4.02 mg·g-1),说明我们具有皂醇含量变异丰富的的大豆资源,有利于今后开展大豆皂苷品质育种工作。
本研究还发现野生大豆材料籽粒中皂醇A、皂醇B和总皂醇含量最高,其次为半野生材料,栽培品种最低,该结论与Hu等[26]的结论一致。同时本研究对不同组织皂醇含量测定发现,大豆胚中皂醇含量最高,种皮最低。该结论与Vasantha Rupasinghe、Berhow等[25,27]对大豆皂醇含量分布的研究结果类似。
研究表明大豆皂醇B的生物活性显著高于大豆皂醇A[13]。本研究参照Jane等[21]人水解方法利用1N HCl-甲醇溶液对山西72份大豆品种(系)种质材料和优异种质材料SNWS38鼓粒期不同组织大豆皂苷提取物进行水解,得到大豆皂醇A和B。通过HPLC法测定分析,结果表明参试品种籽粒中大豆皂醇B与A比值的介于1.36~6.46,大于Vasantha Rupasinghe等[25]测定的皂醇B与A比值的变异范围(2.5~4.5),进一步说明我们具有皂醇含量变异丰富的的大豆资源,有利于我们选择含有优异皂醇组分(皂醇B/A比值大)的种质资源进行品质育种。
[1]Krishnamurthy P, Tsukamoto C, Singh R J, et al. The Sg-6 saponins,new components in wild soybean (GlycinesojaSieb. and Zucc.): polymorphism, geographical distribution and inheritance[J]. Euphytica,2014,198(3):413-424.
[2]Yoshiki Y, Kudou S, Okubo K. Relationship between Chemical Structures and Biological Activities of Triterpenoid Saponins from Soybean[J]. Bioscience Biotechnology & Biochemistry,1998,62(12):2291-2299.
[3]Zhang W, Popovich D G. Chemical and Biological Characterization of Oleanane Triterpenoids from Soy[J]. Molecules,2009,14(8):2959-2975.
[4]Ellington A A, Berhow MSingletary K W. Induction of macroautophagy in human colon cancer cells by soybean B-group triterpenoid saponins[J]. Carcinogenesis,2005,26(1):159-167.
[5]Ellington A A, Berhow M A, Singletary K W. Inhibition of Akt signaling and enhanced ERK1/2 activity are involved in induction of macroautophagy by triterpenoid B-group soyasaponins in colon cancer cells[J]. Carcinogenesis,2006,27(2):298-306.
[6]Ishii Y, Tanizawa H. Effects of soyasaponins on lipid peroxidation through the secretion of thyroid hormones[J]. Biological & Pharmaceutical Bulletin,2006,29(8):1759-1763.
[7]Lee S O, Simons A L, Murphy P A, et al. Soyasaponins lowered plasma cholesterol and increased fecal bile acids in female golden Syrian hamsters[J]. Experimental Biology & Medicine,2005,230(7):472-478.
[8]Xiao J X, Huang G Q, Zhu C P, et al. Morphological study on apoptosis Hela cells induced by soyasaponins[J]. Toxicology in Vitro,2007,21(5):820-826.
[9]Dong W. Enhancement Effect of Total Soyasaponin on Immune Function[J]. Chinese Cereals & Oils Association,2001,16:9-11.
[10]Y Yoshiki, T Kahara, K Okubo. Superoxide-and 1,1-diphenyl-2-picrylhydrazyl radical-scavenging activities of soyasaponin beta g related to gallic acid[J]. Bioscience Biotechnology & Biochemistry,2014,65(10):2162-2165.
[11]Jun H S, Kim S E, Sung M K. Protective effect of soybean saponins and major antioxidants against aflatoxin B1-induced mutagenicity and DNA-adduct formation[J]. Journal of Medicinal Food,2002,5(4):235-240.
[12]Kudou S, Tsuizaki I, Shimoyamada M, et al. Screening for Microorganisms Producing Soybean Saponin Hydrolase[J]. Agricultural & Biological Chemistry,1990,54(11):3035-3037.
[13]Kamo S, Suzuki S, Sato T. Comparison of bioavailability (I) between soyasaponins and soyasapogenols, and (II) between group A and B soyasaponins[J]. Nutrition,2014,30(5):596-601.
[14]Gurfinkel D M, Rao A V. Soyasaponins: The Relationship Between Chemical Structure and Colon Anticarcinogenic Activity[J]. Nutrition & Cancer,2003,47(1):24-33.
[15]Rowlands J C, Berhow M A, Badger T M. Estrogenic and antiproliferative properties of soy sapogenols in human breast cancer cells in vitro[J]. Food & Chemical Toxicology,2002,40(12):1767-1774.
[16]Watanabe M, Mido N, Tamura T, et al. Saponin-decomposing enzyme, gene thereof and large-scale production system for producing soyasapogenol B:US, US7144718[P]. 2006.
[17]Zhang W, Popovich D G. Effect of soyasapogenol A and soyasapogenol B concentrated extracts on HEP-G2 cell proliferation and apoptosis[J]. Journal of Agricultural & Food Chemistry,2008,56(8):2603-2608.
[18]Chang S Y, Han M J, Han S J, et al. Metabolism of Soyasaponin I by Human Intestinal Microflora and Its Estrogenic and Cytotoxic Effects[J]. Biomolecules & Therapeutics,2009,17(4):430-437.
[19]Okubo K, Iijima M, Kobayashi Y, et al. Components responsible for the undesirable taste of soybean seeds[J]. Bioscience Biotechnology and Biochemistry,1992,56:99-103.
[20]Kim E H, Ro H M, Kim S L, et al. Analysis of isoflavone, phenolic, soyasapogenol, and tocopherol compounds in soybean [Glycinemax(L.) Merrill] germplasms of different seed weights and origins[J]. Journal of Agricultural & Food Chemistry,2012,60(23):6045-6055.
[21]Hubert J, Berger M, Daydé J. Validation of a High-performance Liquid Chromatography-Ultraviolet Method to Quantify Soy Sapogenols A and B in Soy Germs from Different Cultivars and in Soy Isoflavone-Enriched Supplements[J]. Journal of Food Science,2005,70(8):c471-c477.
[22]马育华,盖钧镒.江淮下游地区大豆地方品种的初步研究——(三)数量性状的表型、遗传型相关,选择指数,及其育种意义[J].作物学报,1979(4):1-12.
[23]孙军明,丁安林.大豆加工产品中若干抗癌物质的含量及其效应[J].大豆科学,1997(2):158-173.
[24]Okubo K, Iijima M, Kobayashi Y, et al. Components Responsible for the Undesirable Taste of Soybean Seeds[J]. Bioscience Biotechnology & Biochemistry,1992,56(1):99-103.
[25]H P Vasantha Rupasinghe, ChungJa C Jackson, Vaino Poysa, et al. Soyasapogenol A and B Distribution in Soybean (GlycinemaxL. Merr.) in Relation to Seed Physiology, Genetic Variability, and Growing Location[J]. Journal of Agricultural & Food Chemistry,2003,51(20):5888-5894.
[26]Hu J, Lee S O, Hendrich S, et al. Quantification of the group B soyasaponins by high-performance liquid chromatography[J]. Journal of Agricultural & Food Chemistry,2002,50(9):2587-2594.
[27]Berhow M A, Kong S B, Vermillion K E, et al. Complete quantification of group A and group B soyasaponins in soybeans[J]. Journal of Agricultural & Food Chemistry,2006,54(6):2035-2044.
(编辑:武英耀)
Analysis of soyasapogenol contents of different soybean varieties in Shanxi by HPLC method
Wang Weidong1, Zhao Qiaoling1, Gao Chunyan1, Guo Chunrong1, Zhao Jinzhong1, Du Weijun2, Yue Aiqin2*
(1.CollegeofArtsandSciences,ShanxiAgriculturalUniversity,Taigu030801,China; 2.CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]To provide theoretical basis for the selection and mechanism study of soybean varieties with high content of soyasapogenol, the difference of soyasapogenol contents in different grain weight, seed coat color and ecological type of soybean materials were evaluated, soybean genotype materials with high soyasapogenol content were screened. [Methods]The contents of soyasapogenol were determined by high performance liquid chromatography (HPLC) method with 72 soybean varieties from Shanxi as materials.[Results]We found that the soyasapogenol contents of 72 soybean varieties ranged from 0.92 to 4.02 mg·g-1; the contents of soyasapogenol A, B and the total soyasapogenol of small grain materials were significantly higher than those of medium grain and large grain type materials; the soyasapogenol A and total soyasapogenol contents of soybean varieties with black seed coat were significantly higher than those with yellow or green seed coat; the contents of soyasapogenol A and the total soyasapogenol in the wild soybean were significantly higher than those in the cultivated species; In different tissues, the content of soyasapogenol A, B and total soyasapogenol in hypocotyl was the highest, and the content of soyasapogenol in seed coat was the lowest. [Conclusion]The content of soyasapogenol was significantly different in different soybean varieties,the content of soyasapogenol in the variety with the characteristics of small grains, black seed coat, wild materials was the highest.
Soybean, Saponin, Soyasapogenol, HPLC
2016-10-17
2016-12-26
王卫东(1989-),男(汉),山西平鲁人,硕士研究生,研究方向:大豆品质育种
*通信作者:岳爱琴,副教授,硕士生导师,Tel:18734484606;E-mail:yueaiqinnd@126.com
山西省科技计划项目(20120311005-3);山西省高等学校科技创新项目(2015148);山西省自然科学基金(201601D011076)
S331
A
1671-8151(2017)03-0201-06

