AtDES1基因在大白菜中的遗传转化
景巧丽,马晓丽,裴雁曦
(山西大学 生命科学学院,山西 太原 030006)
AtDES1基因在大白菜中的遗传转化
景巧丽,马晓丽,裴雁曦*
(山西大学 生命科学学院,山西 太原 030006)
[目的]硫化氢是继一氧化氮和一氧化碳之后第三种气体信号分子,在植物体的生长发育和抵御外界胁迫过程中发挥着重要的作用。近年来,环境污染日益严重,对大白菜的生长发育过程产生严重的抑制作用。半胱氨酸脱巯基酶(DES1)是产生硫化氢的重要酶,将DES1基因整合入大白菜基因组,有可能提高其抗逆性,同时为白菜育种提供新种质。[方法]本试验以中白60为材料,在已有的培养转化体系基础上对种子的消毒时间、菌液侵染时间以及抗生素筛选压进行优化,获得有效的转化体系。[结果]用0.1%的HgCl2对种子消毒6 min,既能保持较高的萌发率又能防止内源菌的产生;用OD600为0.2~0.3的菌液侵染外植体5 min,分别以7.5 mg·L-1和5.0 mg·L-1的潮霉素作为抗性芽和根的抗生素筛选浓度,转化效率较高,转化率为6%。[结论]抗性植株经PCR和qRT-PCR鉴定表明DES1基因已成功整合到大白菜基因组中且表达量有不同程度的提高。
大白菜; 硫化氢; 转化; 转基因植株
大白菜(BrassicacampestrisL.ssp.pekinensi)属于十字花科芸薹属,是北方秋冬季主要的蔬菜作物。但近年来由于环境的污染,白菜种植遭受到重金属、干旱和冷冻等多种逆境胁迫的影响,给大白菜生产造成很大损失。运用基因工程手段培育优良的抗逆蔬菜品种是解决这些问题的有效手段[1]。
本实验室先前已建立了比较有效的基于津育75为材料的大白菜转化体系。基因型背景对大白菜的遗传转化效率影响严重[2]。因此,为提高本试验所选取的综合性状更符合育种目标的中白60的转化效率,需对已有遗传转化体系中种子的消毒时间、菌液侵染时间进行优化。另外,本试验所用表达载体含潮霉素抗性基因,还需对抗生素筛选浓度进行优化。
硫化氢(H2S)作为一种重要的气体信号分子,在植物对逆境胁迫的响应过程中发挥重要作用,例如抗旱[3],抵御冷胁迫[4]和缓解重金属毒害[5,6]等。植物体内以半胱氨酸为底物产生H2S的酶有半胱氨酸脱巯基酶、半胱氨酸脱硫酶、β-氰丙氨酸合酶和 O-乙酰丝氨酸硫醇裂解酶[7],其中L-半胱氨酸脱巯基酶1(DES1)被认为是植物细胞质中产生内源H2S的关键酶[8],它可以以L-半胱氨酸为底物,分解产生H2S,并生成丙酮酸和NH3。它在植物发育的所有阶段都有表达,尤其在植物的幼苗时期和成熟时期[9]。本试验旨在通过将DES1基因转化入大白菜中白60,优化适合该品种的转化体系,以期获得抗逆性增强的大白菜新种质。
1 材料和方法
1.1 试验材料
大白菜中白60种子由山西省农科院蔬菜研究所提供;载体pET-28a-DES1和菌株LBA4404为本实验室保存;XF-246载体(含pCAMBIA1302骨架)为中国科学院遗传与发育生物学研究所曹晓风研究员惠赠,其T-DNA结构见图1;常规试剂购买于上海生工生物工程有限公司;限制性内切酶购自NEB公司。

图1 载体XF-246的T-DNA区Fig.1 The T-DNA of XF-246 vector
1.2 培养基的配制
参照吴玲玲的方法[2]并略作调整。
播种培养基:1/2MS+3%蔗糖+0.7%琼脂;
预培养培养基:MS+3%蔗糖+0.8%琼脂+2 mg·L-16-BA+0.3 mg·L-1NAA+7 mg·L-1AgNO3;
共培养培养基:MS+3%蔗糖+0.8%琼脂+2 mg·L-16-BA+0.3 mg·L-1NAA+7 mg·L-1AgNO3;
分化培养基:MS+3%蔗糖+0.8%琼脂+2 mg·L-16-BA+0.3 mg·L-1NAA+7 mg·L-1AgNO3+7.5 mg·L-1Hyg+200 mg·L-1Amp;
生根培养基:1/2MS+3%蔗糖+0.7%琼脂+0.2 mg·L-1NAA+5 mg·L-1Hyg+200 mg·L-1Amp。
1.3 表达载体XF-246-DES1的构建及鉴定
从pET-28a-DES1载体上用NcoⅠ和EcoRⅠ内切酶切取DES1片段,切胶回收后,连接于用相同内切酶消化的XF-246载体,具体操作方法参照《分子克隆》。
1.4 遗传转化基本过程
选取颗粒饱满的大白菜种子,在超净台中,以本试验优化的灭菌条件进行处理,播种于1/2 MS培养基中,在温度(23±1) ℃,光照时间16 h·d-1,光照强度3000 lx,60%的相对湿度下培养,5 d后获得无菌苗,切取带柄子叶作为外植体。用含有重组质粒XF-246-DES1的农杆菌LBA4404菌液,以本试验优化的侵染时间处理5 min;处理后外植体在共培养基中培养2 d后接种到分化培养基;21 d后,将再生芽转至生根培养基;待再生植株根系发达后,炼苗移栽。详细方法参照吴玲玲[2]。
1.5 大白菜遗传转化条件的优化
1.5.1 种子消毒时间
供试种子分成3组(每组30粒),用70%乙醇消毒30 s后,用0.1%的HgCl2分别对种子处理4、6和8 min,5 d后观察种子萌发和灭菌效果。
1.5.2 潮霉素筛选浓度
将外植体分为5组(每组30个),共培养2 d后,分别移到含有0,3.0,5.0,7.5和10.0 mg·L-1潮霉素的分化培养基中,21 d后统计再生芽分化率。
将2~3 cm的再生芽分为4组(每组30个),分别移到含有0,5.0,7.5和10.0 mg·L-1潮霉素的生根培养基中,21 d后观察生根情况。
1.5.3 菌液侵染时间
将带柄子叶预培养2 d后,分成5组(每组30个),分别在OD600为0.2~0.3的农杆菌菌液中侵染0、3、5、7和10 min,于培养基中共培养2 d,将外植体移到分化培养基中,21 d后统计抗性芽分化情况。
1.6 抗性植株的分子检测
分别提取野生型和潮霉素抗性植株的基因组DNA,以DES1引物进行PCR扩增鉴定,引物序列为Forward primer: CATGCCATGGAAGACCGCGTC;Reverse primer:CCGGAATTCTCATTCAACTGGC。提取潮霉素抗性植株和对照植株总RNA,反转录为cDNA第一链,用qRT-PCR分析目的基因DES1的表达情况,引物序列为Forward primer:ACCTCTGCACCTAATGCTCTT;Reverse primer:GATTGAGGCAACGGGTGGTAA。
2 试验结果
2.1 表达载体XF-246-DES1的构建及鉴定
以限制性内切酶NcoⅠ和EcoRⅠ对载体pET-28a-DES1进行酶切,胶回收972 bp 的DES1片段,连接于具有同样粘性末端的XF-246,连接产物转化DH5α后,以菌液为模板进行PCR,特异地扩增出972 bp大小的条带(图2A)。对鉴定正确的菌液进行小量提取质粒,双酶切鉴定,可见线性载体和972 bp大小的条带(图2B)。证明载体XF-246-DES1构建成功。

图2 重组载体XF-246-DES1的鉴定Fig.2 Identification of recombinant plasmid XF-246-DES1 注:A:含重组载体XF-246-DES1的大肠杆菌DH5α菌液PCR鉴定 M:DL2000;CK:ddH2O PCR产物(阴性对照);DES1:cDNA PCR产物(阳性对照);1~5:菌液PCR产物;B:酶切鉴定重组质粒 M:DL2000 marker;1:NcoⅠ和EcoRⅠ酶切产物。Note: A: Identification of Escherichia coli DH5α with plasmid XF-246-DES1 M: DL2000 marker; CK: Products of ddH20 with PCR(negative control); DES1: Products of cDNA with PCR(positive control); Lane1~5: Products of bacterium suspension with PCR; B: Enzyme digestion of the recombinant plasmid; M: DL2000 marker; Lane1: Digested products with NcoⅠand EcoRⅠ.
2.2 农杆菌LBA4404的转化及鉴定
将表达载体XF-246-DES1转入农杆菌LBA4404,菌液PCR鉴定,检测出大约972 bp大小的条带(图3),说明质粒XF-246-DES1已成功转入到农杆菌LBA4404中。
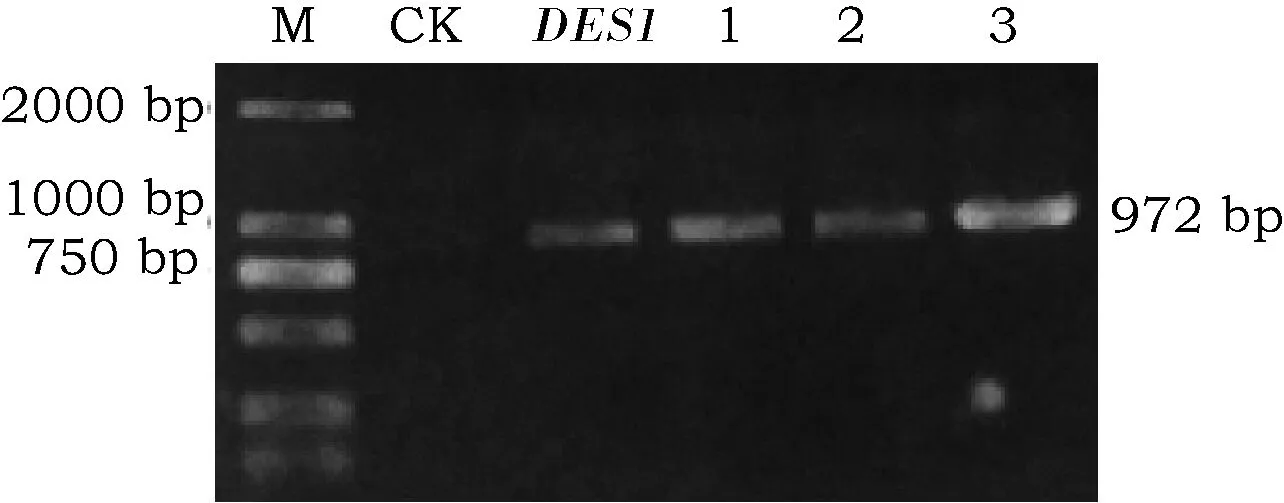
图3 含有重组质粒XF-246-DES1的农杆菌LBA4404菌液PCR鉴定Fig.3 Identification of Agrobacterium LBA4404 with plasmid XF-246-DES1 注:M:DL2000;CK:ddH2O PCR产物(阴性对照);DES1:cDNA PCR产物(阳性对照);1~3:菌液PCR产物。Note: M: DL2000 Marker; CK: Products of ddH20 with PCR(negative control); DES1: Products of cDNA with PCR(positive control); Lane 1~3: Products of bacterium suspension with PCR.
2.3 影响遗传转化的因素
2.3.1 种子的消毒时间
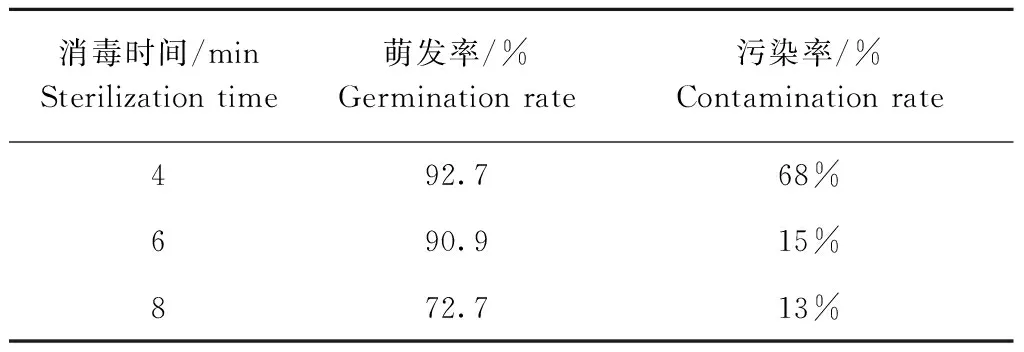
用0.1% HgCl2对种子进行不同时间的灭菌,5 d后种子的萌发状况及后续培养过程中内源菌生长情况见表1。
2.3.2 不同浓度的潮霉素对不定芽的影响
大白菜外植体对于潮霉素十分敏感,因此合适的筛选压对于抗性筛选很关键。最适潮霉素浓度筛选标准为:能有效抑制非转花苗的生长,但对转化苗无明显影响。本试验对分化培养基中潮霉素浓度进行了筛选,结果如图4和图5,随着潮霉素浓度的增大,不定芽的分化率降低;当浓度达到10.0 mg·L-1时,不定芽被完全抑制,外植体基部严重褐化甚至死亡。所以本试验选取7.5 mg·L-1潮霉素作为不定芽最适筛选浓度。
表1 HgCl2灭菌时间对种子萌发及灭菌效果的影响
Table 1 The effect of HgCl2sterilization time on seed germination and efficiency of sterilization
消毒时间/minSterilizationtime萌发率/%Germinationrate污染率/%Contaminationrate492.768%690.915%872.713%

图4 不同浓度的潮霉素对不定芽的影响Fig.4 The effect of different concentration of hygromycin on the adventitious shoot

图5 不同浓度的潮霉素对不定芽生长状况的影响Fig.5 The effect of different concentration of hygromycin on growth status of the adventitious shoot
2.3.3 不同浓度的潮霉素对不定根的影响
将获取的抗性芽接入含有不同浓度潮霉素的生根培养基中,21 d后不定根生长结果如图6,随着潮霉素浓度的增大,不定根的生长受到不同程度的影响,在5.0 mg·L-1时,根的生长明显受到了抑制,但没有完全被抑制。因此,本试验以5.0 mg·L-1作为不定根的抗生素筛选压。

图6 不同浓度的潮霉素对不定根的影响Fig.6 The effect of different concentration of hygromycin on adventitious root

图7 侵染时间对于抗性芽分化的影响Fig.7 The effect of infection time on the differentiation rate of resistant shoot
2.3.4 侵染时间的筛选
将预培养2 d的带柄子叶在菌液中分别侵染不同的时间,共培养2 d后移至分化培养基中,21 d后抗性芽分化情况见图7。当侵染时间为0 min时,无抗性芽的形成;随着侵染时间的延长,抗性芽分化率逐渐升高。在本试验的几个处理中,侵染5 min时,分化率最高;当侵染时间延长至7~10 min时,外植体逐渐褐化,抗性芽分化率降低;侵染10 min时,抗性芽的产生受到严重抑制。因此,本试验选择5 min作为菌液最佳侵染时间。
2.4 转基因植株的获得
将已拥有健壮根的再生植株在三角瓶中炼苗7 d左右,移至装有已灭菌基质土的培养钵中,用塑料膜覆盖3 d左右揭膜,正常培养。再生植株的整个生长过程如图8所示。

图8 转基因植株发育的不同时期Fig.8 The different stage of transgenic plants 注:A:外植体;B:再生植株;C:不定根;D:再生植株的移栽。Note: A: Cotyledon; B: Regenerated plants; C: Adventitious root; D: Transplantation of regenerated plants.
2.5 转基因植株的鉴定
对50个带柄子叶外植体进行基因转化,共获得了3株抗性植株,经PCR鉴定,3株抗性植株DES1基因扩增全部呈阳性,转化率为6%。经qRT-PCR分析,与野生型相比,z1,z2,z3转化植株中DES1表达量分别提高1、123、38倍;PCR和qRT-PCR分析结果分别见图9和图10。

图9 抗性植株的PCR检测Fig.9 The PCR test on the resistant plants 注:M:DL2000;D:阴性对照;CK:未转基因植株;DES1:DES1基因;z1~z3:转基因植株。Note: M: DL2000 Marker; D: Negative control; CK: The untransformed plants; DES1: DES1 gene; z1~z3: The transformed plant.

图10 不同转基因植株DES1的表达量Fig.10 The expression of DES1 in different transgenic plants 注:**表示转基因植株和未转基因植株间在0.01水平存在显著性差异。Note: **stands for significant difference between transgenic plants and untransgenic plants.
3 讨论与结论
获得无菌苗是转化过程的第一步,不同物种不同基因型背景材料间,对灭菌方式和时间敏感程度千差万别。恰当的灭菌时间是保证高萌发率低污染率的关键,灭菌时间过短,种子萌发率高,但由于杀菌不彻底,后续培养过程中易生内源菌;灭菌时间过长,种子萌发过程中的淀粉酶、蛋白酶以及脂肪酶的活性易受到抑制,导致种子活力降低。本试验对大白菜中白60种子消毒6 min,种子萌发率高且后期污染率底,而本实验室已有研究中对津育75种子灭菌4 min。这说明不同遗传背景的材料对HgCl2的敏感度差异很大。
影响大白菜遗传转化的主要因素除了种子灭菌时间外,还有预培养时间、菌液浓度、菌液侵染时间以及共培养时间等。有报道认为大白菜转化过程中对外植体预培养2~3 d[10~12]、菌液OD600=0.2~0.5[2,10,13]、共培养2~3 d[11,14,15]时,对于不同大白菜品种转化差异不大。目前只有范正棋[16]认为对青菜外植体共培养5 d转化效率较高。但农杆菌菌液侵染时间依品种不同差异较大,不能普遍适用。Bhuiyan MSU等[17]认为用农杆菌菌液侵染芥菜子叶15 min转化效果最佳;吴玲玲等[2]用菌液侵染大白菜子叶3 min得到较高的转化率;张凤兰[14]用菌液侵染白菜外植体15 min转化效率较高。本文选用5 min作为菌液最佳侵染时间,与以上结果不同[2,14,17],这可能是由于不同物种及同一物种不同基因型外植体对转化过程中侵染时间的要求存在显著差异。
合适的抗生素筛选压是转化成功的另一关键因素。潮霉素常被用作大白菜转化的筛选剂,但是大白菜对于潮霉素非常敏感。选择浓度过高,易造成外植体褐化甚至死亡;浓度过低,外植体易产生耐受性,形成大量的逃逸体,导致最后筛选转基因植株工作量加大,假阳性率明显升高。张蕊等[18]以5.0 mg·L-1潮霉素作为大白菜津育60 转化的抗生素筛选浓度;张晓东等[19]认为在分化培养基中添加10.0 mg·L-1潮霉素对大白菜抗性芽的筛选最有效。徐娟[20]以17.5 mg·L-1作为甘蓝型油菜后期对转化苗的筛选压;谢建坤等[21]探讨白菜抗虫基因转化受体体系时,潮霉素的选择浓度为20.0 mg·L-1。本试验确定中白60再生芽和根的潮霉素筛选浓度分别为7.5 mg·L-1和5.0 mg·L-1,这与之前报道中的植物材料有明显差异,可能是不同基因型背景对潮霉素的敏感度存在差异所导致。另外,本试验发现再生芽和根的筛选压也存在差异,这可能是不同组织器官的发育过程差异造成的。
总之,大白菜中白60带柄子叶转化最适条件是:对种子灭菌6 min,预培养2 d,OD600=0.2~0.3的菌液中侵染5 min,共培养2 d,分别以7.5 mg·L-1和5.0 mg·L-1潮霉素作为再生芽和根的最适抗生素筛选浓度。
[1]何玉科,R E Voorrips.发根土壤杆菌在芸薹属作物上的高效遗传转化[J].西北农林科技大学学报,1989,4:1-8.
[2]吴玲玲,刘志强,张丽萍,等.胞质雄性不育基因T1243在大白菜中的遗传转化[J].山西大学学报,2014,37(1):121-126.
[3]Jin ZP, Shen JJ, Qiao ZJ, et al. Hydrogen sulfide improves drought resistance inArabidopsisthaliana[J]. Biochem Biophys Res Comm,2011,414(3):481-486.
[4]王鸿蕉,张丽萍,刘志强,等.外源硫化氢对冷胁迫下白菜幼苗生长和光合作用的影响[J].西北植物学报,2015,35(4):780-786.
[5]Zhang LP, Pei YX, Wang HJ, et al. Hydrogen sulfide alleviates cadmium-induced cell death through restraining ROS accumulation in roots ofBrassicarapaL. ssp.pekinensis[J]. Oxidative Medicine and Cellular Longevity,2015:1-11.
[6]Qiao ZJ, Jing T, Jin ZP, et al. CDPKs enhance Cd tolerance through intensifying H2S signal inArabidopsisthaliana[J].Plant and Soil, 2016,398(1):99-110.
[7]裴雁曦.植物中的气体信号分子硫化氢:无香而立,其臭如兰[J].中国生物化学与分子生物学报,2016,32(7):721-733.
[8]LuisC R, García I, Gotor C. L-Cysteine Desulfhydrase 1 modulates the generation of the signaling molecule sulfide in plant cytosol[J]. Plant Signaling and Behavior,2013,8(5):e24007-e24007.
[9]Laureano-Marin Ana M, Garcia I, Romero LC, et al. Assessing the Transcriptional Regulation of L-Cysteine Desulfhydrase 1 inArabidopsisthaliana[J]. Front Plant Sci, 2014(5):683.
[10]杨广东,朱祯,李燕娥,等.大白菜高效遗传转化体系的建立[J].农业生物技术学报,2002,10(2):127-132.
[11]余小林,曹家树,许立奎,等.优化白菜类蔬菜遗传转化体系的研究[J].浙江大学学报(农业与生命科学版),2005,31(5):529-534.
[12]张桂华,巩振辉,张广辉.农杆菌介导的芸薹属作物遗传转化研究进展[J].西北农业大学学报,2000,28(2):80-84.
[13]范爱丽,张鲁刚.橙色大白菜遗传转化体系的初步建立[J].长江蔬菜,2012(18):10-14.
[14]张凤兰.白菜根癌农杆菌介导法基因转化体系的建立[M].全国蔬菜分子育种研讨会,2004:22-29.
[15]Yi DX, Cui L, Liu YM, et al. Transformation of Cabbage (BrassicaoleraceaL. var.capitata) with Btcry1Ba3 Gene for Control of Diamondback Moth[J]. Agricultural Sciences in China,2011,10(11):1693-1700.
[16]范正棋.青菜离体再生和农杆菌介导遗传转化影响因子的研究[D].杭州:浙江大学,2001.
[17]Bhuiyan MSU, Min SR, Jeong WJ, at al. Overexpression ofAtATM3 inBrassicajunceaconfers enhanced heavy metal tolerance and accumulation[J]. Plant Cell Tissue & Organ Culture,2011,107(1):69-77.
[18]张蕊,张爱红,常安涛,等.大白菜‘津育60’遗传转化前后组织培养条件的优化[J].中国农学通报,2011,27(4):165-168.
[19]张晓东,李利斌,宋宜现,等.大白菜高效稳定遗传转化体系的建立[J].山东农业科学,2010(2):1-7.
[20]徐娟.农杆菌介导的Ac/Ds转座系统转化甘蓝型油菜的研究[D].河南郑州大学生物工程系,2010.
[21]谢建坤,崔海瑞,舒庆尧,等.白菜抗虫基因转化受体体系的建立[J].园艺学报,2001,28(2):175-176.
(编辑:邢国芳)
The genetic transformation of Chinese cabbage withDES1 gene
Jing Qiaoli, Ma Xiaoli, Pei Yanxi*
(CollegeofLifeScience,ShanxiUniversity,Taiyuan030006,China)
[Objective]Hydrogen sulfide, considered as the third gasotrasmitter after nitric oxide and carbonic oxide, is playing a significant role in plant developmental processes and defenses. In recent years, with the increased environmental pollution, the growth and developmental processes of Chinese cabbage have been seriously inhibited. L-cysteine desulfhydrase (DES1) is an important enzyme to produce hydrogen sulfide. IntegratingDES1 into cabbage genome can not only increase its stress resistance, but provide cabbage breeding with new germplasm. [Methods]On the basis of the existed transformation system, this study using ‘zhongbai 60’ as material optimized the seed sterilization time, microbial infection time and antibiotics concentration, so as to acquire an efficient transgenic system. [Results]The results indicated that seeds disinfectived with 0.1% HgCl2for 5 min could maintain a higher rate of germination and it could also prevent the formation of endogenous bacteria simultaneously. When the explants were immersed in bacterium concentration of OD600=0.2~0.3 for 5 min and 7.5 mg·L-1and 5.0 mg·L-1were respectively resgarded as the resistant selection pressure for shoots and roots, the transformation rate reached up to 6%. [Conclusion]The results of PCR and qRT-PCR turned out thatDES1 was successfully integrated into the genome of Chinese cabbage, meanwhile, the expression ofDES1 has improved in different degrees.
Chinese cabbage, Hydrogen sulfide, Transformation, Transgenic plant
2016-09-14
2016-11-29
景巧丽(1992-),女(汉),山西晋城人,硕士研究生,研究方向:植物细胞分子生物学
*通信作者:裴雁曦,教授,博士生导师.Tel:13934559401;E-mail:peiyanxi@sxu.edu.cn
国家自然科学基金(31372085)
Q785
A
1671-8151(2017)03-0177-06

