构建模型法解决平衡转化率及平衡影响因素问题
山东 王淑芹
(作者单位:山东省德州市实验中学)
构建模型法解决平衡转化率及平衡影响因素问题

在化学反应原理中,学生虽已知道平衡常数是定量描述化学平衡状态的参数,依据平衡常数可以分析反应进行的方向,并可以比较平衡移动前后平衡转化率的增减。但由于涉及计算,而且需要从理解的层面分析影响化学平衡的因素,学生容易产生理解误区和应用误区。特别是改变条件,对反应物平衡转化率的变化以及压强影响化学平衡的定量分析是最容易出现错误的难点。为解决这一难点,并强化化学平衡常数在定量分析化学平衡问题中的重要性,我们可以用构建模型法解决以上问题。具体方案如下:
一、以教材中的典型可逆反应为模型
从不同角度认识其反应特点,掌握各个因素对这些反应平衡体系的影响结果。如:
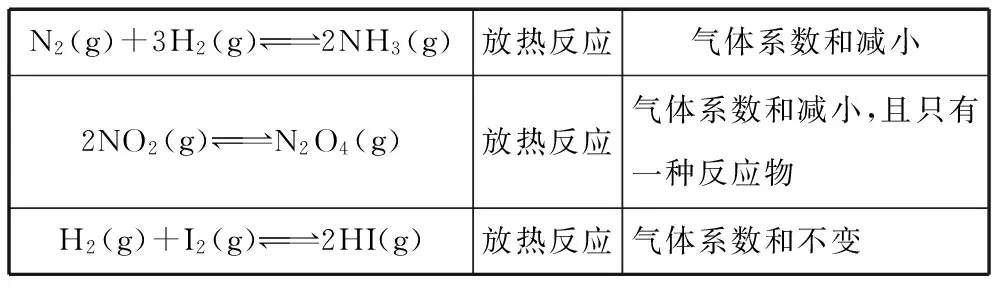
N2(g)+3H2(g)2NH3(g)放热反应气体系数和减小2NO2(g)N2O4(g)放热反应气体系数和减小,且只有一种反应物H2(g)+I2(g)2HI(g)放热反应气体系数和不变
二、强化平衡常数的计算,在计算中论证有关结论,构建思维模型
【模型一】现以对“增大一种反应物的浓度,能够提高另一种反应物的平衡转化率,而自身的平衡转化率却减小”的理解与应用为例说明。
( )
A.减小NO2的浓度
B.增加NO2的浓度
误解:增大一种反应物的浓度,平衡正向移动,使另一种反应物的平衡转化率增大,而自身的平衡转化率减小,误判为A正确。
误解分析:盲目套用规律,忽略了该方程式中反应物只有一种,而且反应前后气体的总物质的量发生变化,因此在平衡正向移动的过程中,所加入的NO2的反应程度与原来不同。即新平衡与原平衡相比,不仅有浓度对平衡的影响,还产生了压强因素对平衡的影响。
正确答案:B
模型构建:应用平衡常数进行计算论证,发现并总结规律。
假设一定温度下,在体积为2 L的容器中用2 mol NO2建立平衡时,NO2的平衡转化率为50%,现向平衡体系中再加入2 mol NO2,则
c0/mol·L-1___________1___________0
Δc/mol·L-1___________0.5___________0.25
c平/mol·L-1___________0.5___________0.25
∴K=0.25÷0.52=1
再充入2 mol NO2,则相当于在原条件下,用4 mol NO2建立平衡,如果NO2的平衡转化率不变,则
c0/mol·L-1___________2___________0
Δc/mol·L-1___________1___________0.5
c末/mol·L-1___________1___________0.5
∴Q=0.5÷12=0.5 结论:在温度、体积不变的条件下,增大NO2的浓度,NO2的平衡转化率增大。 质疑:该规律是否具有普遍性呢?下面以氨气的分解为例再进行论证: c0/mol·L-1___________2___________0___________0 Δc/mol·L-1___________0.2___________0.1___________0.3 c平/mol·L-1___________1.8___________0.1___________0.3 ∴K=0.33×0.1÷1.82=1/1 200 再充入2 mol NH3,相当于用4 mol NH3建立平衡,假设NH3的平衡转化率不变,则 c0/mol·L-1___________4___________0___________0 Δc/mol·L-1___________0.4___________0.2___________0.6 c末/mol·L-1___________3.6___________0.2___________0.6 此时,Q=0.63×0.2÷3.62=1/300>K,即此时反应将逆向进行,故达新平衡后,NH3的平衡转化率将比原来更小。 综上,可构建该类问题的结论模型:对只有一种反应物的可逆反应建立的平衡,在温度、体积不变时,增大反应物浓度,平衡正向移动,而反应物的平衡转化率则与方程式中的气体系数和有关:若气体系数和减小,则平衡转化率增大;若气体系数和增大,则平衡转化率减小。 [理论分析]以例2为例,再充入2 mol NO2,可以认为是将两个完全相同的平衡体系合并在一起,并保持体积不变,实际相当于原平衡的体积减小到原来的1/2。结合“加压,平衡向气体系数和减小的方向移动”,则得出反应物平衡转化率增大的结论。 通过化学平衡常数的计算论证,不仅可以使学生掌握基本计算思路,提高计算技巧,还可以在论证中加深对基本理论的理解和认识,强化学生从定量角度分析化学平衡问题的意识,从而减少思维误区和知识应用误区,并且提高学生对问题的应变能力。例如对上述问题,如果是反应前后方程式中的气体系数和相等,则反应物的平衡转化率将不发生变化。 【模型二】压强影响化学平衡的定量分析 ( ) A.m+n>p B.A的转化率降低 C.平衡向逆反应方向移动 D.E的体积分数增加 误解:设原平衡中E的浓度为c,则新平衡中E的浓度为1.9c>c,故平衡正向移动,A的转化率增大,E的体积分数增加,即D项正确,BC错误。根据加压(减小体积),平衡向气体系数和减小的方向移动可知,m+n>p,故A项正确。 正解:假设原平衡体系的体积为V,E的平衡浓度为c,则原平衡体系中E的物质的量为cV。则改变条件后,体积为V/2,浓度为1.9c,即E的物质的量为1.9c×V/2=0.95cV 答案:BC 误区分析:盲目从浓度的大小判断平衡移动导致的产物增减,而忽略了浓度的变化既受平衡移动的影响,还直接受压强(体积)变化的影响。 模型构建:平衡移动的结果,如果使反应产物的物质的量增加(即:使反应物的物质的量减少),则称为平衡正向移动;反之,称为平衡向逆反应方向移动。 只有在体积不变的条件下,组分浓度的增减才与其物质的量的增减保持一致,浓度的增减才直接体现平衡的移动方向。 气体体积/Lc(Y)/mol·L-1温度/℃1241001.000.750.532001.200.900.633001.301.000.70 下列说法正确的是 ( ) A.m>n B.Q<0 C.温度不变,压强增大,Y的质量分数减少 D.体积不变,温度升高,平衡向逆反应方向移动 (作者单位:山东省德州市实验中学)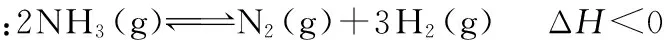
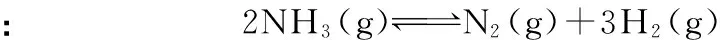
跟踪训练