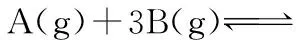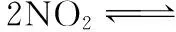巧用等效平衡解答疑难试题
宁夏 王开山
(作者单位:宁夏育才中学)
巧用等效平衡解答疑难试题

一、等效平衡原理
对于同一个可逆反应,在相同的条件下(恒温恒容或恒温恒压),不管是从正反应开始,还是从逆反应开始,或从正反应和逆反应同时开始,达到平衡时,反应混合物中同种物质的百分含量相同,这样的平衡称为等效平衡。
二、等效平衡的分类及判断方法

对于反应mA(g)+nB(g)pC(g)+qD(g)条件m+n≠p+q时m+n=p+q时恒温、恒容一边倒后数值完全相同才建立等效(等同)平衡,即“等量等效”恒温、恒压一边倒后数值成比例就建立等效平衡,即“等比等效”一边倒后数值成比例就建立等效平衡,即“等比等效”
说明:
1.“一边倒”(完全转化)指的是把一边“归零”, 通过可逆反应的化学计量数比换算成另一半边物质的物质的量(浓度)。
2.等效指的是达到平衡后同种组分百分含量(物质的量分数、质量分数、体积分数)相同。也有可能同种组分的物质的量、质量、体积、物质的量浓度也相同。
三、疑难试题解答
1.解答加料问题

①4 mol A+2 mol B ②2 mol A+1 mol B+2 mol C
③2 mol C+1 mol B ④2 mol C
⑤1 mol A+0.5 mol B+1 mol C
(1)达到平衡后,C的物质的量浓度仍是kmol/L的是___________ 。
(2)若令a、b、c分别代表初始加入的A、B、C的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时完全相同,填写:
Ⅰ.若a=0,b=0,则c=___________ 。
Ⅱ.若a=0.5,b=0,则b=___________ ,c=___________ 。
Ⅲ.a、b、c的取值必须满足的一般条件是___________ ;___________ 。(用两个方程式表示,一个只含a、c,另一个只含b、c)
解析:(1)该反应m+n≠p+q且条件为恒温、恒容,所以要满足“等量等效”。将②③④⑤的加料方式全部进行“一边倒”转化为反应物A和B的量后,只有④⑤的加料方式与2 mol A和1 mol B的加料方式完全一致。(2)根据 “一边倒”的方式进行转化,即amol A+bmol B+cmol C等价转化为amol A+bmol B+(cmol A+c/2 mol B)。
答案:(1)④⑤
(2)Ⅰ.c=2 Ⅱ.b=0.25c=1.5 Ⅲ.a+c=2b+c/2=1
2.解答平衡移动方向问题
( )
A.均减半________________ B.均加倍
C.均增加1 mol___________D.均减少1 mol
解析:容积可变,说明是恒温、恒压条件,满足“等比等效”。A项,“均减半”后A、B、C的物质的量分别为2 mol、1 mol 和2 mol,满足“等比等效”,平衡不会移动;B项,“均加培”后A、B、C的物质的量分别为8 mol、4 mol和8 mol,满足“等比等效”,平衡不会移动;C项,“均增加1 mol”后A、B、C的物质的量分别为5 mol、3 mol和5 mol,相当于在5 mol、2.5 mol和5 mol的基础上又增加了0.5 mol B,平衡向右移动;D项,“均减小1 mol”后A、B、C的物质的量分别为3 mol、1 mol和3 mol,相当于在3 mol、1.5 mol和3 mol的基础上减少了0.5 mol B,平衡向左移动。
答案:C
3.解答方程式计量系数问题

( )
A.1___________B.2
C.3___________D.任意值
解析:分两种情况分析:
(1)当反应前后气体体积不相等,则两种投料方式换算到同一边后各组分应完全相同(即恒温恒容时“等量等效”):
起始量/mol___________0.9___________0.3___________2.1
等效于/mol___________0.9+6.3/x___________0.3+2.1/x___________0
即0.9+6.3/x=3 0.3+2.1/x=1
解得x=3
(2)当反应前后气体体积相等,则两种投料方式换算到同一边后各组分应完全相同(即恒温恒压时“等比等效”):
起始量/mol___________0.9___________0.3___________2.1
等效于/mol___________0.9+6.3/4___________0.3+2.1/4___________0
即0.9+6.3/4 = 2.475 0.3+2.1/4=0.825
2.475∶0.825=3∶1,与起始量的投料比相同,故x=4成立。
答案:C
4.解答反应物转化率问题

( )
A.x>y________________B.x C.x=y___________D.不能确定 解析:先建立等效平衡模型,即假设原容器的体积可变,当再充入1 mol N2O4后重新建立起的平衡和原平衡等效,此时NO2的转化率依然为x%。当体积不发生变化时,在原平衡的基础上要缩小容器的体积,即增大了压强,该反应正反应方向为气体体积缩小的方向,平衡向正反应方向移动,NO2的转化率增大,即x 答案:B 5.解答反应热的问题 6.解答容器体积大小问题 例6 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为aL。若打开K2,平衡后B容器的体积缩至0.4aL,则打开K2之前,气球B体积为___________ L。 (作者单位:宁夏育才中学)