板蓝根化学成分及抗氧化活性的研究
闫 峻,赵春芳,李伯平,刘志强,郭冬发,郑 重
(1.核工业北京地质研究院,北京 100029;2.吉林大学,吉林 长春 130021;3.中国科学院长春应用化学研究所,吉林 长春 130022)
板蓝根化学成分及抗氧化活性的研究
闫 峻1,赵春芳2,李伯平1,刘志强3,郭冬发1,郑 重3
(1.核工业北京地质研究院,北京 100029;2.吉林大学,吉林 长春 130021;3.中国科学院长春应用化学研究所,吉林 长春 130022)
采用高效液相色谱-串联质谱法(HPLC-MS/MS)和直接进样的电喷雾串联质谱法(ESI-MS/MS)分析板蓝根乙酸乙酯提取物、正丁醇提取物和95%乙醇提取物的化学成分。同时,采用铁离子还原能力法(FRAP)评价板蓝根的抗氧化活性,并通过自由基清除能力法(DPPH)对FRAP法的测试结果进行验证。结果表明:在板蓝根乙酸乙酯提取物、正丁醇提取物和95%乙醇提取物中共鉴别出吲哚类、喹唑酮类、有机酸类、核苷类、嘌呤类、氨基酸类、黄酮类以及糖类等28个化合物。研究发现,板蓝根抗氧化活性部位主要集中在极性较低的化学组分中,吲哚类、喹唑酮类和有机酸类化合物是其主要的有效成分。该方法简便、快捷、灵敏,可为中药化学成分分析和抗氧化活性评价提供方法参考。
板蓝根;化学成分;高效液相色谱-串联质谱法(HPLC-MS/MS);电喷雾串联质谱(ESI-MS/MS);抗氧化活性
板蓝根(Radix Isatidis)是十字花科植物菘蓝(IsatisindigoticaFort.)的干燥根,为临床常用中药,具有清热解毒、凉血利咽之功效,常用于治疗温毒发斑、舌绛紫暗、痄腮、喉痹、烂喉丹痧、大头瘟疫、丹毒、痈肿等症状[1]。已报道的板蓝根化学成分主要包括吲哚类、喹唑酮类、芥子苷类、有机酸类和氨基酸类化合物等[2]。
现代研究表明,自由基会损伤机体,与许多疾病的发生发展密切相关。传统的合成抗氧化剂虽然具有较强的抗氧化能力,但是长期服用会产生一定的毒性,甚至会致畸和致癌。因此,寻找能够有效清除自由基的中药或天然产物对于保护人类健康具有重要意义[3]。板蓝根等清热解毒药物具有一定的抗氧化活性,但目前主要集中在对其中不饱和脂肪酸类和多糖类成分的研究[4],而未见通过对板蓝根抗氧化活性组分进行筛选,继而确定其有效成分的报道。
中药化学成分研究的传统方法是用溶剂分配和柱色谱法将其逐一分离为纯的单一化合物,然后采用化学方法对其进行结构鉴定,该方法操作繁琐、分离效率和自动化程度低,且对微量组分的分离困难。目前,通常采用高效液相色谱法分离中药的有效化学成分,质谱法测定分子结构[5]。高效液相色谱-质谱法可以同时完成成分分离和结构鉴定,具有高效、快速、灵敏等优点,是中药及天然产物有效成分定性定量分析的有效方法。电喷雾串联质谱法具有样品处理简单、分析速度快、灵敏度高、重现性好等特点,现已广泛用于中药及天然产物化学成分的分析[6]。
本研究拟采用高效液相色谱-串联质谱法(HPLC-MS/MS)分析板蓝根乙酸乙酯提取物和板蓝根正丁醇提取物的化学成分,采用电喷雾串联质谱法(ESI-MS/MS)分析板蓝根95%乙醇提取物的化学成分,并采用铁离子还原能力法(FRAP)对板蓝根抗氧化活性进行评价,通过自由基清除法(DPPH)对FRAP法的评价结果进行验证,以期为板蓝根药效物质基础和谱效关系的研究、质量控制标准的制定提供依据。
1 实验部分
1.1 主要仪器与装置
Waters 2695高效液相色谱仪:美国Waters公司产品;Finnigan LCQ离子阱质谱仪:美国Finnigan公司产品;自动酶标仪:奥地利CliniBio公司产品。
1.2 主要药材与试剂
板蓝根药材:购于北京同仁堂长春药店,经长春中医药大学王淑敏教授鉴定为十字花科植物菘蓝(IsatisindigoticaFort.)的干燥根;靛蓝和靛玉红对照品:由中国药品生物制品检定所提供;胞苷、腺嘌呤、尿苷、鸟苷、腺苷、苯丙氨酸、脯氨酸、精氨酸和苹果酸对照品:美国Sigma公司产品;1,1-二苯基-2-三硝基苯肼、2,4,6-三吡啶基三嗪、抗坏血酸:美国Sigma公司产品;甲醇、乙酸:均为色谱纯,美国Fisher公司产品;水为18.2 MΩ·cm超纯水;其他试剂均为分析纯。
1.3 样品制备
称取10 g板蓝根药材,加水煎煮2次,每次1 h,过滤,合并滤液,浓缩至适量;然后加入3倍量乙醇,搅匀,静置24 h,过滤,减压浓缩至稠膏状,得板蓝根总提取物。将板蓝根总提取物加水溶解,用乙酸乙酯萃取,减压浓缩并干燥,得板蓝根乙酸乙酯提取物;用正丁醇萃取乙酸乙酯萃取后的部分,减压浓缩并干燥,得板蓝根正丁醇提取物;将正丁醇萃取后的部分干燥,加入95%乙醇溶解,减压浓缩并干燥,得板蓝根95%乙醇提取物。取板蓝根乙酸乙酯、正丁醇和95%乙醇提取物各0.5 g,分别置于10 mL容量瓶中,加50%甲醇定容至刻度,摇匀,过0.45 μm滤膜,即得板蓝根乙酸乙酯提取物、正丁醇提取物和95%乙醇提取物的供试品溶液。
1.4 实验条件
1.4.1 板蓝根乙酸乙酯提取物的液相色谱-质谱分析条件 色谱条件:色谱柱为Kromasil C18分析柱(4.6 mm×250 mm×5 μm);流动相由0.15%乙酸-水溶液(A)和甲醇(B)组成;线性梯度洗脱,0~45 min、40%~100%B,45~60 min、100%B;流速0.8 mL/min;柱温25 ℃;进样量10 μL;检测波长254 nm。
质谱条件:大气压化学电离离子源(APCI),正、负离子模式检测,质量扫描范围m/z50~1 000,气化温度450 ℃,毛细管温度150 ℃,喷雾电压4.0 kV,鞘气(N2)流速0.9 L/min,辅助气(N2)流速1.5 L/min。
1.4.2 板蓝根正丁醇提取物的液相色谱-质谱分析条件 色谱条件:色谱柱为Kromasil C18分析柱(4.6 mm×250 mm×5 μm);流动相由0.15%乙酸-水溶液(A)和甲醇(B)组成;线性梯度洗脱,0~10 min、5%B,10~20 min、5%~20%B,20~30 min、20%~30%B,30~50 min、30%~35%B,50~65 min、35%~55%B;流速0.8 mL/min;柱温25 ℃;进样量10 μL;检测波长265 nm。
质谱条件:电喷雾电离离子源(ESI),正、负离子模式检测,质量扫描范围m/z50~1 000,毛细管温度250 ℃,喷雾电压4.5 kV,鞘气(N2)流速0.9 L/min,辅助气(N2)流速3.0 L/min。
1.4.3 板蓝根95%乙醇提取物的串联质谱分析条件 电喷雾电离离子源;正、负离子模式检测;质量扫描范围m/z50~1 000;毛细管温度200 ℃;喷雾电压4.5 kV;鞘气(N2)流速0.75 L/min;将板蓝根95%乙醇提取物加甲醇稀释后采用流动注射泵进样,进样流速5 μL/min。
1.5 板蓝根抗氧化活性研究
1.5.1 铁离子还原能力法(FRAP) 将板蓝根乙酸乙酯、正丁醇和95%乙醇提取物分别用甲醇稀释,配制成0.1 g/L溶液,作为待测样品溶液。向抗坏血酸(Vc)对照品中加入甲醇,配制成500 μmol/L对照品溶液。将0.3 mol/L醋酸钠缓冲溶液(pH 3.6)、0.01 mol/L 2,4,6-三吡啶基三嗪(TPTZ)溶液(溶解在0.04 mol/L HCl中)和0.02 mol/L三氯化铁溶液以10∶1∶1(V∶V∶V)比例混合,配制成FRAP试剂。取10 μL Vc对照品溶液或待测样品溶液加入到96孔板中,然后迅速加入300 μL FRAP试剂,在37 ℃用自动酶标仪分别测定0 min和4 min的吸光度值,平行测定3次。FRAP法的测量结果以相当于500 μmol/L Vc抗氧化能力来计算,示于式(1):
FRAP(μmol/L)=
1.5.2 自由基清除能力法(DPPH) 将板蓝根乙酸乙酯、正丁醇和95%乙醇提取物分别用甲醇稀释,在0.001~10 g/L范围内配制成10个不同浓度的待测样品溶液。向1,1-二苯基-2-三硝基苯肼(DPPH)中加入甲醇配制成浓度为65 μmol/L的溶液。将20 μL甲醇和100 μL DPPH溶液混合作为A0;20 μL不同浓度的待测样品溶液和100 μL DPPH溶液混合作为Ai;20 μL不同浓度的待测样品溶液和100 μL甲醇混合作为Aj。以上3种混合溶液避光放置30 min,用自动酶标仪在515 nm波长下分别测定其吸光度值,每个样品平行测定3次,计算不同浓度样品对DPPH自由基的清除率(SA),其公式示于式(2):

(2)
以清除率对各样品浓度做标准曲线,得线性回归方程SA=aC+b,可计算出SA=50%时的样品浓度C,即为该样品的IC50值。
2 结果与讨论
2.1 板蓝根乙酸乙酯提取物化学成分的分析
板蓝根乙酸乙酯提取物的色谱图和总离子流图示于图1。
板蓝根乙酸乙酯提取物化学成分的LC-MS/MS数据,以及对应的化合物列于表1。

图1 板蓝根乙酸乙酯提取物的液相色谱图(a),以及正离子(b)和负离子(c)模式下的总离子流图Fig.1 LC/MS chromatograms (a), positive (b) and negative (c) TIC of acetate extract from Radix Isatidis
表1 板蓝根乙酸乙酯提取物的LC-MS/MS数据
Table 1 LC-MS/MS data of acetate extract from Radix Isatidis

序号tR/minm/z(+)m/z(-)MS2化合物110.59166[M+H]+166∶148[M+H-H2O]+,120[M+H-HCOOH]+N-醛基氨基苯甲酸N-Formylanthranilicacid[7]211.50267[M+H]+267∶249[M+H-H2O]+,239[M+H-CO]+,146[M+H-C6H5COOH]+3-羧基苯基喹唑酮3-(2'-Carboxyphenyl)-4(3H)-quinazolinone[7]312.81137[M-H]-137∶93[M-H-CO2]-水杨酸Salicylicacid[8]423.76249[M+H]+249∶221[M+H-CO]+色胺酮Tryptanthrin[7]528.87263[M+H]+263∶235[M+H-CO]+,219[M-H-CO2]+靛蓝Indigo*634.35263[M+H]+263∶235[M+H-CO]+,219[M-H-CO2]+靛玉红Indirubin*737.40279[M+H]+279∶223[M+H-2CO]+,205[M+H-2CO-H2O]+羟基靛玉红Hydroxylindirubin[8]846.37277[M-H]-277∶259[M-H-H2O]-,233[M-H-CO2],217[M-H-CH3COOH]-亚麻酸Linolenicacid[7]
注:*表示化合物5和6分别与相应的对照品具有相同的保留时间、质荷比和MS2谱
2.2 板蓝根正丁醇提取物化学成分的分析
板蓝根正丁醇提取物的色谱图和总离子流图示于图2。
板蓝根正丁醇提取物化学成分的LC-MS/MS数据,以及对应的化合物列于表2。
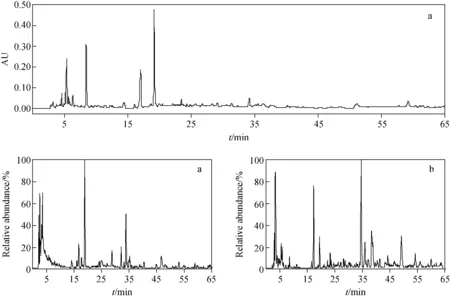
图2 板蓝根正丁醇提取物的液相色谱图(a),以及正离子(b)和负离子(c)模式下的总离子流图Fig.2 LC/MS chromatograms (a), positive (b) and negative (c) TIC of n-BuOH extract from Radix Isatidis
表2 板蓝根正丁醇提取物的LC-MS/MS数据
Table 2 LC-MS/MS data ofn-BuOH extract from Radix Isatidis

序号tR/minm/z(+)m/z(-)MS2化合物94.51244[M+H]+244∶112[M+H-rib]+胞苷Cytidine*105.19136[M+H]+—腺嘌呤Adenine*115.44152[M+H]+—鸟嘌呤Guanine*128.28245[M+H]+245∶113[M+H-rib]+尿苷Uridine*1316.80284[M+H]+284∶152[M+H-rib]+鸟苷Guanosine*1417.77164[M-H]-164∶147[M-H-NH3]-,苯丙氨酸Phenylalanine*118[M-H-HCOOH]-1518.99268[M+H]+268∶136[M+H-rib]+腺苷Adenosine*1635.55593[M-H]-593∶473[M-H-CH2OH(CHOH)2CHO]-,皂草苷Saponarin[9-10]431[M-H-glc]-,341[M-H-glc-CH2OHCHOHCHO]-,311[M-H-glc-CH2OH(CHOH)2CHO]-1737.61623[M-H]-623∶503[M-H-CH2OH(CHOH)2CHO]-,异金雀花素-7-O-吡喃葡萄糖苷461[M-H-glc]-,Isoscoparin-7-O-glucopyranoside[10]371[M-H-glc-CH2OHCHOHCHO]-,341[M-H-glc-CH2OH(CHOH)2CHO]-1844.13593[M-H]-593∶341[M-H-glc-CH2OHCHOHCHO]-,异牡荆素-6″-O-吡喃葡萄糖苷311[M-H-glc-CH2OH(CHOH)2CHO]-Isovitexin-6″-O-glucopyranoside[9]1946.46623[M-H]-623∶371[M-H-glc-CH2OHCHOHCHO]-,异金雀花素-6″-O-吡喃葡萄糖苷341[M-H-glc-CH2OH(CHOH)2CHO]-Isoscoparin-6″-O-glucopyranoside[11]2059.27431431∶341[M-H-CH2OHCHOHCHO]-,异牡荆素Isovitexin[9-10]311[M-H-CH2OH(CHOH)2CHO]-2160.43461461∶371[M-H-CH2OHCHOHCHO]-,异金雀花素Isoscoparin[9-10]341[M-H-CH2OH(CHOH)2CHO]-
注:*表示化合物9~15分别与相应的对照品具有相同的保留时间、质荷比和MS2谱
2.3 板蓝根95%乙醇提取物化学成分的分析
板蓝根95%乙醇提取物的一级全扫描电喷雾质谱图示于图3。可知,在正离子模式下,板蓝根95%乙醇提取物主要有m/z104、116、130、175、180、365和381离子;在负离子模式下,主要有m/z133、341离子。
板蓝根95%乙醇提取物化学成分的ESI-MSn数据,以及对应的化合物列于表3。

注:a.正离子模式;b.负离子模式图3 板蓝根95%乙醇提取物的一级全扫描质谱图Fig.3 Full scan electrospray ionization mass spectrometry of 95% ethanol extract from Radix Isatidis
表3 板蓝根95%乙醇提取物的ESI-MSn数据
Table 3 ESI-MSndata of 95% ethanol extract from Radix Isatidis
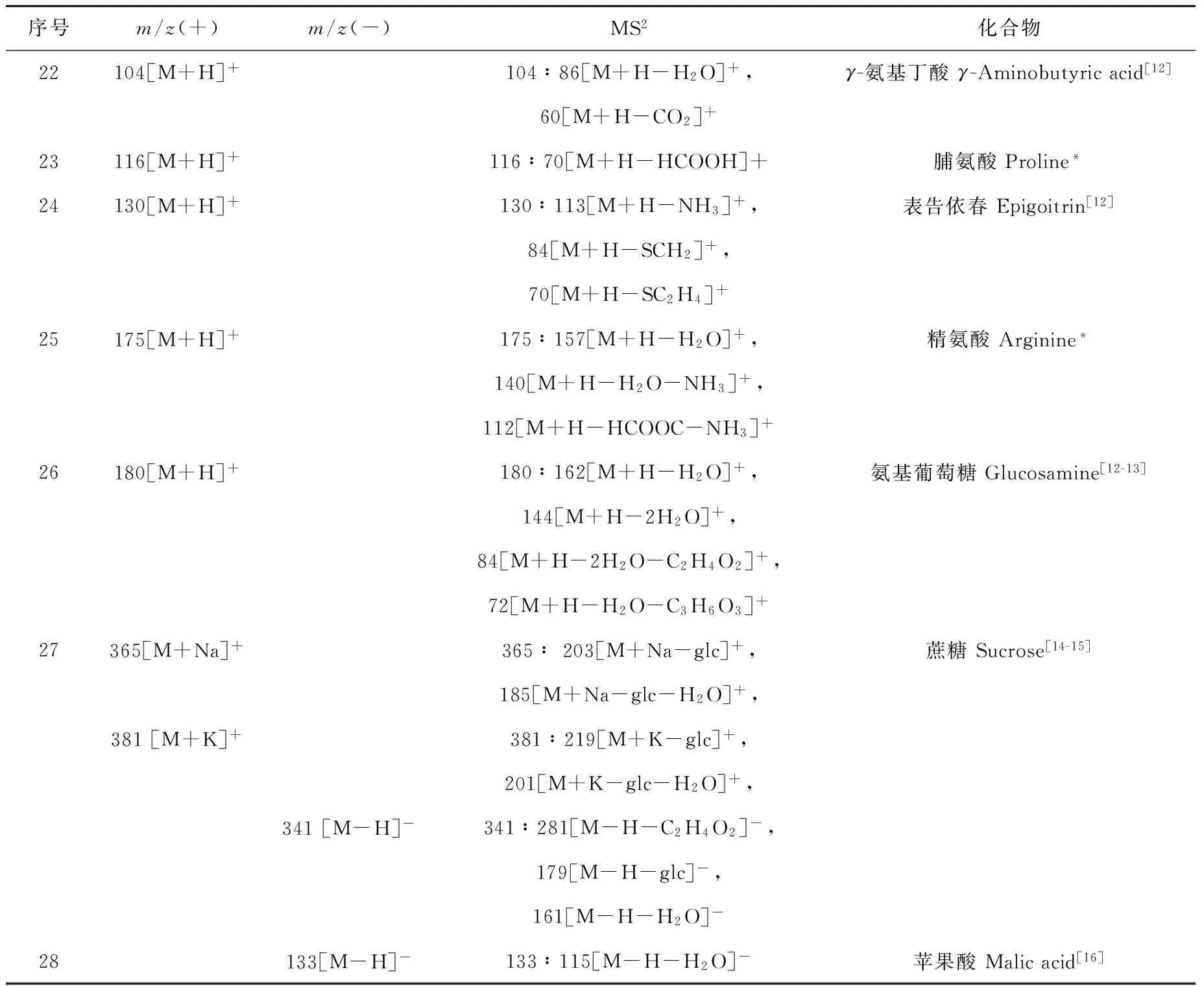
序号m/z(+)m/z(-)MS2化合物22104[M+H]+104∶86[M+H-H2O]+,γ-氨基丁酸γ-Aminobutyricacid[12]60[M+H-CO2]+23116[M+H]+116∶70[M+H-HCOOH]+脯氨酸Proline*24130[M+H]+130∶113[M+H-NH3]+,表告依春Epigoitrin[12]84[M+H-SCH2]+,70[M+H-SC2H4]+25175[M+H]+175∶157[M+H-H2O]+,精氨酸Arginine*140[M+H-H2O-NH3]+,112[M+H-HCOOC-NH3]+26180[M+H]+180∶162[M+H-H2O]+,氨基葡萄糖Glucosamine[12-13]144[M+H-2H2O]+,84[M+H-2H2O-C2H4O2]+,72[M+H-H2O-C3H6O3]+27365[M+Na]+365∶203[M+Na-glc]+,蔗糖Sucrose[14-15]185[M+Na-glc-H2O]+,381[M+K]+381∶219[M+K-glc]+,201[M+K-glc-H2O]+,341[M-H]-341∶281[M-H-C2H4O2]-,179[M-H-glc]-,161[M-H-H2O]-28133[M-H]-133∶115[M-H-H2O]-苹果酸Malicacid[16]
注:*表示化合物23和25分别与相应的对照品具有相同的质谱断裂规律
2.4 板蓝根抗氧化活性的研究
FRAP值的大小可以反映样品对铁离子还原能力的强弱。FRAP值越大,说明该样品对铁离子的还原能力越强,即抗氧化活性越强;反之越弱。样品IC50值可以反映该样品对DPPH自由基清除能力的强弱。IC50值越小,表明该样品对DPPH自由基的清除能力越强,即抗氧化能力越强;反之越弱[17]。板蓝根乙酸乙酯提取物、正丁醇提取、95%乙醇提取物和总提取物的抗氧化活性结果列于表4。可知,板蓝根不同化学组分抗氧化活力强弱为乙酸乙酯提取物>总提取物>正丁醇提取物>95%乙醇提取物。板蓝根乙酸乙酯提取物的抗氧化活性最强,说明其有效成分主要集中在极性较低的化学组分中。

表4 板蓝根提取物的抗氧化活性Table 4 Antioxidant activity of extract from Radix Isatidis
2.5 讨论
本研究采用高效液相色谱-串联质谱法分析板蓝根乙酸乙酯提取物、正丁醇提取物的化学成分,采用电喷雾串联质谱法分析板蓝根95%乙醇提取物的化学成分。在板蓝根乙酸乙酯、正丁醇和95%乙醇提取物中共鉴别出28个化合物,其中,化合物1、3、8和28为有机酸类化合物,化合物2和4为喹唑酮类化合物,化合物5、6和7为吲哚类化合物,化合物9、12、13和15为核苷类化合物,化合物10和11为嘌呤类化合物,化合物14、22、23和25为氨基酸类化合物,化合物16、17、18、19、20和21为黄酮类化合物,化合物24为含硫类化合物。
化合物5与6(m/z263),化合物16与18(m/z593),化合物17与19(m/z623)互为同分异构体。化合物5与6均为靛苷水解产物,在一级全扫描质谱中具有相同的质荷比,在二级串联质谱中也具有相同的质谱断裂规律,需要参照对照品的保留时间进行鉴别;化合物16与18,化合物17与19分别为异牡荆素和异金雀花素结合一分子葡萄糖氧苷所形成的化合物,在一级全扫描质谱中具有相同的质荷比,但在二级串联质谱中的质谱断裂规律有一定差异,可参考文献[9-11]进行鉴别。
抗氧化活性评价结果表明,板蓝根抗氧化活性成分主要集中在极性较低的化学组分中。结合化学成分研究数据可知,板蓝根抗氧化活性的主要有效成分为吲哚类、喹唑酮类和有机酸类化合物,糖类和氨基酸类化合物的抗氧化活性较弱。
[1] 国家药典委员会.中华人民共和国药典(二部)[M]. 北京:中国医药科技出版社,2015:205-206.
[2] 肖姗姗,金郁,孙毓庆. 板蓝根化学成分、药理及质量及控制研究进展[J]. 沈阳药科大学学报,2003,20(6):455-459.
XIAO Shanshan, JIN Yu, SUN Yuqing. Rencent progress in the studies of chemical constituents, pharmacological effects and quality control methods on the roots ofIsatisindigotica[J]. Journal of Shenyang Pharmaceuical University, 2003, 20(6): 455-459(in Chinese).
[3] 孙丽萍,王大仟,张智武. 11种天然植物提取物对DPPH自由基的清除作用[J]. 食品科学,2009,30(1):45-47.
SUN Liping, WANG Daqian, ZHANG Zhiwu. 2, 2-Dipheny-1-picrylhydrazyl radical scavenging activites of eleven spenies of natural plant extracts[J]. Food Science, 2009, 30(1): 45-47(in Chinese).
[4] 陈瀚,李进,李祥,等. 板蓝根不同提取部位的体外抗氧化活性[J]. 中国实验方剂学杂志,2012,18(9):184-186.
CHEN Han, LI Jin, LI Xiang, et al. Antioxidation of different extracts fromIsatidisindigoticainvitro[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(9): 184-186(in Chinese).
[5] 王晓良,陈明华,王芳,等. 板蓝根水提取物的化学成分研究[J]. 中国中药杂志,2013,38(8):1 172-1 182.
WANG Xiaoliang, CHEN Minghua, WANG Fang, et al. Chemical consitituents from root ofIsatisindigotica[J]. China Journal of Chinese Materia Medica, 2013, 38(8): 1 172-1 182(in Chinese).
[6] 周慧,宋凤瑞,刘志强,等. 刺五加叶的HPLC-UV和ESI-MS指纹图谱研究[J]. 质谱学报,2008,29(6):321-326.
ZHOU Hui, SONG Fengrui, LIU Zhiqiang, et al. The fingerprints of leaves ofAcanthopanaxSenticosusby HPLC-UV and ESI-MS[J]. Journal of Chinese Mass Spectrometry Society, 2008, 29(6): 321-326(in Chinese).
[7] MHON T, PLITZKO I, HAMBURGER M. A comprehensive metabolite profiling of Isatis tinctoria leaf extracts[J]. Phytochemistry, 2009, 70(7): 924-934.
[8] XIAO S S, BI K S, SUN Y Q. Identification of chemical constituents in the root ofIsatisindigoticaFort. by LC/DAD/ESI/MS/MS[J]. Journal of Liquid Chromatography, 2007, 30(1): 73-85.
[9] DENG X Y, GAO G H, ZHENG S N, et al. Qualitative and quantitative analysis of flavonoids in the leaves ofIsatisindigaticaFort. by ultra-performance liquid chromatography with PDA and electrospray ionization tandem mass spectrometry detection[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 48(3): 562-567.
[10]FERRERS F, ANDRADE P B, VALENTAO P, et al. Further knowledge on barley (HordeumvulgareL. leavesO-glycosyl-C-glycosyl flavones by liquid chromatography-UV diode-array detection-electrospray ionization mass spectrometry[J]. Journal of Chromatography A, 2008, 1 182(1): 56-64.
[11]FERRERS F, GIL-IZQUIERDO A, ANDRADE P B, et al. Characterization ofC-glycosyl flavonesO-glycosylated by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2007, 1 161(1/2): 214-223.
[12]刘舒,闫峻,李慧琳,等. 板蓝根化学成分的质谱研究[J]. 高等学校化学学报,2010,31(6):1 143-1 147.
LIU Shu, YAN Jun, LI Huilin, et al. Studies on chemical constituents of compoundIndigowoadRootGranuleby mass spectrometry[J]. Chemical Journal of Chinese Universities, 2010, 31(6): 1 143-1 147(in Chinese).
[13]LU W Y, KIMBALL E, RABINOWITZ J D. A high-performance liquid chromatography-tandem mass spectrometry method for quantitation of nitrogen-containing intracellular metabolites[J]. Journal of the American Society for Mass Spectrometry, 2006, 17(1): 37-50.
[14]李锐,付铁军,及元乔,等. 膜荚黄芪与蒙古黄芪化学成分的高效液相色谱-质谱研究[J]. 分析化学,2005,33(12):1 676-1 680.
LI Rui, FU Tiejun, JI Yuanqiao, et al. A study of aStragalusmongholicusand aStragalusmenbranaceusby high performance liquid chromatography-mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2005, 33(12): 1 676-1 680(in Chinese).
[15]郭明全,宋凤瑞,陈茂连,等. 刺五加寡糖的电喷雾多级串联质谱研究[J]. 高等学校化学学报,2003,24(9):1 577-1 581.
GUO Mingquan, SONG Fengrui, CHEN Maolian, et al. Studies on oligosaccharides fromAcanthopanaxSenticosusHarms(AS) by electrospray ionization tandem mass spectrometry (MSn)[J].Chemical Journal of Chinese Universities, 2003, 24(9): 1 577-1 581(in Chinese).
[16]刘巍,毛友安,钟科军,等. 直接电喷雾离子阱质谱法快速表征烟叶[J]. 分析试验室,2008,27(2):65-69.
LIU Wei, MAO Youan, ZHONG Kejun, et al. Fast characterization of tobacco leaves by direct electrospray ionization-ion trap mass spectrometry[J]. Chinese Journal of Analysis Laboratory, 2008, 27(2): 65-69(in Chinese).
[17]孙孟琪,齐瑶,宋凤瑞,等. 中药刺桐抗氧化成分的分离与活性评价研究[J]. 中华中医药学刊,2010,28(8):1 762-1 765.
SUN Mengqi, QI Yao, SONG Fengrui, et al. Studies on the isolation and the activitys evaluation of anti-oxidation chemical compositions in erythina variegata[J]. Chinese Archives of Traditional Chinese Medicine, 2010, 28(8): 1 762-1 765(in Chinese).
Chemical Constituents and Antioxidant Activity of Radix Isatidis
YAN Jun1, ZHAO Chun-fang2, LI Bo-ping1, LIU Zhi-qiang3, GUO Dong-fa1, ZHENG Zhong3
(1.BeijingResearchInstituteofUraniumGeology,Beijing100029,China;2.JilinUniversity,Changchun130021,China;3.ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,Changchun130022,China)
High performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) and electrospray ionization tandem mass spectrometry (ESI-MS/MS) were applied to analyze the chemical constituents from acetate,n-BuOH and 95% ethanol extracts of Radix Isatidis. The separation was performed on a Kromasil C18 column (4.6 mm×250 mm×5 μm) with gradient of 0.15% acetic acid/water and methanol as mobile phase with a flow rate of 0.8 mL/min at 25 ℃. The UV spectra of peaks were obtained by a diode array detector (DAD) under the detection wavelength at 254 nm and 265 nm. In order to get exact data of MS and MS2spectra, the atmosphere pressure chemical ionization ion source (APCI) and electrospray ionization ion source (ESI) in positive and negative scan mode were utilized. Up to date, twenty-eight compounds are identified from the crude extracts, including indoles, quinazolinones, organic acids, nucleosides, purines, amino acids, flavones and carbohydrates. Meanwhile, the antioxidant activity of the extracts from Radix Isatidis were estimated by the ferric reducing antioxidant power (FRAP) and radical scavenging (DPPH) methods. The results of the antioxidant activities indicated that the compositions of antioxidant activity are mainly existed in the small polarity part. Indoles, quinazolinones, organic acids and porphyrins are the main antioxidative constituents of Radix Isatidis. This method is rapid and sensitive, which can be used for analyzing the chemical compositions and antioxidant activities of traditional Chinese medicine in the future.
Radix Isatidis; chemical constituents; high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); electrospray ionization tandem mass spectrometry (ESI-MS/MS); antioxidant activity
2016-03-24;
2016-05-18
吉林省科技发展计划项目(20130102074JC)资助
闫 峻(1982—),男(汉族),吉林通化人,高级工程师,从事中药及天然产物化学成分和质量控制研究。E-mail: cnncyanjun@163.com
时间:2016-09-01;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20160901.1527.010.html
O657.6
A
1004-2997(2017)02-0248-08
10.7538/zpxb.youxian.2016.0042

