高效液相色谱-串联质谱法快速测定食品中5种罂粟壳生物碱
林黛琴,王婷婷,万承波,邱 萍
(1.江西省产品质量监督检测院,江西 南昌 330029;2.南昌大学化学系,江西 南昌 330031)
高效液相色谱-串联质谱法快速测定食品中5种罂粟壳生物碱
林黛琴1,王婷婷1,万承波1,邱 萍2
(1.江西省产品质量监督检测院,江西 南昌 330029;2.南昌大学化学系,江西 南昌 330031)
建立了高效液相色谱-串联质谱法(HPLC-MS/MS)定性定量分析食品中非法添加的吗啡、可待因、蒂巴因、罂粟碱和那可丁等5种罂粟壳生物碱。采用Capcell PAK C18 TYPE MGⅡ(5 μm×2.0 mm×150 mm)色谱柱分离,以10 mmol/L乙酸铵(pH 4.2)-乙腈为流动相,梯度洗脱,电喷雾离子源,多反应监测(MRM)模式检测。在优化的实验条件下,得到了较宽的线性范围和较低的定量检出限。吗啡和可待因的线性范围为1.0~20.0 μg/L,蒂巴因、罂粟碱和那可丁的线性范围为0.2~4.0 μg/L,相关系数均在0.999以上。食品中吗啡、可待因、蒂巴因、罂粟碱和那可丁的定量限分别为7.5、7.5、1.5、1.5、1.5 μg/kg。方法的回收率和重现性较好,5种罂粟壳生物碱的回收率在72.2%~111.4%之间,相对标准偏差(RSD)在3.1%~8.8%之间。该方法操作简单、灵敏度高、准确可靠,可用于食品中5种非法添加罂粟壳生物碱的定量及确证分析。
高效液相色谱-串联质谱法(HPLC-MS/MS);罂粟壳;吗啡;可待因;蒂巴因;罂粟碱;那可丁
罂粟壳是罂粟科植物罂粟采完鸦片后的干燥成熟果壳,含有20多种生物碱,其中吗啡(morphine)、可待因(codeine)、罂粟碱(papavarine)、蒂巴因(tibane)、那可丁(narcotine)等为其主要成分[1],其化学结构示于图1。这5种物质均为异喹啉型生物碱,具有一定的药用价值[2],但其副作用也不可低估。如食用后会使人嗜睡、性格改变,可引起某种程度的惬意和欣快感,造成人的注意力、思维和记忆性能衰退,
长期食用还会引起精神失常、出现幻觉,严重时甚至会导致呼吸停止而死亡[3]。卫生部印发的《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第一批)》中明确规定,食品中的罂粟壳属于违法添加物质。由于添加了罂粟壳的食物味道鲜美,易使消费者成瘾,长期食用会对其产生依赖性,因此一些不法商家在火锅、麻辣烫、烤禽类等汤料或辅料中添加罂粟壳及其水浸物等违禁原料,以吸引更多的食客。对此种行为国家已多次明令禁止,也要求有关部门严厉查处。因此,建立罂粟壳生物碱的简便、快速、高效的检测方法势在必行。
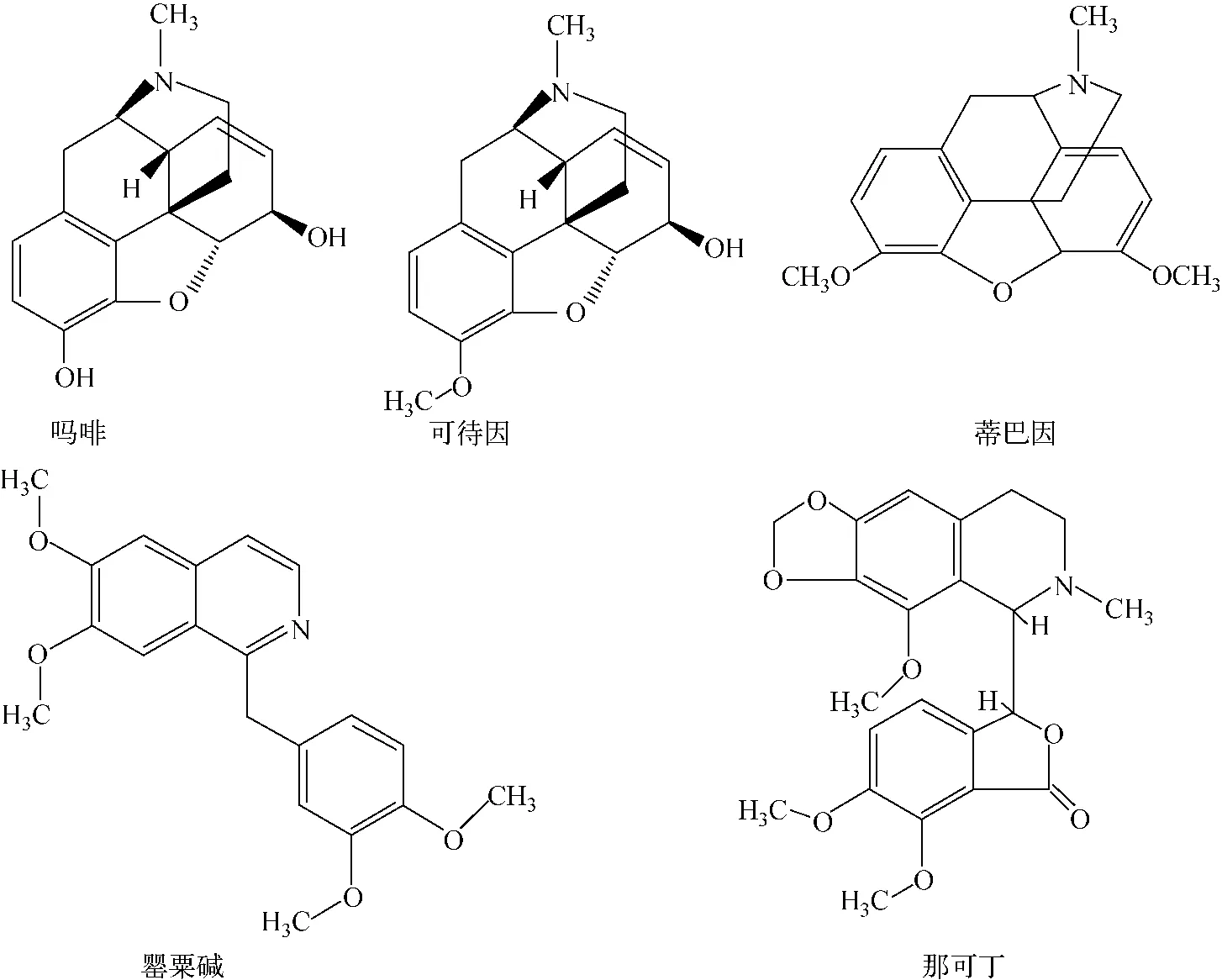
图1 罂粟壳中5种生物碱的化学结构Fig.1 Chemical structures of five opium poppy husk alkaloids
目前,测定罂粟壳中生物碱的方法主要有层析法[4]、示波极谱法[5]、分光光度法[6]、高效液相色谱法[7-13]、气相色谱法[14]、气相色谱-质谱法[15-16]和液相色谱-质谱法[17-20]。其中,层析法、示波极谱法、分光光度法的干扰物质较多,只可对单一成分做定性和半定量测定;液相色谱法和气相色谱法不能对目标化合物准确定性,会产生一些假阳性结果;液相色谱-质谱法同时测定多组分罂粟壳生物碱主要是通过结合固相萃取小柱来完成的,该方法的前处理复杂,不适合快速检测,且运行成本较高。
本研究拟用5%氨化甲醇作为目标化合物提取剂,采用高效液相色谱-串联质谱法(HPLC-MS/MS)通过优化前处理、色谱和质谱条件,建立可同时、快速、准确检测食品中 5 种罂粟壳生物碱(吗啡、可待因、罂粟碱、蒂巴因、那可丁)的方法,旨为开展此类违禁添加物的监测和食品安全管理提供方法参考。
1 实验部分
1.1 主要仪器与装置
Agilent 6410A液相色谱-串联质谱联用仪:美国Agilent公司产品,配有Agilent 1200高效液相色谱仪及电喷雾离子源;Milli-Q超纯水器:美国Millipore公司产品;IKA T25均质器:德国IKA公司产品;SI Vortex Genie 2漩涡混合器:美国Scientific Industries公司产品;KQ-600DE型数控超声清洗仪:昆山市超声仪器有限公司产品;Sigma 3-18K低温离心机:德国Sigma公司产品;Eyela MMV-1000W振荡器:日本Eyela公司产品。
1.2 主要材料与试剂
罂粟壳中生物碱混合标准溶液(吗啡、可待因浓度为50 mg/L、罂粟碱浓度为10 mg/L):美国O2si smart solutions公司产品;乙酸铵、氨水(色谱纯):美国ACS恩科化学有限公司产品;乙腈、甲醇(色谱纯):美国Honeywell有限公司产品;甲酸(色谱纯):美国Tedia公司产品;正己烷(色谱纯):天津康科德科技有限公司产品;实验用水为Milli-Q超纯水。
混合标准工作液中,吗啡和可待因的系列浓度为1.0、2.0、5.0、10.0、20.0 μg/L;蒂巴因、罂粟碱和那可丁的系列浓度为0.2、0.4、1.0、 2.0、4.0 μg/L。
1.3 实验条件
1.3.1 色谱条件 色谱柱:资生堂Capcell PAK C18 TYPE MGⅡ(5 μm×2.0 mm×150 mm);进样量10 μL;柱温40 ℃;流速0.2 mL/min;流动相:A为乙腈,B为0.01 mol/L乙酸铵溶液(pH 4.2);梯度洗脱程序:0~1.0 min、10%A,1.0~5.0 min、10%~55%A,5.0~5.5 min、55%A,5.5~6.0 min、55%~10%A,6.0~15.0 min、10%A。
1.3.2 质谱条件 雾化气压力3.1×105Pa,毛细管电压4 000 V,离子源温度100 ℃,脱溶剂气温度350 ℃,脱溶剂气流速8 L/min。吗啡、可待因、蒂巴因、罂粟碱、那可丁的监测离子对、保留时间、解离电压和碰撞能量等质谱参数列于表1。
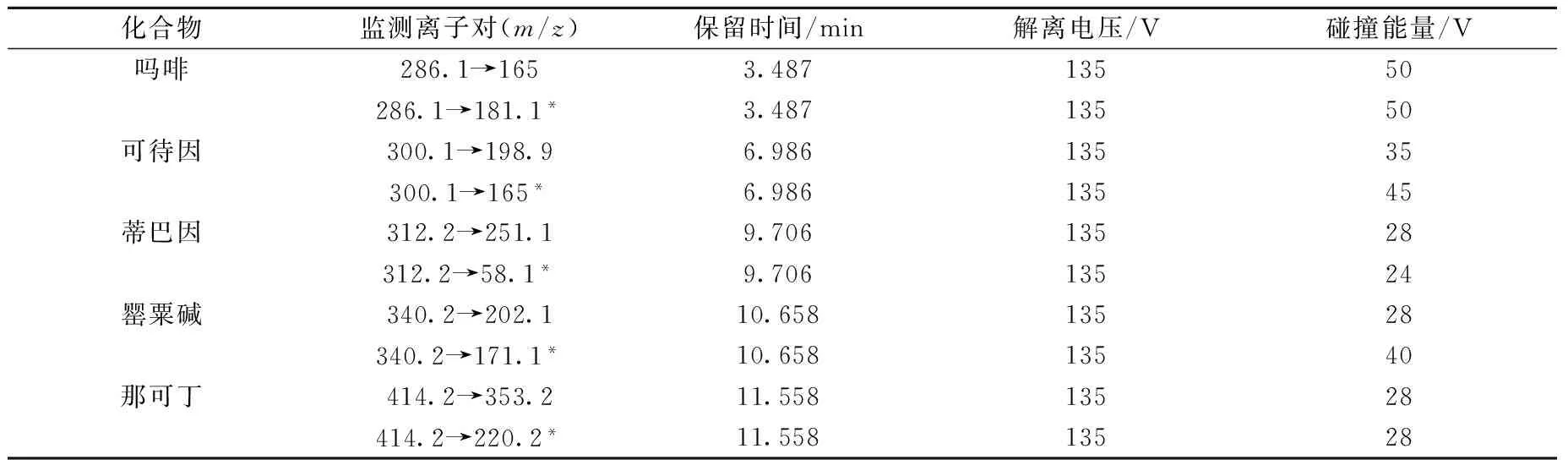
表1 5种罂粟壳生物碱的质谱参数Table 1 MS parameters of five opium poppy husk alkaloids
注:*为定量离子
1.4 样品前处理
称取2 g(精确至0.01 g)均匀样品于50 mL离心管中,加入7.5 mL 5%氨化甲醇,涡旋1 min后,振荡5 min,超声提取30 min,于4 ℃以15 000 r/min离心10 min;移取有机相层至另一离心管中,用7.5 mL 5%氨化甲醇再次提取残渣,合并有机相;然后用甲醇饱和的正己烷去除有机相中油脂,然后除去正己烷层,用5%氨化甲醇定容至15 mL,取适量过0.22 μm聚四氟乙烯滤膜,待LC-MS/MS测定。
基质空白外标曲线溶液的配制:称取2 g(精确至0.01 g)空白基质样品,按上述步骤处理,得到的基质提取液用于稀释标准储备液及高含量样品溶液。
2 结果与讨论
2.1 高效液相色谱条件的优化
2.1.1 色谱柱的选择 考察了资生堂 MGⅡ C18柱(5 μm×2.0 mm×150 mm)、ZORBAX Eclipse XDB-C18柱(3.5 μm×2.1 mm×150 mm)和Aglient XBridgeTMC18柱(3.5 μm×2.1 mm×100 mm)3种不同的高效液相色谱柱对各组分的分离效果。结果表明:资生堂MGⅡC18柱的分离效果最好,且峰形更佳;Aglient XBridgeTMC18柱的分离效果较差,无法分离蒂巴因和罂粟碱。因此,选择资生堂MGⅡ C18柱作为高效液相色谱柱。
2.1.2 流动相的选择 考察了0.1%甲酸水-乙腈、乙酸铵(pH 3.5)-乙腈、乙酸铵(pH 4.2)-乙腈、乙酸铵(pH 5.5)-乙腈4种溶液作为流动相。结果发现:0.1%甲酸水-乙腈作为流动相时的峰型变宽,组分之间的分离严重,且吗啡在色谱柱中无保留;不同pH值乙酸铵体系作为流动相时,随着pH值的增大,三组分的分离度增大,保留时间增长,但吗啡的响应在pH 3.5及pH 5.5时均减小,而在pH 4.2时能使各组分得到较好的分离,且响应值最高。因此,选择乙酸铵(pH 4.2)-乙腈溶液作为流动相。
2.2 前处理条件的优化
罂粟壳中的生物碱易溶于甲醇等有机溶剂,常用于提取罂粟壳中生物碱的溶剂有盐酸溶液[18]、酸化乙腈水溶液[19]、乙醇水溶液[12]、甲醇溶液[9]等。本研究在分析火锅底料、调味油、辣椒酱和固态复合调味料4种不同类型的样品时,分别考察了盐酸溶液、盐酸-乙腈(1∶1,V/V)溶液、乙腈水溶液、5%氨化甲醇的提取效果。结果表明:酸性条件下所得的提取物在色谱柱上的分离效果较差,提取率不足50%;乙腈水溶液提取液中的可待因峰形较差;氨化甲醇提取液中的生物碱能在色谱柱上得到较好的分离,提取率为72%~111%;采用盐酸-乙腈提取液过MCX柱进行净化,氨化甲醇定容,提取的生物碱类成分能得到较好的分离,但步骤繁琐。因此,本实验选择氨化甲醇作为提取溶剂。
2.3 质谱的定性定量分析
根据5种生物碱的分子结构特征,选择电喷雾正离子(ESI+)电离模式对标准溶液进行Q1全扫描。分别准确找出各分子离子峰,然后对其子离子进行Q3全扫描,将2~3个信号较强的碎片离子与母离子组成监测离子对,以多反应监测模式对待测物进行定性和定量检测。5种生物碱的定量离子分别为m/z181.1(吗啡)、m/z165(可待因)、m/z58.1(蒂巴因)、m/z171.1(罂粟碱)、m/z220.2(那可丁),其离子扫描图和解离图示于图2。
从图1可见,吗啡和可待因的分子结构式非常相似,二者的差异仅在与苯环相连的1个基团(羟基、甲氧基),相对分子质量分别为285.1、299.1。对分子离子m/z286.1[M+H]+、m/z300.1[M+H]+进行二级质谱分析,它们的空间分子结构在诱导能量碰撞下不稳定,产生多种断键方式,形成丰富的碎片离子峰,示于图2a和2b。从碎片离子组成可以看出,二者的裂解规律相似;蒂巴因m/z311.4在电喷雾正离子(ESI+)电离模式扫描下加氢得到分子离子m/z312.2 [M+H]+,进一步进行MS2扫描,使其断开化学键,得到特征碎片离子m/z58.1[C3H8N]+和m/z251.1[C16H11O3]+,断键位点示于图2c;罂粟碱m/z339在ESI+下加氢得到分子离子m/z340.1[M+H]+,然后断键,先脱去邻二甲氧基苯m/z138[C6H4(OCH3)2],得到特征碎片离子m/z202.1 [M+H—C6H4(OCH3)2]+,部分特征碎片离子m/z202.1[M+H—C6H4(OCH3)2]+在诱导能量碰撞时进一步脱去2个甲基,得到m/z170.1[M+H—C6H4(OCH3)2—(CH3)2]+,

图2 吗啡(a)、可待因(b)、蒂巴因(c)、罂粟碱(d)及那可丁(e)的离子扫描图和解离图Fig.2 Product ion scans spectra and proposed fragmentation scheme of morphine (a), codeine (b), tibane (c) , papaverine (d) and narcotinum (e)
这是其另一特征碎片离子,断键位点示于图2d;那可丁氯化物m/z449[M]在质谱条件扫描下,脱氯加氢得到分子离子m/z414.2[M—Cl+H]+,在MS2扫描中脱去苯环上2个相邻的甲氧基得到特征碎片离子m/z353.2[M—Cl+H—(OCH3)2]+,部分特征碎片离子在诱导能量碰撞下进一步脱去异苯并呋喃酮,得到另一特征碎片离子m/z220.2[M—Cl+H—(OCH3)2—C8H5O2]+,断键位点示于图2e。
2.4 工作曲线与定量检出限
由于样品中待测组分痕量、样品基质复杂、提取净化步骤繁琐,在液相色谱-串联质谱法测定时,为了考察基质离子抑制对定量结果的影响,在吗啡和可待因7.5、37.5、75.0 μg/kg 3个添加水平,以及蒂巴因、罂粟碱和那可丁1.5、7.5、15 μg/kg 3个添加水平下,分别使用空白样品提取液配制工作溶液,氨化甲醇配制标准溶液对其进行定量。结果发现,二者的回收率差异较大,不同样品的基质效应不同,离子化效率在30%~55%之间。由于存在较大的基质减弱效应,影响了回收率,所以必须考虑扣除基质干扰,以提高定量的准确性。
本实验以5种生物碱的质量浓度为横坐标,以峰面积为纵坐标,选择基质空白加不同浓度标准溶液绘制工作曲线,外标法定量,得到线性回归方程及相关系数。其中,吗啡、可待因的质量浓度为1.0、2.0、5.0、10.0、20.0 μg/L,蒂巴因、罂粟碱和那可丁的质量浓度为0.2、0.4、1.0、2.0、4.0 μg/L。以信噪比S/N=3时对应的目标化合物含量为方法的检出限,以信噪比S/N=10时对应的目标化合物含量为方法的定量限,结果列于表2。5种罂粟壳生物碱混合标准溶液及火锅底料基质和样品的MRM图示于图3。

表2 5种罂粟壳生物碱的线性回归方程、线性范围、相关系数、检出限和定量限Table 2 Linear equations, linear ranges, correlation coefficients, limits of detection and limits of quantification of five opium poppy husk alkaloids
2.5 回收率、精密度及实际样品检测
向没有非法添加的火锅底料、调味油、辣椒酱和固态复合调味料4种空白样品中分别添加3个不同浓度水平的混合标准溶液,每个添加水平重复测定6次,以基质空白工作曲线进行定量,计算方法的回收率及精密度(以相对标准偏差表示),结果列于表3。可见,该方法的精密度和准确度良好,可以满足痕量分析要求。
应用该方法检测了市场的火锅底料、调味油、辣椒酱、固态复合调味料各2份样品,8种样品均未检出这5种罂粟壳生物碱,结果令人满意。
3 结论
本研究建立了高效液相色谱-串联质谱法定性定量分析食品中非法添加的吗啡、可待因、蒂巴因、罂粟碱、那可丁等5种罂粟壳生物碱,其检出限在0.5~2.5 μg/kg之间,定量限在1.5~7.5 μg/kg之间,平均回收率在 72.2%~111.4%之间,相对标准偏差在 3.1%~8.8%之间,方法的线性关系良好,相关系数R2大于0.999。该方法准确可靠、灵敏度高、前处理简单,可应用于食品中罂粟壳生物碱的检测,为食品安全监督检测提供有力的技术支持。
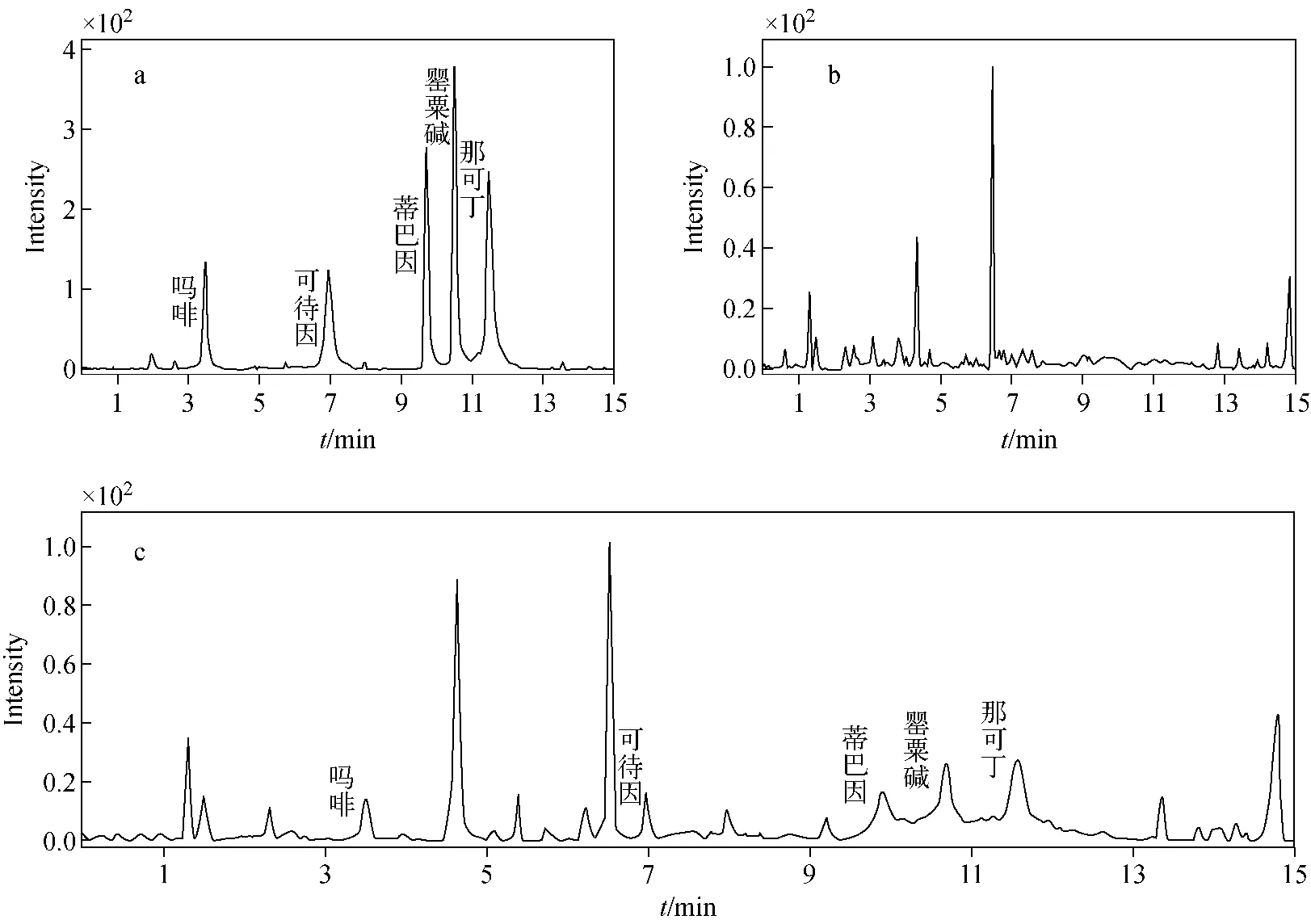
图3 5种罂粟壳生物碱混合标准溶液(a)、火锅底料基质空白溶液(b)、火锅底料样品在检出限添加水平(c)的MRM谱图Fig.3 Multiple reaction monitoring chromatograms of a mixed standard solution of five opium poppy husk alkaloids (a), a blank hot pot material sample (b) and the blank hot pot material sample spiked with four yellow dyes (c)
表3 不同食品中5种罂粟壳生物碱的回收率和精密度
Table 3 Recoveries and precisions of the five opium poppy husk alkaloids in different foods

生物碱添加浓度/(μg/kg)火锅底料调味油辣椒酱固态复合调味料回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%吗啡7.590.43.893.56.583.47.977.15.337.578.93.494.18.890.16.6105.98.87579.86.399.93.686.03.798.25.2可待因7.580.43.892.43.974.35.290.75.137.576.83.993.26.173.18.1101.23.97579.44.498.83.483.93.497.23.6蒂巴因1.591.45.293.55.292.94.984.15.97.587.24.4106.84.0111.45.293.24.11588.93.6103.83.294.14.3103.24.2罂粟碱1.582.84.6101.33.596.66.090.54.47.583.93.994.64.485.73.5105.64.01574.54.4102.24.187.73.1104.93.9那可丁1.576.36.7100.96.985.37.772.24.87.574.24.499.93.284.83.977.54.11578.93.7109.24.284.64.176.04.0
[1] 戴维杰,钮伟民. 高效液相色谱法检测掺罂粟壳食品中的罂粟碱[J]. 中国卫生检验杂志,2003,13(5):607-608.
DAI Weijie, NIU Weimin. Detection of papaverine in food with poppy by HPLC[J]. Chinese Journal of Health Laboratory Technology, 2003, 13(5): 607-608(in Chinese).
[2] 卫生部药典委. 中华人民共和国药典(一部)[M]. 北京:化工出版社,1995:326.
[3] 皮立,胡凤祖,师治贤. 高效液相色谱荧光检测法测定罂粟籽和火锅汤料中的罂粟碱[J]. 色谱,2005,23(6):639-641.
PI Li, HU Fengzu, SHI Zhixian. Determination of papaverine in seeds of papaver somniferum and soup of chafing dish by high performance liquid chromatography-fluorescence detection[J]. Chinese Journal of Chromatography, 2005, 23(6): 639-641(in Chinese).
[4] 姜曲镇,杜道远,谢文涛. 薄层层析法定量测定食品中阿片生物碱[J]. 河南预防医学杂志,1997,8(3):149-151.
JIANG Quzhen, DU Daoyuan, XIE Wentao. Quantitative determination of opium alkaloids in food by thin layer chromatography[J]. Henan Journal of Preventive Medicine, 1997, 8(3): 149-151(in Chinese).
[5] 陶锐. 火锅汤料中吗啡的示波极谱测定[J]. 中国卫生检验杂志,1994,4(3):140-147.
TAO Rui. Determination of morphine in hot pot soup by oscillopolarographic[J]. Chinese Journal of Health Laboratory Technology, 1994, 4(3): 140-147(in Chinese).
[6] 姜典镇,刘松辉,朱素霞,等. 薄层层析-紫外分光光度法定量测定食品中的阿片生物碱[J]. 解放军预防医学杂志,1997,15(3):184-186.
JIANG Dianzhen, LIU Songhui, ZHU Suxia, et al. Quantitative determination of opium alkaloids in food by thin layer chromatography with ultraviolet spectrophotometry[J]. Journal of Preventive Medicine of Chinese People’s Liberation Army, 1997, 15(3): 184-186(in Chinese).
[7] 王越,马丽霞,田微. 火锅底料中罂粟壳的高效液相色谱法测定[J]. 色谱,1999,17(4):401-402.
WANG Yue, MA Lixia, TIAN Wei. Determination of pericarpium papaveris in Bottom material of chafing dish by high performance liquid chromatography[J]. Chinese Journal of Chromatography, 1999, 17(4): 401-402(in Chinese).
[8] 顾利红,施亦斌. 反相HPLC 法测定罂粟壳中吗啡、可待因的含量[J]. 广东药学,1999,9(3):17- 18.
GU Lihong, SHI Yibin. Determination of morphine and codeine inPericarpiumpapaverisby RP-HPLC[J]. Guangdong Pharmaceutical Journal, 1999, 9(3): 17-18(in Chinese).
[9] 陈建军. 固相萃取-反相高效液相色谱法测定火锅中吗啡和可待因[J]. 实用预防医学,2006,13(3):766-767.
CHEN Jianjun. Determination of morphine and codeine in hot pot by solid-phade extraction and HPLC[J]. Practical Preventive Medicine, 2006, 13(3): 766-767(in Chinese).
[10]郝红艳,郭济贤. HPLC和HPCE法测定罂粟壳中3种生物活性生物碱[J]. 药学学报,2000,35(4):289-293(in Chinese).
HAO Hongyan, GUO Jixian. Determination of 3 bioactive alkaloids in the shell of the opium-poppy by HPLC and HPCE[J]. Acta Pharmaceutica Sinica, 2000, 35(4): 289-293(in Chinese).
[11]董南,王海燕. 高效液相色谱法检测食品中多种香料共存时的罂粟壳[J]. 色谱,2000,11(6):554-555.
DONG Nan, WANG Haiyan. Determination of pericarpium papaveris in foods accompanied with some fragrant substances by high performance liquid chromatography[J]. Chinese Journal of Chromatography, 2000, 11(6): 554-555(in Chinese).
[12]张靖. 食品中罂粟碱、吗啡、可待因含量的液相色谱检测法研究[J]. 中国卫生检验杂志,2007,17(1):72-73.
ZHANG Jing. Study on the detection method of content of papaverine, morphine and codeine in food by HPLC[J]. Chinese Journal of Health Laboratory Technology, 2007, 17(1): 72-73(in Chinese).
[13]朱龙. 吗啡和海洛因等生物碱的高效液相色谱化学发光测定[J]. 分析化学,1996,24(11):1 295-1 297.
ZHU Long. Determination of morphine, codeine and other alkaloids by high performance liquid chromatography with chemiluminescence detection[J]. Chinese Journal of Analytieal Chemistry, 1996, 24(11): 1 295-1 297(in Chinese).
[14]季申,王柯. GC法测定中药罂粟壳中吗啡、可待因和罂粟碱的含量[J]. 中草药,1998,29(8):526-528.
JI Shen, WANG Ke. Determination of morphine, codeine and narceine in poppy shell of traditional Chinese medicine by GC method[J]. Chinese Traditional and Herbal Drugs, 1998, 29(8): 526-528(in Chinese).
[15]POPA D S, OPREAN R, CUREA E, et al. TLC-UVdensitometric and GC-MSD methods for simultaneous quantification of morphine and codeine in poppy capsules[J]. Journal of Pharmaceutical & Biomedical Analysis, 1999, 18(4/5): 645-650.
[16] 高玲,杨元,蒲斌. 气相色谱-质谱法测定火锅汤料中吗啡[J]. 中国卫生检验杂志,2001,11(1):41-43.
GAO Ling, YANG Yuan, PU Bin. Determination of morphine in hot pot soup by gas chromatography mass spectrometry[J]. Chinses Journal of Health Laboratory Technology, 2001, 11(1): 41-43(in Chinese).
[17]LIU S Y, WOO S O, HOLMES M J, et al. LC and LC-MS-MS analysis of undeclared codeine in antiasthmatic Chinese proprietry medicine[J]. Journal of Pharmaceutical & Biomedical Analysis, 2000, 22(3): 481-486.
[18]张虹,廖文娟,蔡增轩,等. 液质联用法检测掺罂粟壳食物中生物碱的残留[J]. 食品与发酵工业,2005,31(12):93-97.
ZHANG Hong, LIAO Wenjuan, CAI Zengxuan, et al. Determination of alkaloids residues in food adulterated with pericarpium papaveris by HPLC-MS-MS[J]. Food and Fermentation Industries, 2005, 31(12): 93-97(in Chinese).
[19]王力清,郦明浩,李锦清,等. 超高效液相色谱-串联质谱法高通量快速测定调料中罂粟壳生物碱含量[J]. 食品与发醇工业,2012,38(8):168-172.
WANG Liqing, LI Minghao, LI Jinqing, et al. High throughput determination of alkaloids papavers in sessonings by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food and Fermentation Industries, 2012, 38(8): 168-172(in Chinese).
[20]张虹,任一平,廖文娟. 液相色谱-串联四极杆质谱法测定罂粟壳主要成分在止咳药中的含量[J]. 分析化学,2006,34(8):1 175-1 178.
ZHANG Hong, REN Yiping, LIAO Wenjuan. Determination of alkaloids of pericarpium papaveris in antitussive by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2006, 34(8): 1 175-1 178(in Chinese).
Rapid Determination of Five Opium Poppy Husk Alkaloids in Foods by HPLC-MS/MS
LIN Dai-qin1, WANG Ting-ting1, WAN Cheng-bo1, QIU Ping2
(1.JiangxiInstituteofSupervision&InspectiononProductQuality,Nanchang330029,China;2.DepartmentofChemistry,NanchangUniversity,Nanchang330031,China)
A method of high performance liquid chromatography coupled with tandem mass spectrometry (HPLC-MS/MS) was developed for simultaneous determination of the residues of five opium poppy husk alkaloids in foods, such as morphine, codeine, tibane, papaverine and narcotinum. The samples were extracted by methanol (containing 5% ammonia acetate), and then analyzed by HPLC-MS/MS. The separation was carried out by a Capcell PAK C18 TYPE MGⅡ(5 μm×2.0 mm×150 mm) column, with 10 mmol/L ammonium acetate (pH 4.2) and acetonitrile as mobile phases at a flow rate of 0.2 mL/min. Multiple reaction monitoring (MRM) mode was applied, with positive ion electrospray ionization (ESI). Sample matrix-matched calibration was used to determine the residue contents by external standard. Under the optimized detection conditions, the linear ranges for morphine and codeine are 1.0-20.0 μg/L, and for tibane, papaverine and narcotinum are 0.2-4.0 μg/L, the linear correlation coefficients are all more than 0.999. The limits of quantification for morphine, codeine, tibane, papaverine and narcotinum are 7.5, 7.5, 1.5, 1.5 and 1.5 μg/kg, respectively. The recoveries of five opium poppy husk alkaloids range from 72.2% to 111.4% with the relative standard deviations (RSD) of 3.1%-8.8%. This method is simple, effective and sensitive, which is suitable for the determination and confirmation of five opium poppy husk alkaloids added in the foods illegally.
high performance liquid chromatography coupled with mass spectrometry (HPLC-MS/MS); opium poppy husk; morphine; codeine; tibane; papaverine; narcotine
2016-02-28;
2016-04-11
林黛琴(1979—),女(汉族),江西东乡人,高级工程师,从事食品检验分析。E-mail: zzl0711@126.com
时间:2016-12-22;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20161222.1615.006.html
O657.63
A
1004-2997(2017)02-0239-09
10.7538/zpxb.youxian.2016.0041

