高效液相色谱-串联质谱法测定烟草中马来酰肼残留量
陈晓水,朱书秀,蒋佳磊,汤晓东,苏 燕,林 垦,陆明华
(浙江中烟工业有限责任公司技术中心,浙江 杭州 310024)
高效液相色谱-串联质谱法测定烟草中马来酰肼残留量
陈晓水,朱书秀,蒋佳磊,汤晓东,苏 燕,林 垦,陆明华
(浙江中烟工业有限责任公司技术中心,浙江 杭州 310024)
建立了高效液相色谱-串联质谱(LC-MS/MS)测定烟草中马来酰肼农药残留的方法。烟草样品经盐酸溶液加热回流萃取,冷却后过膜稀释,多反应监测正离子模式测定,氘代马来酰肼同位素内标定量。结果表明,马来酰肼的定量限为0.27 mg/kg,加标回收率在90.3%~101.5%之间,相对标准偏差(RSD)小于5.5%;采用该方法对12个烟草样品进行检测,马来酰肼在其中10个样品中无检出,将有检出的2个样品与标准方法的测定值进行比较,结果显示两组数据的一致性较好,无显著性差异。该方法前处理简单、灵敏度高、稳定性好,适用于烟草样品中马来酰肼残留量的测定。
烟草;马来酰肼;高效液相色谱-串联质谱(LC-MS/MS);同位素内标
马来酰肼(MH)又称抑芽丹,是一种植物生长调节剂,经植物吸收后,通过抑制细胞分裂而抑制植物生长。在烟草生长过程中,使用马来酰肼作为烟草抑芽剂会导致其部分残留在烟草内部。国际烟草科学研究合作中心(CORESTA)于2003年12月提出了烟草中99种农药的指导性残留限量(GRLs),并于2008年和2013年进行了两次增补和修订,最新版本中规定马来酰肼的残留限量为80 mg/kg[1]。
分析马来酰肼残留的常用方法有气相色谱法(GC)、高效液相色谱法(HPLC)、液相色谱-串联质谱法(LC-MS/MS)等,且已用于检测花生、马铃薯等植物中马来酰肼残留量[2-3]。此外,Moreno等[4]采用甲醇振荡提取、冷冻过滤、溶剂置换后进行HPLC分析,测定了大蒜中马来酰肼残留;吴凤琪等[5]建立了一种乙腈提取后经固相萃取柱净化,LC-MS/MS法测定水果中包含马来酰肼在内的8种植物生长调节剂的含量。但烟草中马来酰肼残留状况较为特殊,因其被烟草植株吸收后会有部分结合成糖苷形式[6],在分析过程中首先需要对结合态马来酰肼进行水解。张洪非等[7]利用盐酸溶液对烟草样品进行加热回流萃取,萃取液经C18固相萃取小柱净化后,使用液相色谱紫外检测器检测,同时还考察了不同前处理方式对烟草中马来酰肼的萃取效率,该方法被认定为烟草行业标准方法(YC/T 405.5-2011)用于烟草中马来酰肼残留量的测定[8]。廖雅桦等[9]和Wang等[10]采用LC-MS/MS法分析烟草中马来酰肼,但前者的前处理方法是超声提取后经凝胶渗透色谱净化,而后者是将烟草样品用微波辅助萃取后,萃取液过膜直接进样。
目前,测定烟草中马来酰肼的标准方法存在前处理繁琐、耗时、有机溶剂使用量大等不足,而且液相色谱分离和紫外检测方法的灵敏度较低,对烟草中低浓度马来酰肼残留量的判断准确度偏低。LC-MS/MS法可显著提高马来酰肼检测的灵敏度,并且氘代内标的使用不仅可以消除体积的影响进而简化前处理步骤,在质谱测定时还能有效地减弱基质效应。因此,本工作拟采用LC-MS/MS法,以氘代马来酰肼作为内标,通过对样品前处理条件进行优化,探索一种快速分析烟草及其制品中马来酰肼残留的方法。
1 实验部分
1.1 仪器与装置
Agilent 1200液相色谱仪:美国Agilent公司产品;Q-trap 5500三重四极杆串联质谱仪:美国AB公司产品,配有电喷雾ESI离子源及Analyst 1.6.2数据处理系统;XP205电子天平(感量0.000 1 g):瑞士Mettler Toledo公司产品;Milli-Q纯水系统:美国Millipore公司产品;SD-2000-6六联电加热套:北京圣达共创科技公司产品。
1.2 材料与试剂
马来酰肼、d2-马来酰肼:纯度>97%,德国Dr. Ehrenstorfer公司产品;甲醇:色谱纯,美国Dikma公司产品;37%浓盐酸:杭州双林化工试剂厂产品,本实验将其配制成2 mol/L备用;甲酸:HPLC级,美国Tedia公司产品。
1.3 标准溶液的配制
内标工作溶液的配制:准确称取10.0 mgd2-马来酰肼,用甲醇溶解并定容至100 mL,配制成质量浓度为100 mg/L的内标工作液,于4 ℃冰箱中存储,备用。
标准工作溶液的配制:准确称取10.0 mg标准品,用甲醇溶解并定容至100 mL,配制成质量浓度为100 mg/L的标准储备液,于4 ℃冰箱中存储;分别准确移取0.01、0.02、0.05、0.1、0.2、0.5和1.0 mL标准储备液于100 mL容量瓶中,准确加入100 μL内标溶液,加水定容,即得系列标准工作溶液。
1.4 样品处理与分析
1.4.1 样品前处理 准确称取1.0 g粉碎后的烟草样品,置于250 mL圆底烧瓶中,加入40 mL 2 mol/L盐酸溶液和100 μL内标溶液,放入电加热套中加热回流1 h,冷却至室温后,取0.4 mL上清液,加水稀释至1 mL,过0.45 μm水相滤膜后,用LC-MS/MS法分析,内标法定量。
1.4.2 色谱条件 色谱柱:Hypercarb柱(100 mm×2.1 mm×5 μm);流动相:A为0.1%甲酸-水溶液,B为0.1%甲酸-甲醇溶液;梯度洗脱程序:0 min、95%A,8~15 min、95%~70%A,15~20 min、70%~10%A,20~30 min、10%~95%A,流速:0.3 mL/min;柱温:30 ℃;进样量:5 μL。
1.4.3 质谱条件 电喷雾ESI离子源,电喷雾电压4 500 V,离子源温度400 ℃,雾化气压力345 kPa,气帘气压力241 kPa,辅助加热气压力345 kPa,碰撞气压力Medium,多反应监测(MRM)扫描方式。
马来酰肼标准溶液在正、负离子模式下均有较好的响应,但因样品经盐酸处理后呈酸性,因此选择电喷雾正离子模式进行检测。马来酰肼及其内标的质谱参数列于表1。

表1 马来酰肼及其内标的LC-MS/MS参数Table 1 LC-MS/MS parameters of MH and d2-MH
2 结果与讨论
2.1 色谱条件的选择
马来酰肼的极性较强,在普通的C18液相色谱柱上保留较弱。参考欧盟指定实验室的快速极性农残分析方法(QuPPe Method)[11],选择Hypercarb色谱柱作为分析柱,用酸化的水溶液和甲醇作为流动相,取得了较好的保留效果,样品的提取离子色谱图示于图1。
2.2 萃取方式的选择
马来酰肼的前处理方法有以下两种:1) 加热回流法,即烟草样品经盐酸加热回流萃取后,冷却至室温,过滤定容,然后用C18固相萃取小柱净化[7];2) QuPPe法,即烟草样品加水浸润后,用酸化甲醇或盐酸溶液涡旋振荡提取,于80 ℃水浴中静置15 min后离心,自然冷却至室温,取上清液过0.45 μm水相滤膜[11]。
本实验考察了欧盟QuPPe方法中以酸化甲醇、盐酸溶液作为萃取剂和标准加热回流方法对某烟叶样品的提取效率,结果示于图2。可知,在QuPPe方法中,无论选择酸化甲醇还是盐酸溶液作为萃取剂,对烟草样品中马来酰肼的萃取效率都不及加热回流法。因此,本实验以盐酸溶液作为萃取剂,采取加热回流的萃取方法。
2.3 萃取参数的优化
取1 g烟草样品进行实验,首先考察了不同浓度的盐酸(1、2、4 mol/L)对马来酰肼提取效率的影响,结果示于图3a。可见,2 mol/L盐酸溶液即可满足回收率要求。其次,考察了不同体积(20、30、40、50 mL)盐酸溶液对马来酰肼提取效率的影响,结果示于图3b。可以看出,40 mL盐酸溶液即可满足回收率要求。因此,本实验选取1 g烟草样品,以40 mL 2 mol/L盐酸溶液作为萃取溶剂进行加热回流萃取。
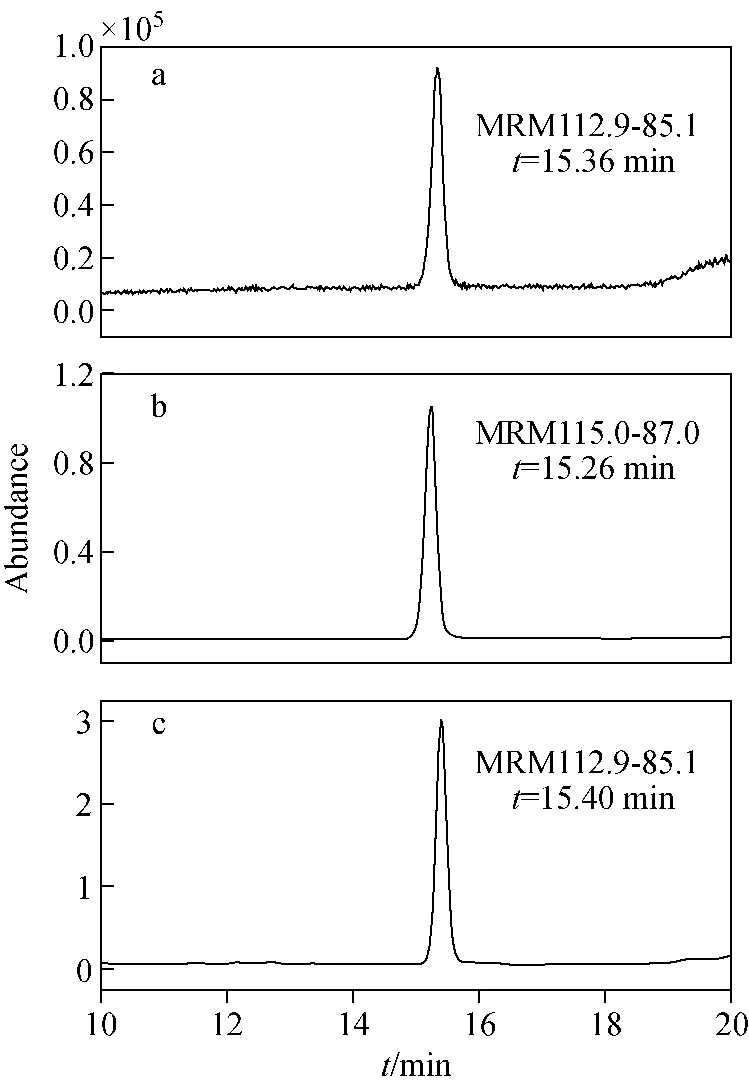
注:a.0.1 mg/L标准溶液中的马来酰肼;b. 标准溶液中氘代内标;c.实际样品中的马来酰肼图1 马来酰肼及其内标的提取离子色谱图 Fig.1 Extract ion chromatography (EIC) of MH and d2-MH
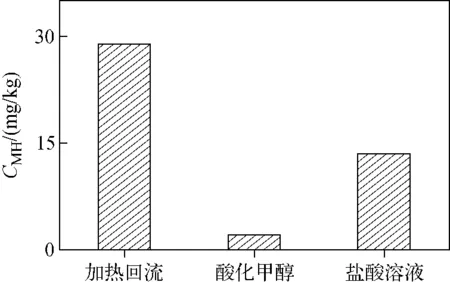
图2 不同萃取方式的提取效率Fig.2 Extraction efficiencies of different extraction methods
2.4 工作曲线、定量限、回收率和精密度
按1.3节方法配制系列标准工作溶液,进行LC-MS/MS测定,内标法定量。以3倍信噪比(S/N=3)计算方法检出限(LOD),以10倍信噪比(S/N=10)计算方法定量限(LOQ)。结果表明,马来酰肼的检出限为0.082 mg/kg,定量限为0.27 mg/kg,且在1~100 mg/kg范围内线性关系良好,相关系数为0.999 9。
向空白烟草样品中分别加入相当于2、10、50 mg/kg马来酰肼标准样品,配制成低、中、高3个浓度的样品,每个浓度制备6个平行样品,按1.4节方法处理和分析,结果列于表2。

图3 盐酸溶液的浓度(a)和体积(b)对马来酰肼萃取效率的影响Fig.3 Effect of concentration (a) and volume (b) of HCl solution on extraction efficiency
由表2可知,在低、中、高3个不同浓度水平下,马来酰肼的回收率在90.3%~101.5%之间,相对标准偏差均小于5.5%,验证了本方法的回收率好、稳定性高。
2.5 实际样品分析及与标准方法对比
采用该方法对12个实际烟草样品进行检测,并将测定结果与现有的标准方法测定值进行对比。结果表明,在其中10个样品中均未检出马来酰肼,在2个样品中检出马来酰肼,其检出值分别为4.7 mg/kg和29.3 mg/kg,均远远低于CORESTA规定的最大残留限量(80 mg/kg)。为了更好地对比本方法与标准方法的一致性,对其中2个样品分别加标后用两种方法进行测定,结果列于表3。实验数据表明,两种方法的测定值无显著差异,具有较好的一致性。

表2 马来酰肼的加标回收率和相对标准偏差(n=6)Table 2 Recoveries and RSDs of maleic hydrazide (n=6)

表3 该方法与标准方法测定2个烟草样品加标后的马来酰肼残留量Table 3 Contents of maleic hydrazide in two tobacco samples with standard added
注:N.D表示未检出
3 结论
本研究建立了LC-MS/MS测定烟草中马来酰肼残留量的分析方法,以氘代马来酰肼为内标,盐酸溶液加热回流萃取后直接稀释过膜进样,得马来酰肼的定量限为0.27 mg/kg,加标回收率为90.3%~101.5%,相对标准偏差小于5.5%。本方法操作简单、结果准确、稳定性好,适用于烟草及其制品中马来酰肼的残留检测。
[1] CORESTA Guide N°1—2013. The concept and implementation of agrochemical guidance residue levels[S].
[2] LEWIS D J, BARNES K A, WILKINSON K, et al. Extraction of maleic hydrazide residues from potato crisps and their determination using high-performance liquid chromatography with UV and atmospheric pressure chemicalionisation mass spectrometric detection[J]. Journal of Chromatography A, 1996, 750(1/2): 391-396.
[3] 阮丽萍,沈东旭,吉文亮,等. 采用HPLC-MS/MS方法同时测定花生中的马来酰肼和丁酰肼[J]. 江苏农业学报,2012,28(1):228-230.
RUAN Liping, SHEN Dongxu, JI Wenliang, et al. Simultaneous determination of maleic hydrazide and daminozide in peanut by high performance liquid chromatography-tandem mass spectrometry[J]. Jiangsu Journal of Agricultural Sciences, 2012, 28(1): 228-230(in Chinese).
[4] MORENO C M, STADLER T, SILVA A A D, et al. Determination of maleic hydrazide residues in garlic bulbs by HPLC[J]. Talanta, 2012, 89(2): 369-376.
[5] 吴凤琪,靳保辉,陈波,等. 水果中8种外源性植物生长调节剂的液相色谱-串联质谱测定[J]. 中国农学通报,2010,26(15):115-119.
WU Fengqi, JIN Baohui, CHEN Bo, et al. Determination of eight exogenous plant growth regulator in fruit by liquid chromatography-tandem mass spectrometry[J]. Chinese Agricultural Science Bulletin, 2010, 26(15):115-119(in Chinese).
[6] FREAR D S, SWANSON H R. Behavior and fate of [14C] maleic hydrazide in tobacco plants[J]. Journal of Agricultural & Food Chemistry, 2002, 26(3): 660-666.
[7] 张洪非,边照阳,唐纲岭,等. HPLC法测定烟草及烟草制品中马来酰肼残留[J]. 烟草科技,2011,(12):47-51.
ZHANG Hongfei, BIAN Zhaoyang, TANG Gangling, et al. Determination of maleic hydrazide in tobacco and tobacco products with high performance liquid chromatography[J]. Tobacco Science & Technology, 2011, (12): 47-51(in Chinese).
[8] YC/T 405.5—2011 烟草及烟草制品多种农药残留量的测定 第5部分 马来酰肼残留量的测定 高效液相色谱法[S]. 北京:中国标准出版社,2011.
[9] 廖雅桦,蒋腊梅,穆小丽,等. 凝胶渗透色谱-高效液相色谱-串联质谱法同时测定烟草中3种抑芽剂残留[J]. 分析试验室,2010,29(1):72-75.
LIAO Yahua, JIANG Lamei, MU Xiaoli, et al. Determination of 3 kinds of suckercide residues in tobacco by GPC and HPLC-MS/MS[J]. Chinese Journal of Analysis Laboratory, 2010, 29(1): 72-75(in Chinese).
[10]WANG L, FEI T, QI D, et al. Development of microwave-assisted extraction and liquid chromatography-tandem mass spectrometry for determination of maleic hydrazide residues in tobacco[J]. Analytical Methods, 2015, 7(12): 5 103-5 107.
[11]Quick method for the analysis of residues of numerous highly polar pesticides in foods of plant origin involving simultaneous extraction with methanol and LC-MS/MS determination (QuPPe Method)[EB/OL]. [2015-12-9]. http:∥www.eurl-pesticides.eu/library/docs/srm/meth_QuPPe.pdf.
Determination of Maleic Hydrazide Residue in Tobacco by HPLC-MS/MS
CHEN Xiao-shui, ZHU Shu-xiu, JIANG Jia-lei, TANG Xiao-dong, SU Yan, LIN Ken, LU Ming-hua
(TechnologyCenterofChinaTobaccoZhejiangIndustrialCo.,Ltd.,Hangzhou310024,China)
A method of high performance liquid chromatography-tandem mass spectrometry (LC-MS/MS) was established for determining of maleic hydrazide residue in tobacco. The LC separation was performed using water containing 0.1% formic acid and methanol containing 0.1% formic acid as mobile phases with gradient elution at a flow rate of 0.3 mL/min. Qualitative and quantitative analysis were achieved after the chromatographic separation on a Thermo Hypercarb column (100 mm×2.1 mm×5 μm). The ESI source in positive ion mode was used for analyzing maleic hydrazide in the multiple reaction monitoring (MRM) mode. The pretreatment parameters were optimized, such as the extraction methods, the concentration and volume of extracts. The tobacco samples were extracted by 40 mL HCl aqueous solution at 2 mol/L under heat reflux for 1 h withd2-maleic hydrazide as the internal standard. After dilution with water and filtration by 0.45 μm membrane filters, the obtained solution was analyzed by LC-ESI-MS/MS in positive MRM mode. The results show that the standard curve is obtained with the correlation coefficients (R2=0.999 9) in the concentration range of 1-100 mg/kg. The limit of quantitation (LOQ, S/N=10) for maleic hydrazide is 0.27 mg/kg. The recoveries of maleic hydrazide are 90.3%-101.5% at three spiked levels of 2, 10 and 50 mg/kg with the relative standard deviations (RSDs) of 2.6%-5.5% (n=6). 12 tobacco samples were selected to detect, in which the maleic hydrazide were not detected in 10 samples. For the rest of samples, in comparison the results of this method with the existing standard method, there was no significant difference. This method is simple and accurate, which is suitable for the determination of maleic hydrazide in tobacco.
tobacco; maleic hydrazide; high performance liquid chromatography-tandem mass spectrometry (LC-MS/MS); isotope labeled internal standard
2016-03-04;
2016-05-27
陈晓水(1987—),男(汉族),山东菏泽人,工程师,从事烟气化学成分分析工作。E-mail: chenxiaoshui@zjtobacco.com
陆明华(1965—),女(汉族),浙江绍兴人,高级工程师,从事烟草化学分析工作。E-mail: lumh@zjtobacco.com
时间:2016-09-01;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20160901.1535.014.html
O657.63
A
1004-2997(2017)02-0234-05
10.7538/zpxb.youxian.2016.0044

