基于液质联用技术的金铃子散亚急性毒性代谢组学
沈淑洁+水素芳+肖炳坤+杨建云+黄荣清


[摘要] 为进一步了解金铃子散毒性影响的代谢特征,探索金铃子散在治疗过程中对未知生物通路的作用。该实验通过以金铃子散3组剂量的水煎剂对大鼠肝肾的影响,来研究金铃子散对大鼠体内代谢组改变的特点和规律。首先对给药2周和给药后1周大鼠尿液和血清样本采用质谱分析方法,通过XCMS在线分析大鼠正负模式离子检测谱,对代谢谱分析的代谢物进行鉴定,结果得到44个差异性物质。最后以MetPA对液质实验中筛选出的代谢物组进行代谢通路富集和分析,结果得到:类固醇激素合成代谢途径,戊糖和葡萄糖醛酸转换,赖氨酸代谢,谷胱甘肽代谢和抗坏血酸代谢5条相关的代谢通路。 由代谢网络图可以看出,与毒性相关的通路主要和生物体赖氨酸代谢、葡萄糖醛酸转化及激素代谢有关,尤其是赖氨酸和谷胱甘肽的代谢失衡,造成机体能量代谢或氧化应激调节的紊乱,产生大鼠体内的损伤。从金铃子散低、中、高3组剂量的亚急性毒性实验结果观察发现,金铃子散19.7 g·kg-1和 39.4 g·kg-1剂量组造成了明显的毒性作用,说明金铃子散在生物体内可产生毒性作用,且毒性随着给药剂量的增加而增加,造成不可逆的机体损伤。
[关键词] 金铃子散; 毒性; 代谢组学; 液质联用
[Abstract] To further understand the metabolic characteristics of Jinlingzi powder toxicity effect in rats and explore the effect of Jinlingzi powder on unknown biological pathways in the treatment process. In this experiment, the effect of three doses of Jinlingzi powder decoction on rat liver and kidney was investigated to explore the characteristics and rules of Jinlingzi powder on in vivo metabonomic changes in rats. First, urine and serum samples of the rats were used for LC-MS analysis. Under the XCMS online analysis, 44 differential substances were found in the identification of metabolites. Finally, Metpa was used for metabolic pathways enrichment and analysis, and five related metabolic pathways were obtained: steroid hormone biosynthesis, tryptophan metabolism, pentose and glucuronate interconversions, ascorbate and aldarate metabolism, as well as glutathione metabolism. Metabolic network diagram showed that the toxicity-related pathways were mainly associated with lysine metabolism in living organisms, glucuronic acid conversion, and hormone metabolism, especially the metabolism imbalance of lysine and glutathione would result in the disorder of energy metabolism or oxidative stress regulation, and thus inducing the damage in rats. Subacute toxicity test results for three doses groups (low, middle and high doses) showed that, Jinlingzi powder with doses of 19.7 g·kg-1 and 39.4 g·kg-1 caused obvious toxic effect, indicating Jinlingzi powder could produce toxic effect in vivo in a dose-dependent manner, and cause irreversible damage to the body.
[Key words] Jinlingzi powder; toxicity; metabonomics; LC-MS
代謝组学主要研究机体小分子代谢物与疾病的关系以及揭示机体内生物化学变化的规律。将这样的方法应用在中药毒性的研究中可以较容易的发现毒性作用的物质基础和作用机制,对追踪毒性作用的相关代谢途径,寻找代表性的生物标志物有重要作用[1-2]。
疏肝泄热名方金铃子散由川楝子和延胡索组成,而两药均有一定的肝肾毒性,尤其是川楝子早在《名医别录》就有记载“楝实有小毒。根微寒。治蛔虫, 利大肠。生荆山” [3]。 但作为中药复方金铃子散毒性的探索并没有报道,为进一步明确金铃子散对机体肝肾代谢机制的影响和产生的毒性作用,本实验从代谢组学的视角对金铃子散作用于肝肾毒性的影响以及毒性标志物的确定进行了初步研究。
1 材料与方法
1.1 仪器与试剂 Agilent 1200/6410三重四级杆液质联用仪(美国安捷伦科技有限公司);HP ODS C18色谱柱(4.6 mm×100 mm, 5 μm);大鼠不锈钢代谢笼(北京龙东海科研设备制造有限公司);TGL-16B台式离心机(上海安亭科学仪器厂);LGJ-25C冷冻干燥机(北京四环科学仪器厂)。
0.9%生理盐水(石家庄四药有限公司);甲酸(50%水溶液,色谱纯,美国 Sigma-Aldrich 化工有限公司);戊巴比妥钠(北京化学试剂公司);叠氮化钠(NaN3,英国Alfa Aesar化工有限公司);乙腈(色谱纯,美国赛默飞世尔科技有限公司);纯化水(屈臣氏集团有限公司);延胡索(北京同仁堂有限责任公司,批号404002248P);川楝子(北京同仁堂有限责任公司,批号101152286W)。
1.2 金铃子散水煎液的提取 川楝子和延胡索各1 000 g,加10倍量水浸泡6 h,煎煮1 h,用医用纱布过滤,混合第2次和第3次煎煮液,回流1 h,合并3次滤液,减压浓缩至浸膏状,浓缩至750 mL,然后在冷冻干燥机上进行干燥处理,浓缩液和药材之比为1∶2.67(相当于1 mL浓缩液含生药材2.67 g), 提取的生药量为37.5%,4 ℃冷藏备用。
1.3 动物分组及给药 SD大鼠雄性48只,体重 180~220 g,由军事医学科学院实验动物中心提供,许可证号SCXK-(军)2012-0004,所有大鼠均单代谢笼饲养,温度 23~25 ℃, 相对湿度保持在55%~65%,12 h明暗交替,自由摄食饮水。
适应环境1周后,随机分为金铃子散9.85,19.7,39.4 g·kg-1组(分别相当于成人临床给药剂量的 5,10,20倍)和空白对照组,每组12只。空白对照组给予相应体积的生理盐水,浸膏用生理盐水稀释后灌胃给药,给药量分别为9.85,19.7,39.4 g·kg-1,每天1次,连续给药2周。
1.4 样品采集及处理 给药2周后,每组取6只大鼠,2%戊巴比妥钠(40 mg·kg-1,ip)深度麻醉,下腔静脉采集血液,于室温下静置 10 min,析出血清,251.5×g 离心10 min,取血清于 EP管中, 置于-80 ℃冰箱保存。各实验组中剩下的6只进行恢复期间实验(不予灌药,自由饮食饮水,观察其体内受金铃子散毒性影响的恢复情况),期间不进行给药操作,自由饮食饮水,观察大鼠对金铃子散毒性的恢复情况,7 d后剖杀,收集血液,脏器(肝、肾)。大鼠尿液分别于第3天,第7天,第10天,第14天,第17天,第21天收集。收集的尿液于-80 ℃条件下低温保存。取200 μL解冻后血清加入800 μL乙腈溶液沉淀蛋白,4 ℃ 251.5×g离心15 min,移取上清液供 LC-MS分析。
1.5 色谱质谱条件 HP ODS C18 Hypersil色谱柱(4.6 mm×100 mm,5 μm);流动相A为H2O(含0.1%甲酸),流动相B为乙腈,梯度洗脱,0~3 min,5%~10% B,3~8 min,10%~55% B,8~12 min,55%~65% B,12~15 min,65%~90% B,15~22 min,90%~10% B,22~28 min,10%~5% B,流速0.3 mL·min-1;进样量2.0 μL;柱温30 ℃;检测波长254 nm。质谱条件:采用正负离子MS2 Scan 模式进行数据采集,干燥气温度350 ℃,干燥气流速10 L·min-1,雾化器压力50 psi(1 psi=6.895 kPa),毛细管电压(+)4 000 V,(-)3 500 V,扫描范围m/z 50~1 000,扫描时间200 s,Fragmentor 135 V,采集速度2 Hz,Delta EMV (+) 200 V,(-) 250 V。
1.6 数据处理 将液质联用采集到的数据上传至 XCMS 数据处理平台进行质谱特征离子评估。通过 XCMS分析结果对峰值保留时间偏差进行质控评价,手动提取组间差别较大的化合物信息(P<0.05),并根据平台生成的 PCA 结果,筛选多元统计分析中变异最大的化合物,通过匹配在线质谱数据库,鉴定并验证所得结果的正确性。将分析的数据上传到 MetPA 数据处理中心,通过与 KEGG 数据匹配ID 后,寻找相关的代谢通路和相关的网络构建。以 Fishers 正确性检验和超几何分布检验对数据在特定生物途径中的随机性进行测试。另外部分差异性代谢物通过在相同液相条件下,比对三重四极杆串联质谱仪上的保留时间和相对分子质量来确认。最后根据得到的 MetPA 预测数据,进行代谢机制推断和解释。
1.7 统计学分析 所得实验数据利用SPSS 19.0 软件进行组间样本方差分析(ANOVA),并结合方差分析中的 LSD 和 SNK 法对样本组间差异情况进行分析。
2 结果
2.1 大鼠尿液随时间变化的统计分析结果 取不同时间段金铃子散39.4 g·kg-1剂量组大鼠尿液进行液质数据采集,将LC-MS分析的结果进行统计分析。
差异代谢物组筛选与鉴定提取中,将液质联用分析的正负离子数据,经标度化预处理数据后,以XCMS 建立2种离子模式数据的 PCA 模型,见图1。正负离子模式下,主成分分析所得的前3个主成分方差贡献率(R2)及累计贡献率(Q2)分别为 0.610(0.871), 0.720(0.952)。说明2种模式下的 PCA 模型有60%以上的变量可用于预测金铃子散高剂量组毒性对不同剂量大鼠之间 87%以上的差异,模型预测能力良好。由图可以看出随着给药次数的累积,大鼠尿液里的代谢物变化逐渐偏离0 d时的代谢物组群,且呈现明显的规律性变化。
2.2 液质数据分析结果 为了减少组间差异,以随机进样的方式,交替进样。将LC-MS采集到的数据,通过 XCMS 对数据自动分析处理,XCMS 以 t 检验对2组间平均丰度值进行差异统计,以P<0.05 提取差异变量。剔除加合、同位素及碎片离子。并根据相同色谱条件下建立的標准化合物的液质数据验证化合物的准确性。结合多元统计分析的VIP的大小,大鼠血清和尿液最终在正负离子检测模式共提取到44个差异性代谢物。
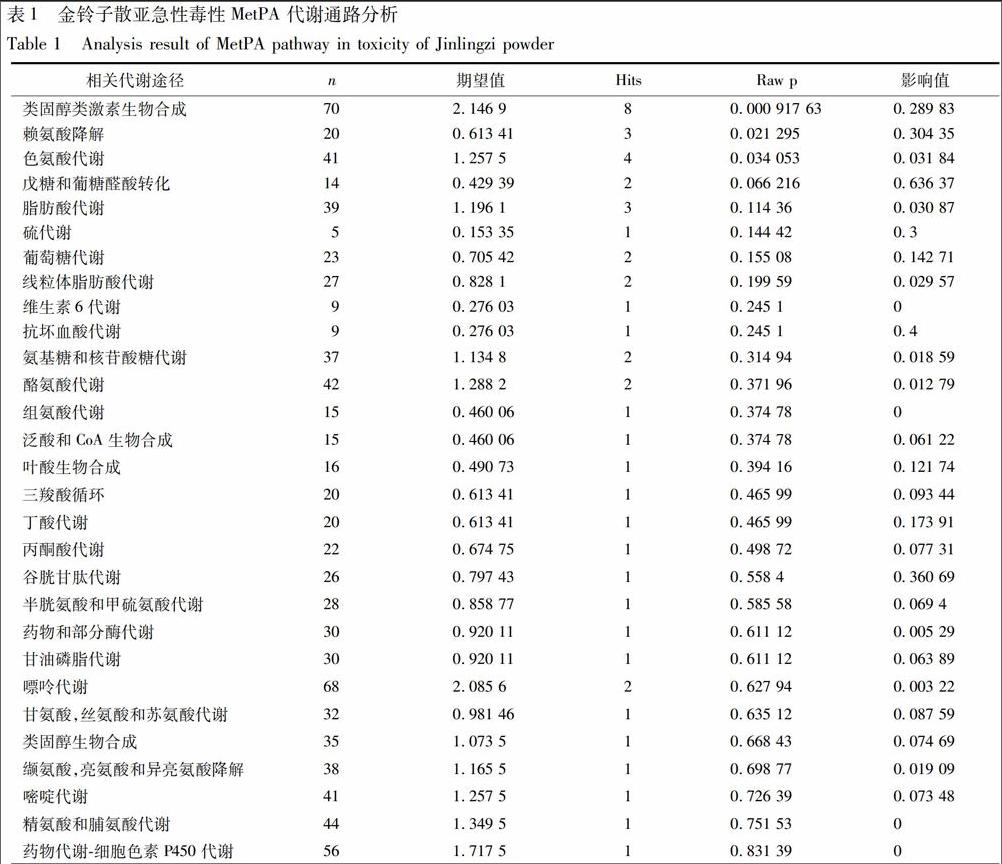
2.3 MetPA代謝途径分析 将液质联用筛选出的44个代谢物数据导入MetPA 进行代谢通路查询。相关 29条通路分析的详细结果见表1,综合 Raw p,Holm p,FDR,影响值结果,对与毒性相关代谢通路的重要性进行评价。结果得到5个代谢通路:类固醇激素的生物合成,而戊糖、葡萄糖醛酸转换,赖氨酸代谢,谷胱甘肽代谢和抗坏血酸代谢因具有较大影响值(>0.3)也被列为潜在的代谢途径,代谢通路分析见图2。
3 讨论
在本研究中,基于液质联用代谢组学研究方法, 通过比较金铃子散高、中、低剂量对大鼠代谢谱差异的影响,识别与毒性相关的代谢物通路,并进行代谢通路分析,见图3。由代谢网络图可以看出,与毒性相关的代谢通路主要和生物体氨基酸代谢、能量转换及激素代谢有关,这些代谢通路与肝脏线粒体功能相关性很大。
轭合反应指药物或其代谢物与生物机体的内源性物质相结合,产生极性更强的代谢物,更容易被排出体外,从而达到代谢的目的。葡萄糖醛酸轭合反应负责机体内多种外源和内源性化合物的清除,在多种药物及其氧化代谢产物、体内毒物、内源性激素、胆酸的代谢清除中发挥着重要作用[4-8]。葡萄糖醛酸转移酶将葡萄糖醛酸(LC-MS正离子模式579.9)生成葡萄糖醛酸苷产物,减少对目标靶的亲和性,增加了其在机体中的排泄,有更强的解毒和去活化作用[9-12]。金铃子散中剂量组葡萄糖醛酸轭合反应增加,排毒效果增加,而高剂量组含量相对较低,则说明肝肾受损,已不可逆转。
抗坏血酸(ascorbic acid)是生物体内重要的氧化还原剂,主要参与机体内活性氧的清除和细胞调控, 并作为多个酶的辅因子参与多种生理过程[13-15]。抗坏血酸能使过氧离子失活,有较为广泛的抗氧化损伤能力[16-17]。另外抗坏血酸与中性粒细胞内的谷胱甘肽相互作用,可调节细胞内氧化还原状态,从而使中性粒细胞产生氧自由基减少。金铃子散组中剂量组谷胱甘肽(LC-MS正离子模式304.1)含量较空白对照组下降,使得细胞抗氧自由基增加,使细胞损伤造成毒性。
类固醇是由机体内分泌腺分泌的亲脂性小分子化合物,一般作用于外周靶组织和中枢神经系统[18-19]。孕烯醇酮是所有类固醇激素的母体化合物,可以被氧化异构化成孕酮并经羟基化反应生成其他类固醇激素。当机体受到外界严重的应激反应时,下丘脑可产生促肾上腺皮质激素释放激素,经腺垂体产生促肾上腺皮质激素进而合成和分泌糖皮质激素皮质醇。皮质醇通过对中间代谢,炎症和免疫应答的作用,使机体对应激起反应,严重者造成肝肾毒性损伤[20]。从实验结果分析显示,金铃子散组孕烯醇酮(LC-MS负离子模式329.1)含量升高,皮质醇分泌代谢失衡,影响大鼠体内脂质代谢。
谷胱甘肽是谷胱甘肽转移酶(GSTs)催化反应中的底物, 在机体中可以有效清除机体内的毒性物质。还原型谷胱甘肽由谷氨酸、甘氨酸和半胱氨酸组成,能氧化分解体内的超氧因子,中和自由基对组织的损坏,防止因巯基氧化而导致的蛋白质变性,抑制细胞凋亡,降低炎症反应,调节脂质代谢,从而达到降低毒性的作用[21-23]。谷胱甘肽通过还原型谷胱甘肽和氧化型谷胱甘肽互相转化构成生物体的氧化还原缓冲系统,与亲电子基质结合后可清除体内的超氧离子和其他自由基[24-28]。另外,谷胱甘肽还可以通过谷氨酰胺循环途径维持蛋氨酸的含量,以保证转甲基及转丙氨基反应,促进胆酸代谢,从而加快机体受损功能的恢复[29]。当药物对生物体的肝肾造成损害时,使自由基产生增多,导致谷胱甘肽生成不足,启动了谷胱甘肽极度缺乏的恶性循环,引起全身性功能的下降与损害如脑、肝和肾等脏器。从实验结果来看金铃子散39.4 g·kg-1剂量组谷胱甘肽(LC-MS正离子模式304.1)含量降低,19.7 g·kg-1剂量组谷胱甘肽含量上升,推测高剂量组体内谷胱甘肽代谢调节已经损坏,而低剂量组有一定的调节作用。
赖氨酸在生物体内除了可以合成蛋白质外,还可通过脱氨作用参与三羧酸循环,提供能量。赖氨酸为戊二酰辅酶A脱氢酶的代谢底物,当戊二酰辅酶A脱氢酶不足时,产生赖氨酸代谢障碍,使四氢异喹啉在机体内蓄积[30]。另外在赖氨酸的降解过程中,酵母氨酸途径是其降解的主要通路[31-33]。与模型对照组相比金铃子散高剂量组四氢异喹啉(LC-MS正离子模式190)含量升高,推测金铃子散的毒性作用可能通过增强四氢异喹啉的代谢途径,影响赖氨酸的代谢途径,从而作用于线粒体的能量代谢或自由基的产生清除过程,导致氧化应激失衡,造成机体损伤。
本课题采用传统病理学实验方法与代谢组学分析技术相结合,对金铃子散进行毒性机制的探索。从实验结果来看,金铃子散各剂量组大鼠对外界刺激反应缓慢,金铃子散高剂量组给药后,不同时间段内尿液代谢物表型的聚类分布明显,且随给药时间的延长体内代谢物质的差异性逐渐增大,提示高剂量金铃子散灌胃给药后14 d,已经干扰了大鼠体内代谢物的组成,此时已存在潜在毒性。在代谢途径方面,赖氨酸代谢和谷胱甘肽代谢对大鼠体内毒性的影响最为显著。从金铃子散9.85,19.7, 39.4 g·kg-1组的亚急性毒性实验中观察发现,金铃子散19.7,39.4 g·kg-1剂量组可造成明显的肝肾毒性,9.85 g·kg-1剂量组毒性作用相对较弱。
[参考文献]
[1] Gonzalez F J, Fang Z Z, Ma X C. Transgenic mice and metabolomics for study of hepatic xenobiotic metabolism and toxicity[J]. Expert Opin Drug Metab Toxicol, 2015, 11(6): 869.
[2] Chen C, Kim S. LC-MS-based metabolomics of xenobiotic-induced toxicities[J].Comput Struct Biotechnol, 2013, 4 (5): e201301008.
[3] 熊彥红,齐双岩,金若敏.川楝子对大鼠肝毒性的时效和量效关系研究[J].江苏中医药,2008,40(7):83.
[4] Brandon E F A, Raap C D, Meijerman I, et al. An update on in vitro test methods in human hepatic drug biotransformation research: pros and cons [J]. Toxicol Appl Pharmacol,2003, 189: 233.
[5] Obach R. Pharmacologically active drug metabolites: impact on drug discovery and pharmacotherapy [J].Pharmacol Rev,2013,65(2): 578.
[6] Harbourt D, Fallon J, Ito S, et al. Quantification of human uridine-diphosphate glucuronosyl transferase 1A isoforms in liver, intestine, and kidney using nanobore liquid chromatography-tandem mass spectrometry [J]. Anal Chem, 2012, 84(1): 98.
[7] Zhu L, Ge G, Liu Y, et al. Characterization of UDP-glucuronosyltransferases involved in glucuronidation of diethylstilbestrol in human liver and intestine [J]. Chem Res Toxicol,2012, 25(12): 2663.
[8] Sun D X, Chen G, Dellinger R W, et al. Characterization of tamoxifen and 4 hydroxytamoxifen glucuronidation by human UGT 1A4 variants[J]. Breast Cancer Res, 2006,8(4): R50.
[9] Burchell B, Coughtrie M W H. UDP-glucuronosyltransferases[J].Pharmacol Therapeut,1989,43: 261.
[10] Tukey R H, Strassburg C P. Human UDP-glucuronosyltranferases:metabolism, expression, and disease [J]. Annu Rev Pharmacol and Toxicol, 2000, 40: 581.
[11] 史雪岩,葡萄糖醛酸轭合反应及其在药物代谢转化中的作用[J].科技导报,2010,28(4):101.
[12] Yang G, Zhu L, Lv X, et al. Highly efficient preparation of bisphenol A glucuronide [J].Chem J Chin Univ,2014,35(2): 314.
[13] 田俊芝,郭会彩,岳晓东.维生素C对纳米二氧化钛致小鼠心脏毒性的保护作用[J].中国药理学与毒理学杂志,2014,28(2):227.
[14] Kumar V, Rani A, Dixit A K, et al. A comparative assessment of total phenolic content, ferric reducing anti-oxidative power, free radical-scavenging activity, vitamin C and isoflavones content in soybean with varying seed coat colour[J]. Food Res Int,2010,43: 323.
[15] Fransson L A, Mani K. Novel aspects of vitamin C: howimportant is glypican-1 recycling[J].Trends Mol Med, 2007,13:143.
[16] Ishikawa T, Shigeoka S. Recent advances in ascorbate biosynthesis and the physiological significance of ascorbate peroxidase in photosynthesizing organisms[J]. Biosci Biotechnol Biochem,2008, 72:1143.
[17] 刘和俊,汪太平,李芹.维生素C对急性心肌梗死患者氧化代谢的影响[J].中国动脉硬化杂志,1999,7(3):228.
[18] Liu Y, Fang Y, Huang M. Uniconazole-induced starch accumulation in the bioenergy crop duckweed (Landoltia punctata)Ⅱ: transcriptome alterations of pathways involved in carbohydrate metabolism and endogenous hormone crosstalk[J]. Biotechnol Biofuels,2015,11(8):64.
[19] Taylor A E, Keevil B, Huhtaniemi I T. Mass spectrometry and immunoassay: how to measure steroid hormones today and tomorrow [J]. Eur J Endocrinol, 2015,173(2):1.
[20] Richard A Harvey, Denise R Ferrier. Lippincott,s illustrated reviews: biochemistry[M]. Philadelphia:Lippincott Williams & Wilkins, 2011.
[21] Rahman I, Biswas S K, Kode A. Oxidant and antioxidant balance in the airways and airway diseases[J]. Eur J Pharmacol, 2006,533:222.
[22] Valko M, Leibfritz D, Moncol J, et al. Free radicals and antioxidants innormal physiological functions and human disease[J]. Int J Biochem Cell Biol, 2007, 39:44.
[23] Limónpacheco J, Gonsebatt M E. The role of antioxidants and antioxidant-related enzymes in protective responses to environmentally induced oxidative stress[J]. Mutat Res, 2009, 674:137.
[24] Pajaud J, Ribault C, Ben Mosbah I, et al. Glutathione transferases P1/P2 regulate the timing of signaling pathway activations and cell cycle progression during mouse liver regeneration[J].Cell Death Dis,2015(6):e159.
[25] 杨美蓉,张英,尹翠兰. 多烯磷脂酰胆碱与还原型谷胱甘肽治疗肝衰竭临床疗效比较[J].实用肝脏病杂志,2012,15(5):444.
[26] 安鼎伟,李静,金丽君.还原型谷胱甘肽联合多烯磷脂酰胆碱治疗急性药物性肝损害的疗效观察[J].中国药房,2011,22(28):2642.
[27] 張汉平,李卫平,聂显栋.还原型谷胱甘肽治疗药物性肝损害的临床疗效分析[J].河北医药,2010,32(21):65.
[28] Rybka J, Kupczyk D K,dziora-Kornatowska K, et al.Glutathione-related antioxidant defense system in elderly patients treated for hypertension[J]. Cardiovasc Toxicol,2011,11:1.
[29] 胡金波,谷恒存,丁志山.基于LC-MS的系统性红斑狼疮小鼠的代谢组学研究[J].浙江中医药大学学报,2012,36(12):1325.
[30] Moroni F, Russi P, Lombardi G, et al. Presence of kynurenic acid in the mammalian brain[J]. J Neurochem,2006,51(1):177.
[31] Miihlhausen C,Burckhardt B C, Hagos Y. Membrane translocation of glutaricacid and its derivatives[J]. Inherit Metab Dis, 2008, 31(2):188.
[32] Gale M, Yan Q. High-throughput screening to identify inhibitors of lysine demethylases[J].Epigenomics, 2015, 7(1):57.

