内源性氧化胁迫促进酿酒酵母合成谷胱甘肽的潜在机制分析
王立梅,任清华,郑丽雪,孙 姜,齐 斌,朱益波,*
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.烟台啤酒青岛朝日有限公司,山东 烟台 264000;3.中海海洋无锡海洋工程装备有限公司,江苏 无锡 214000)
内源性氧化胁迫促进酿酒酵母合成谷胱甘肽的潜在机制分析
王立梅1,任清华2,郑丽雪1,孙 姜3,齐 斌1,朱益波1,*
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.烟台啤酒青岛朝日有限公司,山东 烟台 264000;3.中海海洋无锡海洋工程装备有限公司,江苏 无锡 214000)
利用转录组学分析手段结合生理生化特性来研究酿酒酵母突变株高产谷胱甘肽的潜在机制。结果表明:突变株谷胱甘肽合成限速酶、抗氧化酶活力及其编码基因表达量、过氧化氢和还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)含量显著提高;丙酮酸激酶活力、丙酮酸、柠檬酸和琥珀酸含量显著降低;此外,三羧酸循环和磷酸戊糖途径的基因表达量分别显著下调和上调。因此,突变株可能在遭受内源性活性氧过氧化氢的胁迫下,通过调节谷胱甘肽合成限速酶活力加强了谷胱甘肽的合成,与抗氧化酶共同抵御氧化胁迫;丙酮酸激酶活力减弱降低了丙酮酸的合成,减少了三羧酸循环的通量,使得磷酸戊糖途径通量增加,从而提高了NADPH含量,为谷胱甘肽的合成提供了充足的还原力。
谷胱甘肽;氧化胁迫;酿酒酵母;还原型辅酶Ⅱ
谷胱甘肽(glutathione,GSH)是一类普遍存在于生物体内的活性小肽化合物[1-3],具有解毒[4]、抗氧化[5]和增强免疫力[6]等多种生物学功能,能够清除外源异物[7],抵御由活性氧造成的氧化性损伤[8]以及增强白细胞的免疫功能[9]。随着各种生物活性功能的不断揭晓,GSH的应用范围也越来越广泛[10-12],国内外的需求量日益增大,其中存在的巨大商业价值推动了GSH的工业化生产。
GSH主要的生产方法包括溶剂萃取法[13]、化学合成法[14]、酶转化法[15]和微生物发酵法[16]。其中微生物发酵法是最高效最经济的GSH工业化生产方法。酿酒酵母(Saccharomyces cerevisiae)是目前最常用的一种GSH微生物发酵菌株,胞内GSH合成能力强,安全无毒。然而,普通的S. cerevisiae菌株GSH产量一般不足细胞干质量的1%[17],因此研究者不断地通过一些物理和化学方法(紫外[18]、亚硝基胍[19]和γ-射线[20]等)对S. cerevisiae进行诱变处理从而筛选高产GSH的突变菌株。
转录组学是指一门从整体层面上研究特定细胞中基因转录情况及转录调控规律的学科,主要建立在测序技术的基础上。RNA高通量测序(RNA-Seq)是一种新的测序技术,能够提供全面的转录组方面的信息,检测灵敏,重复性好,准确率高,样品用量少,操作简便[21]。从而为研究生物体在不同条件下的基因转录情况提供了便利、高效和功能强大的技术平台。
在之前的研究中,以保藏的S. cerevisiae 2-10515为出发菌株,利用化学诱变剂亚硝基胍诱变筛选得到一株高产GSH的S. cerevisiae突变株Y518,本研究在此基础上,通过转录组学分析手段结合生理生化特性来进一步研究突变株Y518高产GSH的潜在机制。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
S. cerevisiae 2-10515(出发菌株)和S. cerevisiae Y518(突变株)由苏州食品生物技术重点实验室筛选保藏。
1.1.2 试剂
柠檬酸和琥珀酸标准品 美国Sigma公司;GSH和氧化型谷胱甘肽(oxidized glutathione,GSSG)检测试剂盒、过氧化氢检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、谷胱甘肽过氧化物酶(glutathion peroxidase,GPX)检测试剂盒 上海碧云天生物技术有限公司;还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)测试盒、丙酮酸测试盒、γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)测试盒、丙酮酸激酶测试盒 苏州科铭生物技术有限公司;总RNA提取试剂盒 德国Qiagen公司;其他试剂均为国产分析纯。
1.1.3 培养基
S. cerevisiae培养基[22]:酵母膏5 g/L、葡萄糖20 g/L、磷酸二氢钾6 g/L、硫酸钾3 g/L、硫酸铵5 g/L、硫酸镁1.5 g/L,pH 6.0。
1.2 仪器与设备
UV-2450分光光度计、LC-20A高效液相色谱仪、Shim-pack VP-ODS C18柱(250 mm×4.6 mm,5 μm) 日本岛津公司;酶标仪 美国Bio-Rad公司;TissueLyserⅡ高通量组织破碎仪 德国Qiagen公司;2100生物分析仪 美国Agilent公司;HiSeq 2000测序仪美国Illumina公司。
1.3 方法
1.3.1 发酵
分别将活化好的出发菌株和突变株单菌落接种到种子培养基中,于30 ℃、180 r/min条件下培养18 h,再将种子液等量接种到发酵培养基中,于相同条件下发酵培养48 h。
1.3.2 GSH和GSSG含量测定
取发酵液于12 000 r/min、4 ℃离心5 min,收集菌体细胞并用磷酸盐缓冲液洗涤一次后按照GSH和GSSG检测试剂盒说明书的要求利用酶标仪进行测定,测定结果用mg/g细胞干质量表示。细胞干质量于105 ℃条件下烘干测定。
1.3.3 总RNA提取和高通量测序
菌体细胞用冷的DEPC水洗涤2 次并用液氮猝灭2 min,按照总RNA提取试剂盒说明书要求用高通量组织破碎仪破壁后提取总RNA。RNA高通量测序委托深圳华大基因研究院进行,原始数据已上传GEO数据库(http://www.ncbi.nlm.nih.gov/geo/query/acc. cgi?acc=GSE47787)。具体步骤如下:总RNA样品质量经生物分析仪检测合格后进行cDNA文库的构建;cDNA文库构建合格后利用测序仪进行序列鉴定,测序仪产生的原始数据(raw reads)经过去杂处理转换成clean reads用于后续数据分析;利用SOAP2序列比对软件将获得的clean reads与S. cerevisiae S288c参考基因序列进行比对计算基因表达量并筛选出差异表达基因(上调或下调的倍数不小于1),后续分析中Gene Ontology(GO)和KEGG Pathway显著性富集分析都是基于差异表达基因进行的;GO功能显著性富集分析能够筛选出差异表达基因显著富集的GO功能条目,并鉴定出这些差异表达基因参与哪些生物学功能;KEGG Pathway显著性富集分析能够筛选出差异表达基因显著性富集的通路,从而了解这些差异表达基因主要参与的生化代谢途径和信号转导途径。
1.3.4 过氧化氢和抗氧化酶活力测定
过氧化氢和抗氧化酶(SOD、CAT和GPX)活力分别参照各自的检测试剂盒说明书在酶标仪上进行测定。1.3.5 γ-GCS活力、丙酮酸激酶活力、NADPH和丙酮酸含量测定
γ-GCS活力、丙酮酸激酶活力、NADPH和丙酮酸含量按照各自测试盒说明书的要求在分光光度计上进行测定。
1.3.6 柠檬酸和琥珀酸含量测定
利用高效液相色谱法测定柠檬酸和琥珀酸的含量[23],分析条件为:分离柱Shim-pack VP-ODS C18、流动相0.5%磷酸氢二铵、流速0.8 mL/min,进样量20 μL、柱温25 ℃、检测波长215 nm。
2 结果与分析
2.1 GSH产量

图1 Y518和2-10515胞内GSH(A)和GSSG(B)含量Fig.1 Intracellular GSH (A) and GSSG (B) contents of the mutant Y518 and the parent strain 2-10515
Y518 GSH含量在前48 h逐渐增加,48~60 h有所降低(图1A),GSSG含量逐渐减少(图1B),说明随着发酵时间的延长有部分GSSG逐渐转化成GSH;2-10515 GSH和GSSG含量均逐渐降低(图1),说明两者之间的转化保持平衡;而在一个完整的发酵周期内,Y518 GSH产量比2-10515提高了约55%,表明突变株胞内积累GSH的能力比出发菌株强。为了进一步揭示突变株Y518胞内GSH合成增强的机制,进行了以RNA-Seq为基础的转录组学分析。
2.2 GO功能显著性富集分析
RNA-Seq共鉴定筛选出1 628 个差异表达基因,对这些差异表达基因进行GO分析发现在分子功能类群下有6 个差异表达基因参与抗氧化活性功能(图2)。GPX2/HYR1编码GPX,CTT1编码CAT,TRR1/TRR2编码硫氧还蛋白还原酶,它们能够催化清除过氧化氢;而SOD1编码Cu/Zn SOD,能够催化清除超氧阴离子自由基。Y518的这6 个基因中除了TRR1下调外其余均显著上调(表1),表明Y518胞内可能存在氧化胁迫。

图2 GO功能显著性富集分析Fig.2 GO functional enrichment analysis

表1 Y518参与抗氧化活性功能的差异表达基因Table1 Up- or down-regulated expression of antioxidant enzyme gens in Y518 relative to 2-10515
2.3 KEGG Pathway显著性富集分析

表2 Y518上调的磷酸戊糖途径基因表达量Table2 Up-regulated expression of genes involved in the pentose phosphate pathway in Y518 relative to 2-10515

表3 Y518下调的三羧酸循环基因表达量Table3 Down-regulated expression of genes involved the citrate cycle pathway in Y518 relative to 2-10515
为了进一步了解这些差异表达基因在代谢途径里的变化情况,对差异表达基因进行KEGG Pathway分析,结果显示磷酸戊糖通路基因显著上调(上调倍数不小于2)(表2),而三羧酸循环通路基因显著下调(下调倍数不小于2)(表3),表明磷酸戊糖途径的通量可能加强而三羧酸循环的通量可能减弱。GO和KEGG Pathway显著性富集分析都是基于基因层面进行的分析,并不能完全说明突变株高产GSH的表观现象,所以进行了一些生理生化特性方面的研究。
2.4 GSH合成限速酶活力变化

图3 Y518和2-10515 GSH合成限速酶活力变化Fig.3 The activities of rate-limiting enzymes for GSH synthesis of Y518 and 2-10515
γ-GCS是催化合成GSH反应的限速酶[24],其活力强弱直接影响GSH的产量。如图3所示,在发酵过程中,Y518和2-10515的γ-GCS活力均呈现出下降的趋势,6~24 h,Y518的γ-GCS活力高于2-10515,48 h略低于2-10515。整体而言,Y518的γ-GCS活力显著高于2-10515,说明Y518 GSH产量的提高和γ-GCS活力的增强有关。
2.5 抗氧化酶活力和过氧化氢含量变化
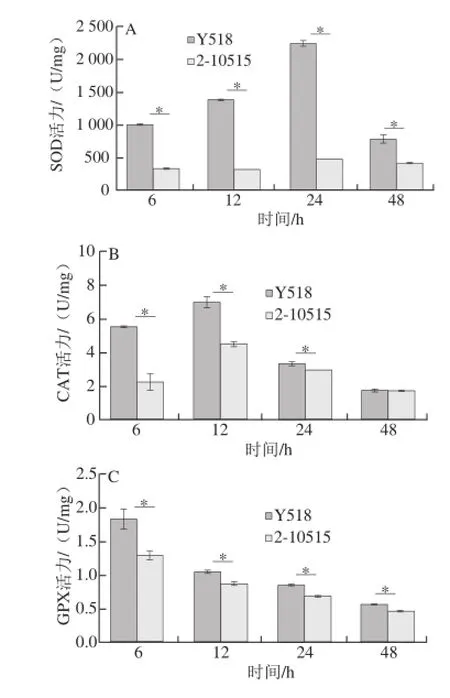
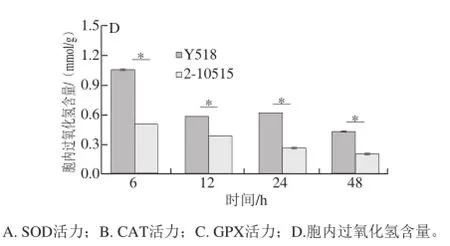
图4 Y518和2-10515抗氧化酶活力和胞内过氧化氢含量变化Fig.4 Antioxidant enzymes activities and intracellular hydrogen peroxide contents of Y518 and 2-10515
SOD[25]、CAT[26]和GPX[27]是细胞防御体系重要的抗氧化酶,能够催化氧化还原反应清除活性氧,抵御氧化性损伤。Y518 SOD活力在6~24 h逐渐增加,24~48 h下降,而2-10515 SOD活力则变化很小(图4A);两者CAT的活力变化趋势一致,都是从6~12 h增加,12~48 h逐渐下降(图4B);两株菌GPX的活力在6~48 h都呈下降趋势(图4C)。在整个发酵过程中,Y518的3 种酶活力均显著高于2-10515,而之前的研究中发现Y518胞内活性氧水平显著高于出发菌株2-10515[28],表明Y518胞内存在由活性氧引起的氧化胁迫,GO功能显著性富集分析显示,参与抗氧化活性功能的6 个差异表达基因中有5 个基因的主要功能是清除活性氧过氧化氢,因此继续测定突变株和出发菌株胞内过氧化氢的含量,结果显示,Y518胞内过氧化氢含量几乎是2-10515的两倍多(图4D),因此,Y518可能遭受由活性氧过氧化氢引起的内源性氧化胁迫,从而启动抗氧化酶和提高GSH含量来抵御氧化性损伤[29]。
2.6 NADPH含量变化
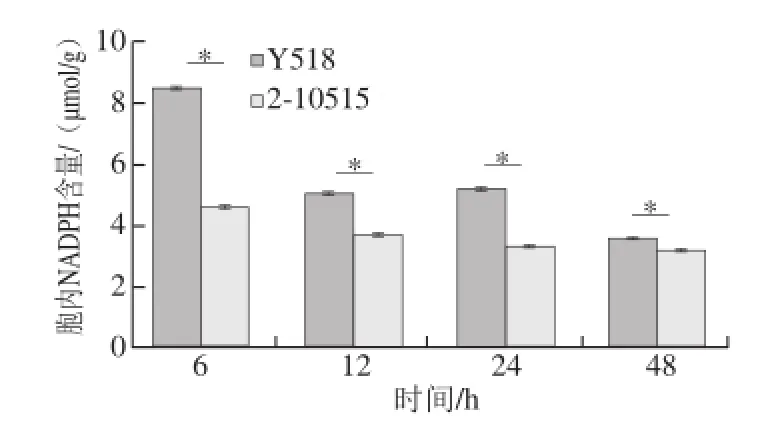
图5 Y518和2-10515胞内NADPH含量变化Fig.5 Intracellular NADPH contents of Y518 and 2-10515
如图5所示,Y518胞内NADPH显著高于2-10515,能够为Y518转化GSSG生成GSH提供充足的还原力[30]。而NADPH主要产生于磷酸戊糖途径,通过KEGG Pathway显著性富集分析发现,相对于2-10515,Y518磷酸戊糖途径整体基因表达量显著上调(表2),通量增加,因此,Y518胞内NADPH含量的提高可能是由于磷酸戊糖途径通量增加导致的。
2.7 丙酮酸激酶活力和丙酮酸含量变化

图6 Y518和2-10515丙酮酸激酶活力(A)和胞内丙酮酸含量(B)变化Fig.6 Pyruvatekinase activities (A) and intracellular pyruvate contents (B) of Y518 and 2-10515
丙酮酸激酶催化糖酵解途径最后一步将磷酸烯醇式丙酮酸转化成丙酮酸,而丙酮酸又是进入三羧酸循环的关键代谢物,Y518丙酮酸激酶活力和胞内丙酮酸含量均显著低于2-10515(图6),说明Y518减弱了丙酮酸激酶活力从而减少了丙酮酸的生成,这有可能会降低三羧酸循环的通量[31]。
2.8 柠檬酸和琥珀酸含量变化

图7 Y518和2-10515胞内柠檬酸(A)和琥珀酸(B)含量变化Fig.7 Intracellular contents of citrate (A) and succinate (B) of Y518 and 2-10515
KEGG Pathway显著性富集分析发现,Y518三羧酸循环整体基因表达量显著下调(表3),而重要中间产物柠檬酸和琥珀酸含量也显著减少(图7),说明三羧酸循环的通量的确降低,而糖酵解途径和磷酸戊糖途径是互补的两个通路,所以磷酸戊糖途径通量的增加可能是三羧酸循环通量降低导致的[31]。
2.9 突变株Y518高产GSH的机制
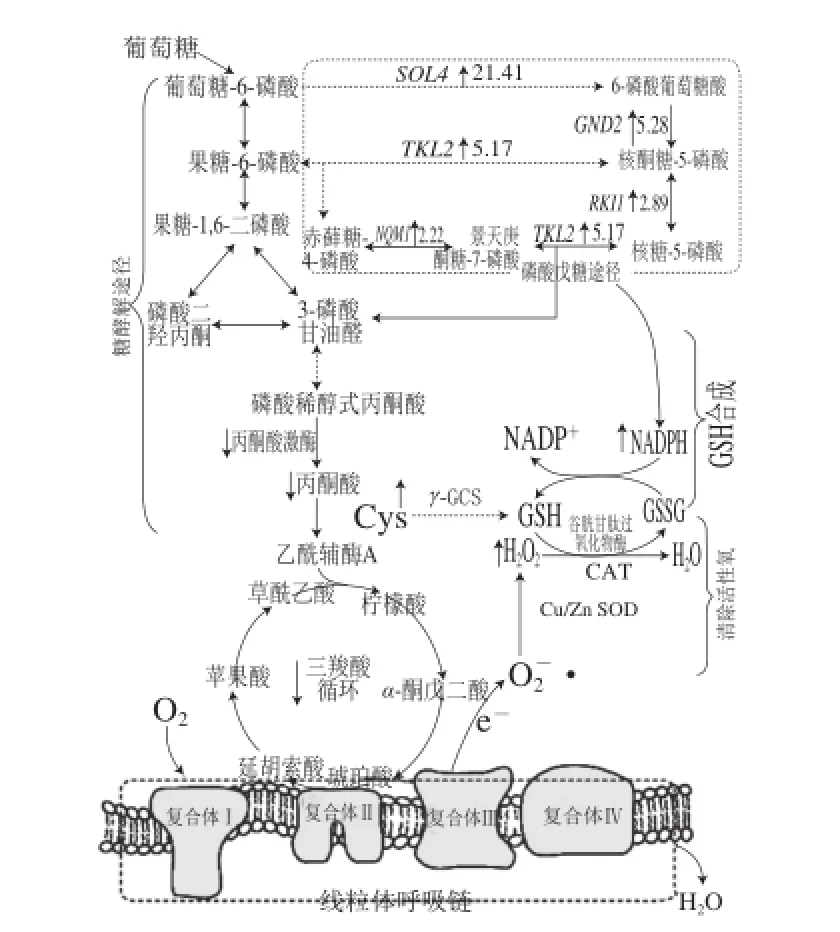
图8 Y518高产GSH的机制Fig.8 Mechanism underlying glutathione oversynthesis in Y518
从图8可以看出,过氧化氢含量的提高产生了氧化胁迫,Y518增强了抗氧化酶的活力,提高了胞内还原力,增加了GSH的含量,共同抵御氧化胁迫。
3 结 论
以亚硝基胍诱变筛选出的一株高产G S H的Saccharomyces cerevisiae突变株Y518为研究对象,通过转录组学分析手段结合生理生化特性初步探索了突变株高产GSH的潜在机制。研究表明突变株Y518胞内可能存在由活性氧过氧化氢引起的氧化胁迫,从而启动了一系列的防御机制来维持胞内氧化还原环境的平衡。一方面通过增强GSH合成限速酶的活力促进GSH合成来抵御氧化胁迫;另一方面通过增加磷酸戊糖途径的通量加强NADPH的产生为GSSG转化成GSH提供充足的还原力。
[1] 陈志颖, 张子健, 焦瑞杰, 等. 利用啤酒废酵母扩培物制备富含谷胱甘肽酵母抽提物[J]. 中国酿造, 2015, 34(11): 61-65. DOI:10.11882/ j.issn.0254-5071.2015.11.014.
[2] 姚晨阳, 刘敬, 张启美, 等. 谷胱甘肽在水产养殖中的应用研究进展[J]. 山东科学, 2016, 29(1): 105-109. DOI:10.3976/ j.issn.1002-4026.2016.01.018.
[3] 郑丽雪, 谢群凡, 王立梅, 等. 不同pH值酿酒酵母分批发酵生产谷胱甘肽数学模型建立[J]. 食品科学, 2013, 34(13): 162-164. DOI:10.7506/spkx1002-6630-201313035.
[4] RECIO L, SHEPARD K G, HERNÁNDEZ L G, et al. Dose-response assessment of naphthalene-induced genotoxicity and glutathione detoxication in human TK6 lymphoblasts[J]. Toxicological Sciences, 2012, 126(2): 405-412. DOI:10.1093/toxsci/kfs012.
[5] SAFONOVA O A, POPOVA T N, KRYL’SKII E D, et al. Synthesis and estimation of the inf l uence of 2,4-dimethoxyphenylbiguanide on the glutathione antioxidant system activity in heart and blood serum of rats with experimental rheumatoid arthritis[J]. Pharmaceutical Chemistry Journal, 2016, 49(11): 749-752. DOI:10.1007/s11094-016-1364-7.
[6] KEI H, SATOSHI F, PAWEL B, et al. Glutathione and tryptophan metabolism are required for Arabidopsis immunity during the hypersensitive response to hemibiotrophs[J]. Proceedings of the National Academy of Sciences, 2013, 110(23): 9585-9594. DOI:10.1073/pnas.1305745110.
[7] CAROLE M, CHARLOTTE J, JEAN-FRANÇOIS M, et al. The utilization of sulfur amino acid in the mercapturate pathway to detoxify maximal therapeutic dose of acetaminophen is associated with glutathione and protein homeosteny in adult rats[J]. Faseb Journal, 2013, 27(7): 295-310.
[8] SULLIVAN L, MARTINEZ-GARCIA E, NGUYEN H, et al. The proto-oncometabolite fumarate binds glutathione to amplify ROS-dependent signaling[J]. Molecular Cell, 2013, 51(2): 236-248. DOI:10.1016/j.molcel.2013.05.003.
[9] MING J H, YE J Y, ZHANG Y X, et al. Effects of dietary reduced glutathione on growth performance, non-specif i c immunity, antioxidant capacity and expression levels of IGF-I and HSP70 mRNA of grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2015, 438: 39-46. DOI:10.1016/j.aquaculture.2014.12.038.
[10] 李纯伟. 还原型谷胱甘肽在肝硬化治疗中的应用[J]. 中外医学研究, 2015(31): 46-47. DOI:10.14033/j.cnki.cfmr.2015.31.022.
[11] 冮洁, 单立峰. 谷胱甘肽的生产及其在食品工业中的应用[J]. 中国调味品, 2009, 34(2): 40-44. DOI:10.3969/ j.issn.1000-9973.2009.02.006.
[12] 李晓玲, 马志敏, 郝秀玲, 等. 香烟提取物对肺泡上皮细胞的影响及还原型谷胱甘肽的干预作用[J]. 临床荟萃, 2015, 30(8): 875-879. DOI:10.3969/j.issn.1004-583X.2015.08.009.
[13] 刘千, 陈黎, 胡用军, 等. 麦胚谷胱甘肽提取与含量测定方法研究[J]. 中国粮油学报, 2012, 27(10): 104-108. DOI:10.3969/ j.issn.1003-0174.2012.10.021.
[14] 周佳栋, 曹飞, 张小龙, 等. 一种基于共保护策略合成谷胱甘肽的新方法[J]. 有机化学, 2009, 29(8): 1272-1277.
[15] 李鑫. HPLC法检测酶法合成中还原型/氧化型谷胱甘肽[J]. 广东化工, 2014, 41(5): 158-159. DOI:10.3969/j.issn.1007-1865.2014.05.082.
[16] 孙姜, 朱益波, 王立梅, 等. 原生质体诱变选育高产GSH菌株及基因表达分析[J]. 食品科学, 2013, 34(23): 176-179. DOI:10.7506/ spkx1002-6630-201323037.
[17] PENNINCKX M J, JASPERS C J, LEGRAIN M J. The glutathionedependent glyoxalase pathway in the yeast Saccharomyces cerevisiae[J]. Journal of Biological Chemistry, 1983, 258(10): 6030-6036.
[18] 胡林华, 谭天伟. 高产谷胱甘肽酵母菌株的选育和培养条件的初探[J]. 高校化学工程学报, 2005, 19(2): 273-276. DOI:10.3321/ j.issn:1003-9015.2005.02.025.
[19] 王雅楠, 梅艳珍, 郑丽雪, 等. 高产GSH酵母突变株Y518谷胱甘肽合成酶结构分析[J]. 食品科学, 2009, 30(17): 258-261. DOI:10.3321/ j.issn:1002-6630.2009.17.059.
[20] 邵娜, 卫功元, 葛晓光, 等. 紫外线γ-射线复合诱变筛选S-腺苷甲硫氨酸和谷胱甘肽联产发酵菌株[J]. 辐射研究与辐射工艺学报, 2010, 28(2): 107-113.
[21] TRAPNELL C, ROBERTS A, GOFF L, et al. Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cuff l inks[J]. Psychopharmacology, 2012, 7(5): 562-578. DOI:10.1038/nprot.2012.016.
[22] 冮洁, 卜红宇. 酿酒酵母菌产谷胱甘肽的发酵条件研究[J]. 中国酿造, 2009, 28(1): 59-61. DOI:10.3969/j.issn.0254-5071.2009.01.018.
[23] 张利, 成建国, 张善飞, 等. 不同代数酿酒酵母对有机酸代谢的影响[J].食品工业科技, 2012, 33(9): 202-204.
[24] GAVIN F, WALLACE B. Glutamate cysteine ligase and the agerelated decline in cellular glutathione: the therapeutic potential of γ-glutamylcysteine[J]. Archives of Biochemistry & Biophysics, 2016, 593(5): 12-23. DOI:10.1016/j.abb.2016.01.017.
[25] GAJERA H P, KATAKPARA Z A, PATEL S V, et al. Antioxidant defense response induced by Trichoderma viride against Aspergillus niger Van Tieghem causing collar rot in groundnut (Arachis hypogaea L.)[J]. Microbial Pathogenesis, 2016, 91(1): 26-34. DOI:10.1016/ j.micpath.2015.11.010.
[26] SANI M, SEBAI H, REFINETTI R, et al. Effects of sodium nitroprusside on mouse erythrocyte catalase activity and malondialdehyde status[J]. Drug & Chemical Toxicology, 2016, 39(3): 350-356. DOI:10.3109/01480545.2015.1122032.
[27] WIRTH T. Kleine Organoselenverbindungen: mehr als nur mimetika der glutathion-peroxidase[J]. Angewandte Chemie, 2015, 127(35): 10212-10214. DOI:10.1002/ange.201505056.
[28] ZHU Y Y, SUN J, ZHU Y Y, et al. Endogenic oxidative stress response contributes to glutathione over-accumulation in mutant Saccharomyces cerevisiae Y518[J]. Applied Microbiology & Biotechnology, 2015, 99(17): 7069-7078. DOI:10.1007/s00253-015-6629-7.
[29] LI L, DU J, LIAN Y, et al. Protective effects of coenzyme Q10 against hydrogen peroxide-induced oxidative stress in PC12 cell: the role of Nrf2 and antioxidant enzymes[J]. Cellular & Molecular Neurobiology, 2016, 36(1): 103-111. DOI:10.1007/s10571-015-0224-4.
[30] DONG L H, LI L, SONG Y, et al. TRAF6-mediated SM22α K21 ubiquitination promotes G6PD activation and NADPH production, contributing to GSH homeostasis and VSMC survival in vitro and in vivo[J]. Circulation Research, 2015, 117(8): 684-694. DOI:10.1161/ CIRCRESAHA.115.306233.
[31] GRÜNING N M, RINNERTHALER M, BLUEMLEIN K, et al. Pyruvate kinase triggers a metabolic feedback loop that controls redox metabolism in respiring cells[J]. Cell Metabolism, 2011, 14(3): 415-427. DOI:10.1016/j.cmet.2011.06.017.
Elucidation of the Underlying Mechanism by Which Endogenous Oxidative Stress Promotes Glutathione Synthesis of Saccharomyces cerevisiae
WANG Limei1, REN Qinghua2, ZHENG Lixue1, SUN Jiang3, QI Bin1, ZHU Yibo1,*
(1. College of Biological and Food Engineering, Changshu Institute of Technology, Changshu 215500, China; 2. Yantai Beer Tsingtao Asahi Co. Ltd., Yantai 264000, China; 3. Wuxi Ocean Engineering Equipment Co. Ltd. of Zhonghai Ocean, Wuxi 214000, China)
The potential mechanism for glutathione oversynthesis in the Saccharomyces cerevisiae mutant Y518 was researched using transcriptome analysis combined with physiological and biochemical characteristics. The results indicated that the rate-limiting enzyme of glutathione synthesis, antioxidant enzymes activities and the expression levels of their encoding genes, and the contents of hydrogen peroxide and nicotinamide adenine dinucleotide phosphate (NADPH) were signif i cantly increased in the mutant whereas pyruvatekinase activity, the contents of pyruvate, citrate and succinate were markedly decreased. Besides, the expression levels of genes involved in the citrate cycle were significantly down-regulated while those involved in the pentose phosphate pathway were signif i cantly up-regulated. Therefore, under endogenous oxidative stress, the mutant might strengthen the synthesis of glutathione by adjusting the activities of rate-limiting enzymes of glutathione synthesis to defend against oxidative stress together with the antioxidant enzymes. Meanwhile, weakened pyruvatekinase activity decreased pyruvate generation, which led to declined citrate cycle fl ux and increased NADPH production by the pentose phosphate pathway and consequently provided appropriate reducing power for glutathione biosynthesis.
glutathione; oxidative stress; Saccharomyces cerevisiae; NADPH
10.7506/spkx1002-6630-201704005
Q815
A
1002-6630(2017)04-0026-06
王立梅, 任清华, 郑丽雪, 等. 内源性氧化胁迫促进酿酒酵母合成谷胱甘肽的潜在机制分析[J]. 食品科学, 2017, 38(4): 26-31. DOI:10.7506/spkx1002-6630-201704005. http://www.spkx.net.cn
WANG Limei, REN Qinghua, ZHENG Lixue, et al. Elucidation of the underlying mechanism by which endogenous oxidative stress promotes glutathione synthesis of Saccharomyces cerevisiae[J]. Food Science, 2017, 38(4): 26-31. (in Chinese with English abstract)
10.7506/spkx1002-6630-201704005. http://www.spkx.net.cn
2016-03-28
国家自然科学基金面上项目(31171758)
王立梅(1964—),女,教授,博士,研究方向为食品生物技术。E-mail:wlmqb@126.com
*通信作者:朱益波(1980—)男,副教授,博士,研究方向为食品生物技术。E-mail:centuryrain@cslg.edu.cn

