研究植物乳杆菌对肠道细菌易位的抑制作用
李京京,尤焕焕,王 丹,赵永峰,王 斌
研究植物乳杆菌对肠道细菌易位的抑制作用
李京京1,尤焕焕1,王 丹1,赵永峰1,王 斌2
目的 研究植物乳杆菌对肠道细菌易位的抑制作用。方法 将SD大鼠随机分为4组,即假手术对照组,乳杆菌L2灌胃组,缺血再灌注(Ischemia/Reperfusion, I/R)组,乳杆菌预处理+缺血再灌注组。观察各组动物肠黏膜形态病理学变化、肠道菌群变化、细菌易位、血浆细胞因子的水平。结果 与假手术对照组相比,缺血再灌注组大鼠肠黏膜有明显病理损伤改变,肠黏膜出现坏死、脱落。肠道内厌氧菌数量显著下降,肠杆菌数量也有所下降。在肝、脾、肾及肠系膜淋巴结中有细菌存在,其易位率达87.5%(P<0.01)。乳杆菌灌胃组大鼠各项指标无显著变化,乳杆菌预处理+I/R组其变化程度较之缺血再灌注组显著减弱。结论 植物乳杆菌L2能够抑制肠道缺血再灌注损伤引起的细菌易位,减弱其对肠黏膜屏障的损伤。
植物乳杆菌;抑制;肠道;缺血再灌注;细菌易位
细菌易位是指原存在于肠腔中的细菌或内毒素,通过某种途径穿过肠黏膜屏障,进入肠系膜淋巴结、门静脉系统,继而进入体循环以及肝、脾、肾等实质器官的过程[1]。随着对全身炎性反应综合征(systemic inflammatory response syndrome,SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的深入研究,发现危重患者中的感染,绝大多数是由肠源性微生物引起的,因此,肠源性感染细菌易位被认为是引发SIRS和MODS的主要原因[2-4]。大量的临床研究表明,肠道缺血再灌注(I/R)损伤可以诱发肠黏膜屏障受损和细菌易位。肠道I/R损伤是一个复杂的病理生理过程,各种创伤、大出血、心源性或感染性休克发生时,机体为保护心、脑等重要脏器,血液重新分布,肠黏膜及黏膜下层血流减少,缺血而使组织内含氧量降低,血管通透性增加,组织间隙渗出液增多,形成组织水肿,黏膜上皮紧密连接受损。血流再灌注后引发的炎性反应进一步造成大量炎性反应细胞的组织浸润以及炎性介质的释放,最终导致肠黏膜坏死,通透性增高,细菌通过肠黏膜屏障,形成肠道细菌易位[5-7]。
乳杆菌是人体肠道内重要的生理有益菌,它具有维持胃肠道内稳,抑制病原菌的入侵和感染及增强机体免疫力等作用。但是乳杆菌的益生特性具有菌株特异性,不同菌株之间其功能差异很大。本课题组前期筛选了一株益生性能较好的植物乳杆菌L2,为了进一步了解该菌株对肠黏膜屏障的保护作用,本研究拟通过建立肠道I/R模型诱发肠道细菌易位,观察植物乳杆菌L2对肠道细菌易位的抑制作用,以期为阐明乳杆菌保护肠黏膜屏障的可能机制提供实验依据。
1 材料与方法
1.1 材料 植物乳杆菌L2(Lactobacillus plantarum)分离自人的肠道,由本室保存。将菌株接种于新鲜配制的MRS液体培养基,37 ℃培养24 h。SD大鼠,32只,雌性,南京军区南京总医院实验动物中心提供,体重180~200 g。
1.2 实验分组 SD大鼠32只,随机分为以下4组,每组8只。假手术对照组;乳杆菌灌胃组(每日灌胃植物乳杆菌L2 2 ml/次/d,菌液浓度为4×1010CFU/ml,连续灌胃14 d);缺血再灌注模型组;乳杆菌预处理+缺血再灌注组(术前每日灌胃植物乳杆菌L2 2 ml/次/d,菌液浓度为4×1010CFU/ml,连续灌胃14 d,后进行缺血再灌注手术)。
1.3 缺血再灌注模型 将SD大鼠麻醉(氯胺酮腹腔注射,2 mg/kg)。沿腹白线切开,暴露腹腔。无菌游离肠系膜上动脉,用血管夹夹闭肠系膜上动脉,30 min后松开血管夹,使血流再灌注。后关腹,4 h后处死动物,收集标本。
1.4 检测指标及方法
1.4.1 细菌易位检测 无菌取肠系膜淋巴结、肝、脾、肾1 g,将其置于灭菌的玻璃匀浆器中,加入生理盐水5 ml,进行组织匀浆,后取匀浆液100 μl,分别接种于血平板和BHI培养基,将血平板置于37 ℃培养18~24 h,BHI平板置于厌氧培养箱中培养48~72 h,然后进行计数,并对菌落进行鉴定。
1.4.2 肠道菌群分析 无菌采集新鲜盲肠内容物0.5~1.0 g,确定重量后,将样品置于加有稀释液的无菌三角瓶中,充分震荡20 min后,混匀后系列稀释,分别接种选择性培养基,进行培养。肠杆菌、肠球菌分别接种于EMB琼脂和EC琼脂,37 ℃培养18~24 h。乳杆菌接种于MRS,双歧杆菌接种于改良的BS琼脂,拟杆菌接种于BBE琼脂,分别置于37 ℃厌氧培养48~72 h。待菌落长出后,以菌落形态,革兰染色,生化反应等进行细菌鉴定,计算每克盲肠内容物中的细菌数量。
1.4.3 血浆细胞因子的检测 无菌抽取下腔静脉血2 ml,置于肝素抗凝管中,3000 rpm离心20 min,吸取上层血浆,置于-80 ℃冰箱中,统一检测。采用ELISA法检测TNF-α和IL-6,按其说明书进行。
1.4.4 形态病理学观察 无菌行剖腹术,距回盲部以上4 cm处,取回肠组织2~4 cm,用PBS缓冲液轻微冲洗后,置10%中性甲醛溶液中固定,石蜡包埋,切片,常规HE染色,光镜观察。
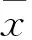
2 结 果
2.1 细菌易位分析 结果显示,I/R组与假手术对照组相比,在其肠系膜淋巴结、肝、脾、肾等实质器官中均发现了大量的细菌,其易位率为87.5%(P<0.01)。乳杆菌L2灌胃组,在其肠系膜淋巴结、肝、脾、肾等实质器官中并未检出细菌。而乳杆菌L2+I/R组中,分别有两只动物在其肠系膜淋巴结和脾脏中检出细菌,但数量明显要少于I/R组,其易位率为25%,差异无统计学意义。与I/R组相比,其细菌易位率差异有统计学意义(P<0.05,表1、2)。

表1 各组大鼠肠道细菌易位的分析结果 (n=8)
注:与假手术对照组比较,①P<0.01;与I/R模型组比较,②P<0.01
2.2 肠道菌群 肠道菌群计数结果显示, I/R组与假手术对照组相比,厌氧的革兰阳性乳杆菌、双歧杆菌,以及革兰阴性拟杆菌数量显著下降(P<0.01),革兰阴性肠杆菌数量也有所下降(P<0.05),而肠球菌数量却无明显变化。乳杆菌L2灌胃组中,厌氧菌和兼性厌氧菌的数量与假手术对照组相比无显著变化。乳杆菌L2预处理+I/R组中,厌氧的拟杆菌、双歧杆菌,以及乳杆菌的数量与假手术对照组相比,无显著变化,但肠杆菌的数量有所上升(P<0.05)。与I/R组相比,其拟杆菌、双歧杆菌以及乳杆菌的数量显著增高(P<0.05,表3)。
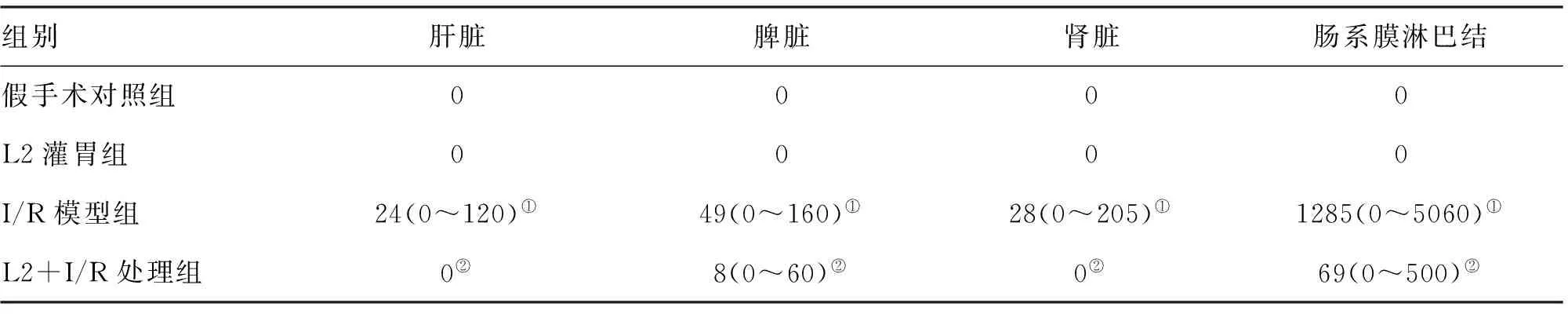
表2 各组大鼠组织器官细菌易位检测结果 (n=8)
注:与假手术对照组相比,①P<0.01;与I/R模型组相比,②P<0.01

表3 各组动物盲肠内容物肠道菌群分析结果 (log10 CFU/g;n=8)
注:与假手术对照组比较,①P<0.05;与I/R模型组比较,②P<0.05
2.3 血浆细胞因子浓度的变化 采用ELISA法分别检测了各组大鼠血浆中TNF-α 和 IL-6的浓度(图1),结果显示,与假手术组相比,I/R组大鼠血浆TNF-α水平显著增加(P<0.01),IL-6水平略有增加,但无显著性差异。乳杆菌L2灌胃组中,其TNF-α和IL-6水平与假手术对照组相比,无显著性差异。而在乳杆菌L2预处理+I/R组中,其TNF-α水平与假手术对照组相比略有降低,但无显著性差异。但与I/R组相比,其TNF-α水平差异有统计学意义(P<0.01)。其IL-6水平与假手术对照组和I/R组相比,差异均无统计学意义。
2.4 形态病理学观察 光镜观察结果显示,与假手术对照组相比,I/R组大鼠在缺血再灌注后4 h,其肠黏膜水肿、萎缩,可见大量炎性细胞浸润。肠黏膜发生坏死、脱落,肠绒毛排列紊乱、稀疏,上皮细胞脱落;乳杆菌L2灌胃组大鼠肠黏膜完整,肠绒毛排列整齐,未见上皮细胞脱落;乳杆菌L2预处理+I/R组大鼠肠黏膜病变明显减轻,肠黏膜及绒毛高度明显增加,绒毛轻度水肿,仅见少量炎性细胞浸润,绒毛排列较为整齐、致密,未见上皮细胞脱落(图2)。
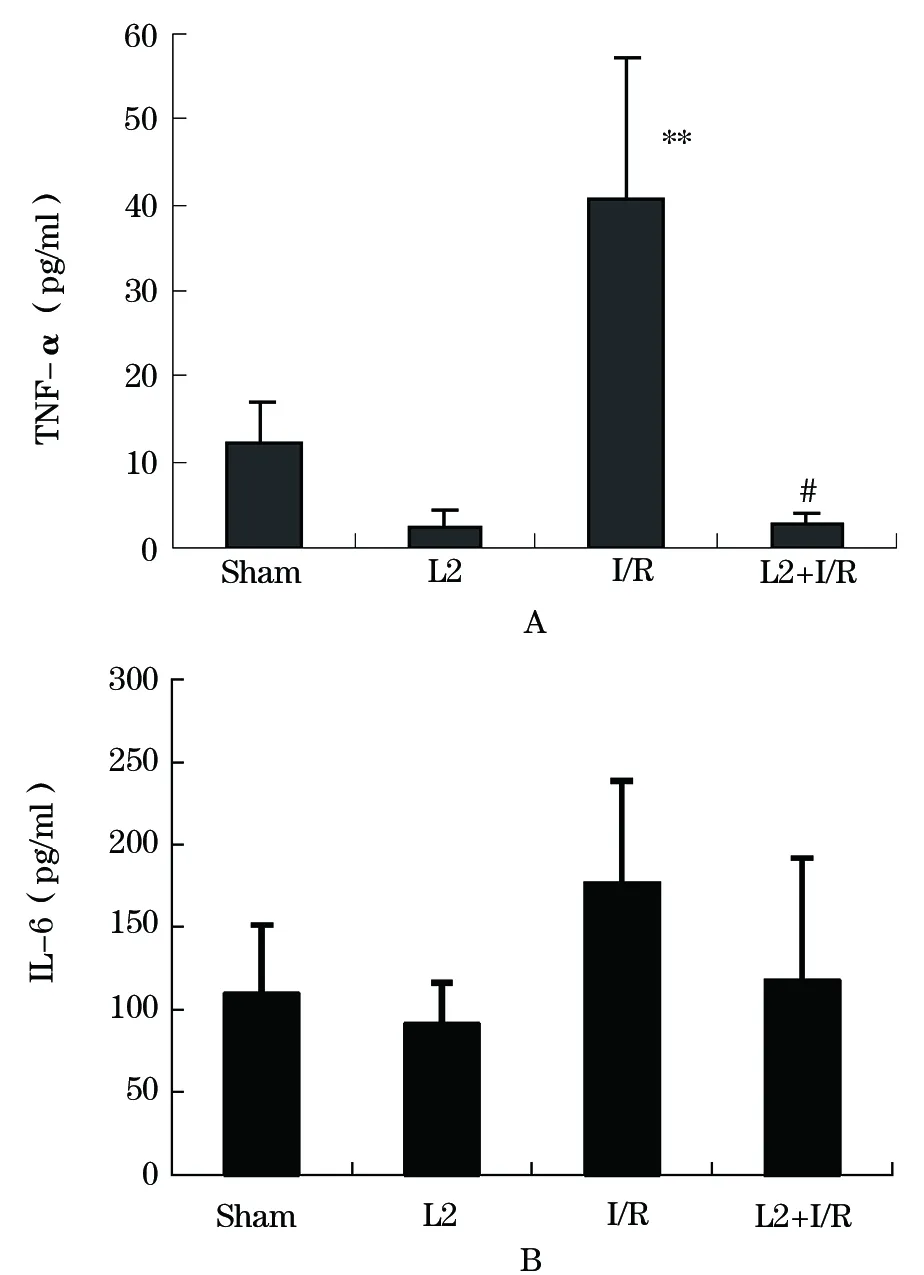
图1 各组大鼠血浆细胞因子检测结果

图2 大鼠肠黏膜组织形态学观察(HE,×200)
3 讨 论
本研究发现,在肠道缺血30 min,再灌注后4 h(I-30 min/R-4 h),肠黏膜已发生严重坏死、脱落,大量细菌易位至肠系膜淋巴结、肝、脾、肾等实质器官中,其易位率达87.5%。肠黏膜上皮细胞对缺氧极为敏感,既便是很短时间的缺血、缺氧,都可造成肠上皮细胞的损伤。血流再灌注后,诱发大量的炎性细胞因子和活性氧自由基,进一步加重了对肠黏膜屏障的损伤,诱使肠腔中的细菌穿过肠黏膜进入体循环。后者一旦大量进入血液,就会进一步导致多种炎性介质的过度释放,引发或加重过度炎性反应,形成一种恶性循环[8-11]。本研究发现,I/R损伤4 h后,血浆中炎性细胞因子TNF-α水平显著增加,并且从肠黏膜形态病理学观察中也发现,存在有大量的炎性细胞浸润,这与以往的报道相符[12,13],表明炎性反应是造成肠黏膜屏障损伤的一个重要因素。
植物乳杆菌L2是本课题组从人体肠道中分离的一株益生菌,前期大量的实验均已证实其具有优良的益生特性。在本研究发现,预防性给予植物乳杆菌L2,可有效地抑制肠道I/R损伤引起的细菌易位,并且减弱I/R造成的肠黏膜损伤。以往的研究显示,乳酸菌对肠黏膜屏障的保护作用大多通过调节菌群失调、维护肠道微生态平衡等。在本研究中,肠道菌群分析结果显示,植物乳杆菌L2能够有效地促进有益的厌氧菌的生长,调节肠道菌群紊乱,这可能是它保护肠黏膜屏障的方式之一。另外,值得注意是,植物乳杆菌L2能够明显降低I/R损伤时血浆中炎性细胞因子TNF-α的水平,本研究的前期研究结果显示,植物乳杆菌L2能够抑制外周血单核细胞释放TNF-α[14],这与本研究的前期体外研究结果相符。
综上所述,表明植物乳杆菌L2具有抑制过度炎性反应,参与调控肠道内稳的作用。对于I/R造成的肠黏膜损伤,与大量使用抗生素所致的肠黏膜损伤不同,I/R可引起较为严重的机械屏障损伤,致使肠腔中大量的细菌发生易位。因此,该菌株还可能具有维护肠黏膜机械屏障的作用。对于植物乳杆菌抑制I/R引起的细菌易位的分子机制,有待于进一步进行深入的研究。
[1] Steinberg S M. Bacterial translocation: what it is and what it is not[J]. Am J Surg, 2003, 186 (3): 301-305.
[2] Shimizu K, Ogura H, Goto M,etal. Altered gut flora and environment in patients with severe SIRS[J]. J Trauma, 2006, 60 (1):126-133.
[3] Gatt M, Reddy B S, MacFie J. Bacterial translocation in the critically ill-evidence and methods of prevention[J]. Aliment Pharmacol Ther, 2007, 25 (7): 741-757.
[4] Reddy B S, MacFie J, Gatt M,etal. Commensal bacteria do translocate across the intestinal barrier in surgical patients[J]. Clin Nutr, 2007, 26 (2): 208-215.
[5] Yüksek Y N, Kologlu M, Daglar G,etal. Intestinal ischemia-reperfusion injury augments intestinal mucosal injury and bacterial translocation in jaundiced rats[J]. Hepatogastroenterology, 2004, 51 (55): 171-175.
[6] Matthijsen R A, Derikx J P, Kuipers D,etal. Enterocyte shedding and epithelial lining repair following ischemia of the human small intestine attenuate inflammation[J]. PLoS One, 2009, 4 (9): e7045.
[7] Amaral F A, Fagundes C T, Guabiraba R,etal. The role of macrophage migration inhibitory factor in the cascade of events leading to reperfusion-induced inflammatory injury and lethality[J]. Am J Pathol, 2007, 171 (6):1887-1893.
[8] Souza D G, Amaral F A, Fagundes C T,etal. The long pentraxin PTX3 is crucial for tissue inflammation after intestinal ischemia and reperfusion in mice[J]. Am J Pathol, 2009, 174 (4): 1309-1318.
[9] Stefanutti G, Pierro A, Parkinson EJ,etal. Moderate hypothermia as a rescue therapy against intestinal ischemia and reperfusion injury in the rat[J]. Crit Care Med, 2008, 36 (5):1564-1572.
[10] Stefanutti G, Pierro A, Vinardi S,etal. Moderate hypothermia protects against systemic oxidative stress in a rat model of intestinal ischemia and reperfusion injury[J]. Shock, 2005, 24 (2):159-164.
[11] Leaphart C L, Tepas J J.The gut is a motor of organ system dysfunction [J]. Surgery,2007,141(5):563-569.
[12] Fagundes C T, Amaral F A, Souza A L,etal. ST2, an IL-1R family member, attenuates inflammation and lethality after intestinal ischemia and reperfusion[J]. J Leukoc Biol, 2007, 81 (2): 492-499.
[13] Tadros T, Traber D L, Heggers J P,etal. Effects of interleukin-1alpha administration on intestinal ischemia and reperfusion injury, mucosal permeability, and bacterial translocation in burn and sepsis[J]. Ann Surg, 2003, 237 (1): 101-109.
[14] Wang Bin, Li Jieshou, Li Qiurong,etal. Isolation of adhesive strains and evaluation of the colonization and immune response by Lactobacillus plantarum L2 in the rat gastrointestinal tract [J]. Int J Food Microbiol, 2009, 132 (1): 59-66.
(2016-09-17收稿 2016-12-30修回)
(责任编辑 张 楠)
Lactobacillusplantarumprevents bacterial translocation induced by intestinal ischemia and reperfusion injury in rats
LI Jingjing1, YOU Huanhuan1, WANG Dan1,ZHAO Yongfeng1,and WANG Bin2.
1.Department of Ultrasonic Sound, Nanjing Hospital of Armed Police Force, Nanjing 210008,China; 2.Jiangsu Academy of Science and Technology for Inspection and Quarantine, Nanjing 210001,China
Objective To investigate the ability ofLactobacillusplantarumL2 to prevent intestinal ischemia and reperfusion induced bacterial translocation.Methods 32 SD rats were randomly divided into four groups: sham, Lactobacillus intragastric administration, ischemia and reperfusion (I/R) model, Lactobacillus pre-treatment and I/R model. The bacterial translocation, changes of gut microflora, levels of proinflammatory cytokines in plasma and intestinal morphology were observed.Results The increase in bacterial translocation was significant after 4 h I/R treatment (P<0.01) as compared with sham-operated group. There were obvious pathological changes of mucosal morphology in I/R rats and the number of anaerobic bacteria such as Bifidobacteria, Lactobacillus and Bacteroides was significantly reduced. The level of TNF-α in plasma was increased after I/R injury.Lactobacillusplantarumtreatment alone had no effect on intestinal barrier function. However, pretreatment of rats withLactobacillusplantarumL2 significantly abrogated I/R induced intestinal mucosal injury and prevented translocation of bacteria to mesenteric lymph nodes or to remote organs.ConclusionsLactobacillusplantarumL2 has the ability to prevent bacterial translocation and attenuate I/R induced intestinal injury.
Lactobacillusplantarum;prevent;gut;ischemia and reperfusion;bacterial translocation
江苏省自然科学基金(BK20141518)
李京京,硕士研究生,主治医师。
1.210008 南京,武警江苏总队南京医院影像科;
2.210001 南京,江苏省检验检疫科学技术研究院
王 斌,E-mail: wangbin301@sohu.com
R378.2

