地氟烷预处理对大鼠离体心脏缺血再灌注损伤的影响及作用机制
梁 宁 刘 玲 陈 萍
(重庆医科大学附属第一医院麻醉科,重庆 400016)
地氟烷预处理对大鼠离体心脏缺血再灌注损伤的影响及作用机制
梁 宁 刘 玲 陈 萍
(重庆医科大学附属第一医院麻醉科,重庆 400016)
目的 探讨地氟烷预处理在大鼠离体心脏缺血再灌注(IR)中的保护作用是否与单磷酸腺苷激活的蛋白激酶(AMPK)有关。方法 清洁级健康雄性大鼠50只,2~3月龄,体重250~280 g,切取离体心脏并随机分为正常对照(C)组、IR组、地氟烷预处理+IR(DR)组、地氟烷预处理+AMPK抑制剂+IR(DC)组和IR+AMPK抑制剂(CR)组各10只。DR组和DC组在给予大鼠吸入1 MAC的地氟烷30 min后立即切取心脏。采用Langendorff灌注装置并以95%O2~5%CO2饱和的K-H液作为灌注液,在平衡灌注15 min后,停止灌注30 min后再灌注60 min建立IR模型。分别在停止灌注前和再灌注60 min时记录心率(HR)、左室发展压(LVDP)、左室内压最大上升速率(+dp/dt)和左室内压最大下降速率(-dp/dt)。采用caspase-3活性检测试剂盒测定心肌组织内caspase-3活性,酶联免疫吸附(ELISA)法检测冠脉流出液中心肌肌钙蛋白(cTn)I浓度。采用免疫组织化学法和Western印迹法检测心肌组织内AMPK(Thr-172)的磷酸化水平。结果 与C组比较,IR组离体心脏再灌注60 min时HR、LVDP、+dp/dt和-dp/dt显著降低(P<0.05),心肌组织caspase-3活性和冠脉流出液中cTnI浓度显著升高(P<0.05),而AMPK(Thr-172)的磷酸化水平无显著差异(P>0.05)。与IR组比较,DR组HR、LVDP、+dp/dt和-dp/dt显著升高(P<0.05),caspase-3活性和cTnI浓度显著降低(P<0.05),AMPK(Thr-172)的磷酸化水平显著升高(P<0.05)。而与DR组比较,DC组HR、LVDP、+dp/dt和-dp/dt显著降低(P<0.05),caspase-3活性和cTnI浓度显著升高(P<0.05),AMPK(Thr-172)的磷酸化水平显著降低(P<0.05)。结论 地氟烷预处理使IR后心肌组织内AMPK(Thr-172)磷酸化水平升高而被激活,是其缓解心肌IR损伤的机制之一。
地氟烷;单磷酸腺苷激活的蛋白激酶(AMPK);心肌缺血再灌注损伤
心肌细胞能量代谢障碍是缺血再灌注(IR)时心肌受损的重要因素。单磷酸腺苷激活的蛋白激酶(AMPK)是调节细胞内能量代谢的关键酶〔1〕。大量研究表明,AMPK参与减轻IR后的心肌损伤〔2~5〕。地氟烷是临床上应用日益广泛的吸入麻醉药。研究指出,缺血心肌在采用含地氟烷的灌注液进行再灌注时可减轻心肌IR损伤〔6〕,然而其保护机制尚不明确。目前,地氟烷的心肌保护作用是否与AMPK有关鲜有报道。本研究拟以离体大鼠心脏IR损伤作为模型,探讨地氟烷预处理能否激活AMPK及AMPK是否参与地氟烷的心肌保护作用。
1 材料与方法
1.1 实验动物及离体心脏灌注模型的建立 实验操作均严格遵守美国国立卫生院《实验动物使用和处理指南》(No.80~23,Rev.1996)的要求,通过重庆医科大学动物伦理委员会的审查。清洁级健康雄性SD大鼠50只,2~3月龄,体重250~280 g,由重庆医科大学实验动物中心提供。腹腔注射肝素2 U/g抗凝,10 min后腹腔注射乌拉坦1.5 g/kg的麻醉条件下将大鼠仰卧固定于手术台上,开胸并暴露心脏,从主动脉弓处离断主动脉后取出心脏。将离体心脏置于4℃K-H液〔成分:118 mmol/L NaCl、1.2 mmol/L MgSO4·7H2O、4.7 mmol/L KCl、1.2 mmol/L KH2PO4、25 mmol/L NaHCO3、11 mmol/L 葡萄糖和10 mmol/L羟乙基哌嗪乙硫磺酸(HEPES),pH7.35〕中,剪去多余组织,并立即挂于Langendorff灌注装置(Radnoti公司,美国)上,经主动脉灌注95%O2~5%CO2饱和的K-H液15 min(平衡灌注),灌注液温36.5℃~37.5℃,灌注压75 cmH2O(1 cmH2O=0.098 kPa)。
1.2 分组处理 采用随机数字表法,将离体心脏随机分为5组(n=10):正常对照(C)组、IR组、地氟烷预处理+IR(DR)组、地氟烷预处理+AMPK抑制剂Compound C+IR(DC)组和IR+Compound C(CR)组。试验中均采用95%O2~5%CO2饱和的K-H液作为灌注液。平衡灌注完成后,C组持续灌注90 min,其余各组先停止灌注30 min,随即再灌注60 min。DR组和DC组在给予大鼠吸入1 MAC的地氟烷30 min后再立即切取心脏。DC组和CR组在再灌注时采用含有10 μmol/L Compound C(Millipore公司,美国)的灌注液。采用地氟烷挥发罐(Dräger公司,德国)对地氟烷进行浓度调节。
1.3 心功能指标测定 在离体心脏左心耳做一小口,将带乳胶球囊的导管插入左心房,并沿二尖瓣进入左心室,导管经压力传感器与信号采集系统(型号:RM6240,成都仪器厂)连接。分别在停止灌注前(T1)和再灌注60 min时(T2)测定心率(HR)、左室发展压(LVDP)、左室内压最大上升速率(+dp/dt)和左室内压最大下降速率(-dp/dt)。
1.4 心肌组织内caspase-3活性检测 在心功能指标检测完成并且冠脉流出液收集完成后,将心脏置于4℃磷酸盐缓冲液(PBS)液中清洗3次,在冰浴条件下剪碎心脏,研磨匀浆并加入裂解液裂解心肌细胞。低温12 000 r/min离心10 min(离心半径10 cm),提取上清液。采用聚氰基丙烯酸正丁酯(BCA)蛋白浓度检测试剂盒检测样本中蛋白浓度。将蛋白样本存于-70℃备用。采用caspase-3活性检测试剂盒测定蛋白样本中caspase-3活性。按照说明书的操作进行。
1.5 冠脉流出液中心肌肌钙蛋白(cTn)I含量测定 再灌注结束时,分别收集各组离体心脏冠脉流出液。采用大鼠cTnI酶联免疫检测试剂盒(R&D公司,美国)并按照说明书操作。
1.6 免疫组化法检测心肌组织内AMPK(Thr-172)的磷酸化水平 在心功能指标检测完成并且冠脉流出液收集完成后,将心脏石蜡包埋并切片(厚度4 μm)。经二甲苯脱蜡和梯度酒精浸泡并PBS冲洗后,在95℃条件下枸橼酸钠缓冲液(10 μmol/L,pH6.0)抗原修复20 min。5%山羊血清封闭1 h,孵育兔抗大鼠p-AMPK(Thr-172)抗体(1∶50,Cell Signaling公司,美国),4℃过夜。采用免疫组化二抗试剂盒(博士德生物工程有限公司,武汉)并按照试剂盒说明书进行以下实验。图片结果由BX51 Olympus显微镜获得。每张切片随机获取5个视野,并采用Image-Pro Plus 6.0图像分析软件(Media Cybernetics公司,美国)分析视野光密度值(OD)。
1.7 Western印迹法心肌组织内AMPK(Thr-172)的磷酸化水平 蛋白样本的制备同测定caspase-3活性时的制备方法。蛋白样本50 μg在80 V电压下于十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)中电泳,之后将凝胶中的目标蛋白电转于聚偏二氟乙烯(PVDF)膜(Millipore公司,美国)上。含5%脱脂奶粉的Tris-盐酸氯化钠和Tween 20混合液(TBST)液中封闭膜2 h,之后孵以兔抗大鼠p-AMPK(Thr-172)抗体(稀释度1∶1 000),并在4℃环境中过夜。PBS洗涤3次(每次10 min),将辣根过氧化物酶标记的山羊抗兔IgG(博士德生物工程有限公司,武汉)孵于膜上,并在37℃环境中孵育2 h。再次PBS洗涤3次,使用电化学发光(ECL)-plus显色剂在Bio-Rad显色仪中显色。采用Quentity One软件测定条带灰度值。以蛋白样本中GAPDH表达量作为内参。
1.8 统计学处理 采用SPSS17.0 统计学软件进行单因素方差分析,两两比较行Tukey法。
2 结 果
2.1 各组离体心脏心功能指标的比较 各组离体心脏T1各心功能指标的值均无统计学差异(P>0.05)。T2时,与C组比较,IR组离体心脏的HR、LVDP、+dp/dt和-dp/dt显著降低(P<0.05);与IR组比较,DR组离体心脏的HR、LVDP、+dp/dt和-dp/dt显著升高(P<0.05);而与DR组比较,DC组离体心脏的HR、LVDP、+dp/dt和-dp/dt再次降低(P<0.05)。见表1。
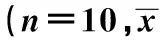
表1 各组离体心脏心功能指标的比较±s)
与C组比较:1)P<0.05;与IR组比较:2)P<0.05;与DR组比较:3)P<0.05,下表同
2.2 各组冠脉流出液cTnI浓度和心肌组织内caspase-3活性的比较 与C组比较,IR组离体心脏在再灌注结束时的冠脉流出液中cTnI浓度、心肌组织内caspase-3活性显著升高(P<0.05)。与IR组比较,DR组冠脉流出液中cTnI浓度、心肌组织内caspase-3活性显著降低(P<0.05)。而与DR组比较,DC组冠脉流出液中cTnI浓度、心肌组织内caspase-3活性再次升高(P<0.05)。见表2。
2.3 各组心肌组织内AMPK(Thr-172)磷酸化水平的比较 与C组比较,IR组离体心脏心肌组织内AMPK(Thr-172)磷酸化水平无明显改变(P>0.05)。与IR组比较,DR组离体心脏心肌组织内AMPK(Thr-172)磷酸化水平显著升高(P<0.05)。而与DR组比较,DC组AMPK(Thr-172)磷酸化水平降低(P<0.05)。见表2。

表2 各组冠脉流出液cTnI浓度和心肌组织内caspase-3、 AMPK(Thr-172)磷酸化水平的比较
3 讨 论
本研究采用参考文献〔7〕的方法制备离体心脏IR模型,该模型排除了体液和神经因素的影响。本研究说明IR损伤模型建立成功。本研究参考文献〔8〕的方法在切取大鼠心脏前给予30 min 1 MAC的地氟烷吸入,使用了地氟烷的心脏进行再灌注后,心功能改善,caspase-3活性降低,冠脉流出液中cTnI浓度降低,说明地氟烷预处理的心肌保护作用。同时,地氟烷预处理提高心肌组织内AMPK的磷酸化水平,提示其改善缺血再灌注心肌组织内的AMPK活性。本研究参考文献〔9〕选择AMPK抑制剂Compound C浓度(10 μmol/L),结果提示,地氟烷改善心肌IR损伤的作用与提高心肌组织内AMPK的活性有关。
地氟烷预处理和后处理均能减轻心肌IR损伤,其心肌保护机制尚不明确。地氟烷的心肌保护作用可能包括抑制线粒体通透性转移孔(mPTP)开放、促进ATP敏感性线粒体钾通道(mitoKATP)开放和促进一氧化氮的合成等〔10,11〕。本实验揭示地氟烷的心肌保护作用可能与能量代谢调节有关。
能量代谢障碍和细胞凋亡是IR后心肌受损和心功能障碍的重要因素。心肌组织遭受IR损伤后心肌细胞内线粒体功能障碍,使细胞产能受损。细胞内能量缺乏可致胞内生物反应无法正常完成及生物膜完整性无法正常保持,导致促凋亡因子的产生或从细胞器内漏出,进而激活心肌细胞内凋亡发生途径,导致凋亡关键蛋白caspase-3的激活,这是IR时心肌细胞凋亡的途径之一〔12〕。AMPK是调节能量代谢的关键酶,其第172位苏氨酸(Thr-172)位点的磷酸化是其发挥酶活性的关键〔1〕。在应激条件下,AMPK能增强细胞内的产能过程而抑制耗能反应,进而维持受损情况下的细胞功能。研究指出,在心肌缺血时,心肌组织内AMPK(Thr-172)的磷酸化水平提高〔2〕,激活的AMPK能增加心肌细胞的葡萄糖摄取和糖酵解,进而减轻缺血后心肌凋亡〔3〕,这可能是心肌组织在应激条件下的自我保护反应。另外,AMPK亦能抑制胞内促凋亡蛋白Bad的活化和内质网应激等促凋亡途径及激活心肌细胞内自噬相关通路进而减少心肌细胞死亡〔12,13〕。然而,缺血心肌再灌注后,AMPK的磷酸化程度较缺血时显著降低,导致AMPK在心肌再灌注时无法继续发挥保护作用〔2〕。本实验提示AMPK在IR后未发挥作用。在心肌遭受IR时,地氟烷预处理通过提高心肌组织内AMPK活性,进而可能通过调节能量代谢和抑制凋亡通路有效减少了心肌损伤。
然而,地氟烷预处理激活AMPK的机制尚不清楚。同时,采用离体心脏IR损伤模型进行实验缺乏药物、心脏和其他系统之间的相互影响。因此,需要在在体动物上进一步证实。地氟烷预处理使IR后心肌组织内AMPK(Thr-172)磷酸化水平升高而被激活,是其缓解心肌IR损伤的机制之一。
1 Srivastava RA,Pinkosky SL,Filippov S,etal.AMP-activated protein kinase:an emerging drug target to regulate imbalances in lipid and carbohydrate metabolism to treat cardio-metabolic diseases〔J〕.J Lipid Res,2012;53(12):2490-514.
2 Wang J,Yang L,Rezaie AR,etal.Activated protein C protects against myocardial ischemic/reperfusion injury through AMP-activated protein kinase signaling〔J〕.J Thromb Haemost,2011;9(7):1308-17.
3 Russel RR,Li J,Coven DL,etal.AMP-activated protein kinase mediates ischemic glucose uptake and prevents postischemic cardiac dysfunction,apoptosis,and injury〔J〕.J Clin Invest,2004;114(4):495-503.
4 Yuan MJ,Wang T,Kong B,etal.GHSR-1a is a novel pro-angiogenic and anti-remodeling target in rats after myocardial infarction〔J〕.Eur J Pharmacol,2016;788:218-25.
5 Chang X,Zhang K,Zhou R,etal.Cardioprotective effects of salidroside on myocardial ischemia-reperfusion injury in coronary artery occlusion-induced rats and Langendorff-perfused rat hearts〔J〕.Int J Cardiol,2016;215:532-44.
6 Lange M,Redel A,Lotz C,etal.Desflurane-induced postconditioning is mediated by beta-adrenergic signalling:role of beta 1-and beta 2-adrenergic receptors,protein kinase A,and calcium/calmodulin-dependent protein kinase Ⅱ〔J〕.Anesthesiology,2009;110(3):516-28.
7 Kambara T,Ohashi K,Shibata R,etal.CTRP9 protein protects against myocardial injury following ischemia-reperfusion through AMP-activated protein kinase (AMPK)-dependent mechanism〔J〕.J Biol Chem,2012;287(23):18965-73.
8 Smul TM,Lange M,Redel A,etal.Desflurane-induced preconditioning against myocardial infarction is mediated by nitric oxide〔J〕.Anesthesiology,2006;105(4):719-25.
9 Lamberts RR,Onderwater G,Hamdani N,etal.Reactive oxygen species-induced stimulation of 5'AMP-activated protein kinase mediates sevoflurane-induced cardioprotection〔J〕.Circulation,2009;120(11 Suppl):S10-5.
10 Lemoine S,Tritapepe L,Hanouz JL,etal.The mechanisms of cardio-protective effects of desflurane and sevoflurane at the time of reperfusion:anaesthetic post-conditioning potentially translatable to humans〔J〕?Br J Anaesth,2016;116(4):456-75.
11 Stumpner J,Smul TM,Redel A,etal.Desflurane-induced and ischaemic postconditioning against myocardial infarction are mediated by Pim-1 kinase〔J〕.Acta Anaesthesiol Scand,2012;56(7):904-13.
12 Yeh CH,Chen TP,Wang YC,etal.AMP-activated protein kinase activation during cardioplegia-induced hypoxia/reoxygenation injury attenuates cardiomyocytic apoptosis via reduction of endoplasmic reticulum stress〔J〕.Mediators Inflamm,2010;2010:130636.
13 Mo Y,Tang L,Ma Y,etal.pramipexole pretreatment attenuates myocardial ischemia/reperfusion injury through upregulation of autophagy〔J〕.Biochem Biophys Res Commun,2016;473(4):1119-24.
〔2016-03-27修回〕
(编辑 杜 娟)
Involvement of adenosine monophosphate-activated protein kinase in desflurane preconditioning-induced protection against myocardial ischemia/reperfusion injury in isolated rat hearts
LIANG Ning,LIU Ling,CHEN Ping.
Department of Anesthesiology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
Objective To investigate the role of AMPK in desflurane preconditioning-induced myocardial ischemia/reperfusion injury attenuation in isolated rat hearts. Methods Healthy male SD rats,aged 2~3 months old,weighed 250~280 g were heparinized(2 U/g) and anesthetized. The hearts were excised and randomly divided into 5 groups(n=10):control (C) group,ischemia/reperfusion (IR) group,desflurane preconditioning + IR (DR)group,desflurane preconditioning + IR +AMPK inhibitor(Compound C) (DC) group and IR+ Compound C group(CR). The hearts were perfused in a langendorff apparatus with oxygenated(95% O2+5% CO2) K-H solution at 37℃. After 15 min of stabilization,the IR model was established with 30 min of no flow followed by 60 min of reflow. desflurane preconditioning was carried out when the rats were inhaled with 1 MAC desflurane for 30 min before the excision of the heart. Heart rate(HR),left ventricular developing pressure(LVDP),+dp/dt and -dp/dt were recorded before perfusion suspension and 60 min after reperfusion. The activity of caspase-3 in myocardial tissue was determined with a commercial caspase-3 activity assay kit,and the level of cTnI in coronary outflow was detected with ELISA assay. The phosphated level of AMPK(Thr-172) was determined with immunohistochemistry and Western blot. Results Compared with group C,HR,LVDP,+dp/dt and -dp/dt were substantially depressed and caspase-3 activity,cTnI level were markedly increased at 60 min after reperfusion in IR group. Compared with group IR,HR,LVDP,+dp/dt and -dp/dt were significantly improved and caspase-3 activity,cTnI level were decreased in group DR,accompanied by significant elevation of the phosphate level of AMPK(Thr-172). Co-adminstration of Compound C(10 μmol/L) in DC group significantly suppressed the improvement of HR,LVDP,+dp/dt and -dp/dt,elevated caspase-3 activity and cTnI level,as well as suppressed the elevation of phosphate level of AMPK(Thr-172). Conclusions Desflurane preconditioning effectively elevates the phosphate level of AMPK(Thr-172) and activates it,which is one of the mechanisms underlying desflurane preconditioning-induced cardioprotection.
Desflurane;Adenosine monophosphate-activated protein kinase;Myocardial ischemia/reperfusion injury
陈 萍(1961-),女,硕士,教授,主任医师,主要从事围术期脑和心肌保护研究。
梁 宁(1984-),男,硕士,住院医师,主要从事围术期脑和心肌保护研究。
R541
A
1005-9202(2017)04-0791-04;
10.3969/j.issn.1005-9202.2017.04.005

