二甲双胍对正常饮食大鼠血清成纤维细胞生长因子19、21及胰腺成纤维细胞生长因子受体1的影响
王 燕 孙 佩 夏 金 逄曙光,
(山东大学医学院,山东 济南 250013)
二甲双胍对正常饮食大鼠血清成纤维细胞生长因子19、21及胰腺成纤维细胞生长因子受体1的影响
王 燕1孙 佩1夏 金2逄曙光1,2
(山东大学医学院,山东 济南 250013)
目的 探讨二甲双胍(METF)对血清成纤维细胞生长因子(FGF)19和FGF21及胰腺成纤维细胞生长因子受体(FGFR)1和Akt通路上分子的影响。方法 给予8周龄健康雄性Wistar大鼠(40只)标准饮食,随机分为正常对照(Con)组和METF(500 mg·kg-1·d-1)。在24 w末检测血清生化学指标及FGF19和FGF21水平。蛋白免疫印迹检测胰腺组织FGFR1,Akt、磷酸化的Akt(p-Akt),FoxO1、磷酸化的FoxO1(p-FoxO1)的表达水平。结果 METF干预可以减轻大鼠的体重,降低大鼠空腹血糖、低密度脂蛋白和胆汁酸水平。METF组大鼠血清FGF21较Con组明显升高(P<0.05),而FGF19较Con组明显减低(P<0.05)。此外,胰腺FGFR1的表达水平及 Akt及FoxO1的磷酸化水平在METF干预后明显升高(均P<0.05)。结论 METF可以降低血清FGF19、升高血清FGF21水平,对两者产生相反的作用。此外,METF可能通过增加FGFR1的表达、Akt及FoxO1的磷酸化对胰腺功能产生影响。
二甲双胍;成纤维细胞生长因子19;成纤维细胞生长因子21;成纤维细胞生长因子受体1
二甲双胍(METF)主要通过活化腺苷酸活化的蛋白激酶(AMPK),增加外周组织血糖摄取、脂肪组织脂肪酸氧化及抑制肝糖原输出从而降低血糖〔1〕。METF能够降低2型糖尿病患者的血糖,血糖正常的人使用也不会引起低血糖,这一优势使得METF在保护心血管、抗肿瘤、减肥、延长寿命等方面发挥重要作用。最新研究表明成纤维细胞生长因子(FGF)19和FGF21在糖脂代谢方面也发挥着重要作用〔2〕。FGF19与FGF21,FGF23同属于β-Klotho家族,结合成纤维细胞生长因子受体(FGFRs)时需要β-Klotho共受体的参与〔3〕。与其他FGFs不同,FGF19、FGF21产生后可以进入循环系统,通过与不同的受体结合可以活化C-Jun、Erk、Akt等通路,发挥调控糖脂代谢的作用〔4〕。FGFR1广泛表达于脂肪组织和胰腺组织,在胰腺组织特异性表达于胰腺β细胞。胰腺FGFR1的表达失活可以导致糖尿病的发生,而特异性活化FGFR1及其介导的通路可以改善2型糖尿病的糖脂代谢〔5〕。研究证实胰十二指肠同源盒(Ipf/Pdx1)作为FGFR1的上游基因产物,在胰腺发育、胰岛β细胞分化及胰岛素分泌方面发挥着重要作用〔6〕。METF或AMPK激动剂AICAR可以增加胎鼠胰腺祖细胞的Ipf/Pdx1,使得出生后的胎鼠拥有更高的胰腺β细胞比例〔7〕。
叉头转录因子(FoxO1)属于FoxO家族,是一种主要参与细胞凋亡、应激、DNA损伤修复、肿瘤发生和糖代谢的转录因子,是胰岛素信号通路(PI3K-AKT)上的重要转录因子。通常,胰岛素结合胰岛素受体后激活PI3K继而使AKT磷酸化(p-AKT),之后使FoxO1磷酸化(p-FoxO1),磷酸化后的FoxO1可以从细胞核上解离,其细胞内定位从细胞核上转移到细胞质中,从而失去对下游基因的调节。FoxO1在调节肝糖原输出〔8〕、胰岛素合成〔9〕、脂肪细胞分化〔10〕等方面发挥着重要作用。本研究旨在探讨METF干预对血清FGF19、FGF21、胰腺FGFR1的影响及其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 从北京维通利华公司购买8周龄雄性Wistar大鼠(220~250 g,n=40)。清洁级饲养,室温20℃~25℃,相对湿度55%~70%,12 h光照维持,昼夜循环。普通标准饲料(北京华阜康公司)含碳水化合物64%,脂肪6%,蛋白质23%。自由摄水、饮食,保持垫料干燥,每日定时更换,适应性喂养1 w后进入实验。
1.1.2 主要试剂 盐酸二甲双胍(格华止)(中美上海施贵宝制药有限公司);FGF19抗体(70R-50760)购自美国Fitzgerald公司;FGFR1(#9740S)、Akt(#9272)、phospho-Akt (ser473,#4060)、FoxO1(#2880)、phospho-FoxO1(ser256,#9461)抗体购自美国The Cell Signaling Technology(CST)公司;抗β肌动蛋白(β-actin)抗体、辣根过氧化物酶标记山羊抗兔或者抗鼠二抗,购自中杉金桥公司。大鼠FGF19和FGF21 ELISA试剂盒购自上海江莱生物科技有限公司。大鼠胰岛素ELISA试剂盒(Art.No.10-1250-01z)购自瑞典Mercodia 公司。
1.2 方法
1.2.1 分组及给药方法 雄性Wistar大鼠适应性喂养1 w后,按体重随机分为正常对照(Con)组和METF组。METF组大鼠给予格华止(500 mg/kg/d),连续灌胃24 w;Con组大鼠给予等量生理盐水。两组均给予标准饮食。药物干预前(第1周末)内眦静脉取血检测两组大鼠血清学指标。实验终点(第24周末)收集大鼠胰岛组织和血清。组织保存于液氮中,血清保存于-80℃。
1.2.2 口服糖耐量实验(OGTT) 治疗结束后,禁食16 h,行OGTT(0.2 g/kg),即分别在葡萄糖灌胃前(0 h),后(15,30,60,120 min)内眦静脉采血,4℃、3 000 r/min离心20 min,分离血清,分装后-80℃保存。
1.2.3 体重质量测定 每隔1 w相同时间测定大鼠体重。
1.2.4 血清学指标检测 内眦静脉取血,分离血清,检测空腹血糖(FPG)、总胆汁酸(TBAs)、血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。空腹胰岛素(FIN)、FGF19和FGF21水平采用ELISA法检测。
1.2.5 蛋白免疫印迹法测胰腺组织中Akt通路相关蛋白FGFR1、Akt、FoxO1的表达 喂养24 w后,处死大鼠取胰腺组织,加裂解液和蛋白酶抑制剂,冰上裂解组织,离心后取上清液,检测蛋白浓度。10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后,转移至聚偏氟乙烯(PVDF)膜,脱脂牛奶封闭1.5 h。TBST洗膜后,分别加入FGFR1、Akt、p-Akt、FoxO1、p-FoxO1一抗,4℃孵育过夜。二抗室温孵育1.5 h,化学增强发光法(ECL)试剂盒化学发光显影。β-actin作为内参。每个指标至少重复3~5次。
1.2.6 胰岛素抵抗水平评估 胰岛素抵抗指数(HOMA-IR)=(FPG×FIN)/22.5。
1.3 统计学分析 应用Graphpad软件行t检验。
2 结 果
2.1 两组大鼠体重、糖、脂、胆汁酸、胰岛素水平比较 第1周末,METF组大鼠体重及生化学指标与Con组比较无显著差异。实验期间,Con组大鼠体重持续增加,METF组大鼠体重增速较Con组减慢(图1)。第24周末,METF可以一定程度降低大鼠的FPG(P<0.05),但是METF组大鼠餐后0.5 h血糖与Con组比较没有统计学意义。此外,METF组大鼠的FIN水平较Con组减低(P<0.05)。根据胰岛素抵抗指数,METF干预可以增加胰岛素敏感性。第24周末,METF组大鼠LDL-C和HDL-C均较Con组降低;与Con组大鼠比较,METF组大鼠TBAs明显降低(P<0.05)。见表1。
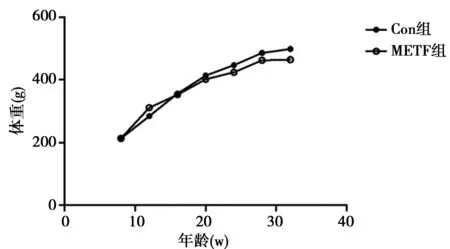
图1 两组大鼠体重比较

生化指标第1周末Con组METF组第24周末Con组METF组体重(g)250.97±10.93256.16±9.87498.15±22.20467.7±13.861)FPG(mmol/L)5.72±0.125.73±0.155.83±0.184.81±0.40FIN(ng/ml)1.48±0.251.49±0.431.56±0.861.21±0.161)TG(mmol/L)1.28±0.371.26±0.421.43±0.441.58±0.26TC(mmol/L)2.08±0.202.12±0.162.14±0.151.87±0.12HDL-C(mmol/L)0.93±0.320.94±0.280.95±0.300.38±0.051)LDL-C(mmol/L)0.52±0.070.49±0.060.55±0.060.37±0.051)TBAs(μmol/L)30.08±4.2632.16±3.8831.83±5.1718.26±2.481)
与Con组比较:1)P<0.05
2.2 两组大鼠血清FGF19、FGF21比较 第24周末,METF组大鼠血清FGF19水平〔(36.25±3.21)ng/ml〕较Con组〔(82.46±2.78)ng/ml〕显著降低(P<0.05)。与血清FGF19水平一致,METF组大鼠胰腺FGF19蛋白水平明显低于Con组(P<0.05,图2)。与对血清FGF19的影响相反,METF组大鼠血清FGF21水平〔(837.62±58.28)ng/ml〕较Con组〔(692.55±64.16)ng/ml〕明显升高(P<0.05)。
2.3 两组大鼠胰腺FGFR1,Akt/PKB和FoxO1水平比较 METF组大鼠胰腺组织FGFR1较Con组明显升高(P<0.05),胰腺p-Akt/Akt、p-FoxO1/FoxO1水平均较Con组明显升高(P<0.05)。见图2。
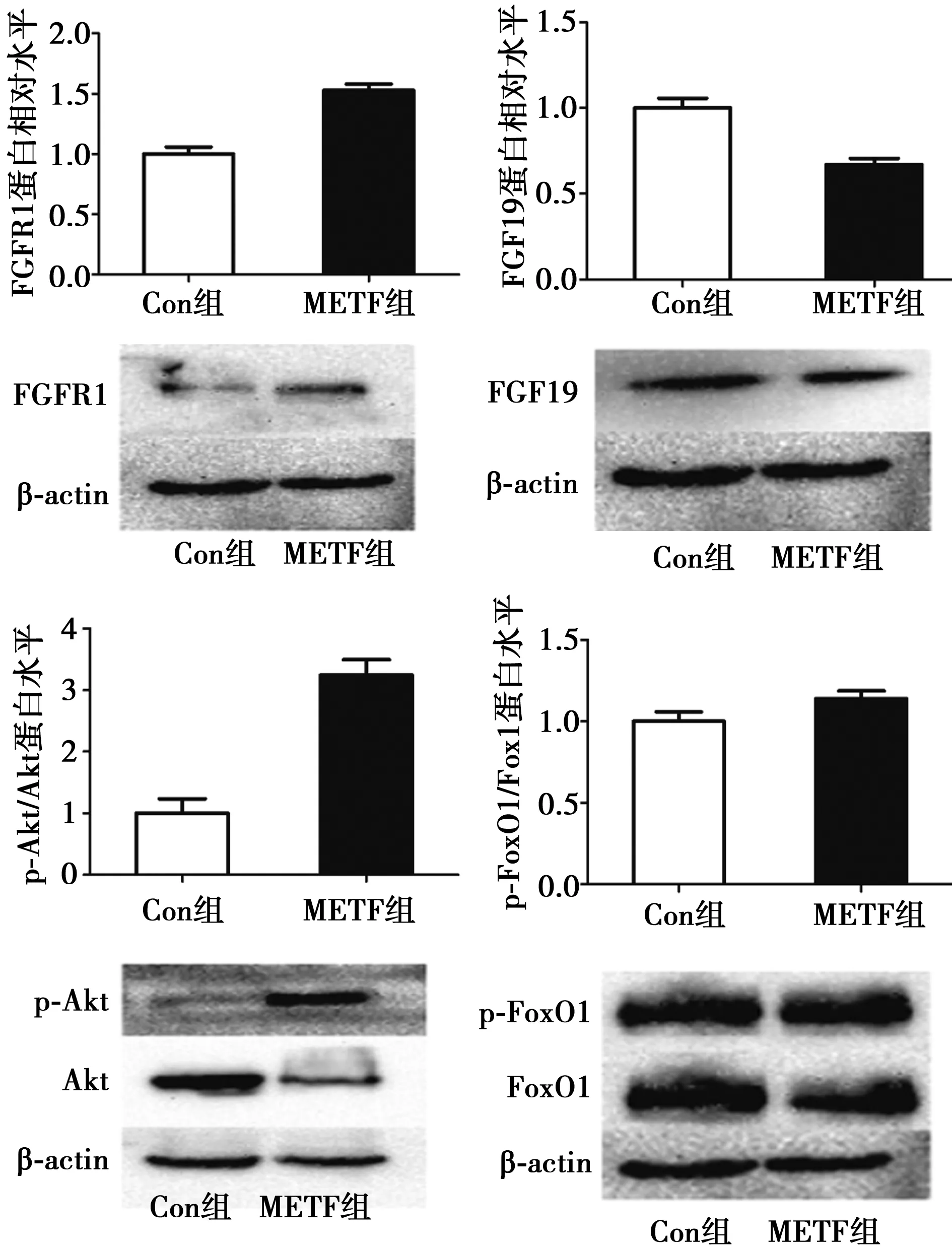
图2 两组大鼠胰腺FGFR1,Akt,FoxO1,FGF19蛋白水平比较
3 讨 论
METF最常用作2型糖尿病的治疗,因其可以改善胰岛素敏感性,抑制肝糖原输出的作用,在多囊卵巢综合征及肥胖症的治疗上也得到患者的认可。既往对METF作用靶点的研究主要集中在肝脏,对胰腺的研究较少。METF对血清FGF19的影响可能与血清胆汁酸的改变有关。已证实进食后食物刺激胆汁酸分泌,并在回肠中结合并活化法尼醇X受体(FXR)生成FGF19〔11〕。然而,METF活化的AMPK可以与FXR产生交互作用并抑制其下游基因FGF19的表达〔12〕。METF激活的AMPK与FXR的交互作用可能在不同组织中存在不同的调节方式。FGF21主要在肝脏中产生〔13〕,在脂肪组织和胰腺组织中也有表达。本研究发现METF可以提高血清FGF21水平。但是METF对FGF21影响的研究较少,且机制仍不清楚。Kim等〔14〕发现METF可以通过AMPK依赖的方式诱导肝脏FGF21的表达。然而,Cyphert等〔15〕认为 FXR激活后和RXR结合形成FXR/RXR复合体,结合在FGF21基因的5′末端,使肝脏产生FGF21。此外,通过对FGFR1的研究,发现METF可以明显提高FGFR1的表达水平。这可能与Ipf/Pdx1作为FGFR1的上游基因有关。由于FGFR1在胰腺中特异性表达于β细胞,因此METF可能通过影响FGFR1的表达在β细胞生长发育过程中发挥重要作用。METF对FPG的影响可能与胰腺FoxO1的磷酸化有关。研究表明FoxO1能够增加胰岛β细胞数量,提高胰岛素敏感,提升β细胞抗氧化功能〔11〕。此外,在病理情况下,FoxO1在减少糖脂毒性诱导的β细胞凋亡中也发挥着重要作用。一方面可以减少脂肪酸诱导的内质网应激,另一方面在高的血糖浓度下仍能刺激胰岛素的分泌〔16〕。
然而,METF对Akt和FoxO1磷酸化的影响是否与FGF21与FGFR1的结合及活化的通路有关,还需要进一步的研究。此外,METF在肥胖或2型糖尿病大鼠模型上的应用是否会对FGFs及FGFR产生影响也有待进一步研究。
1 Duca FA,Cote CD,Rasmussen BA,etal.Metformin activates a duodenal Ampk-dependent pathway to lower hepatic glucose production in rats〔J〕.Nat Med,2015;21(5):506-11.
2 付 坤,柳景华.成纤维细胞生长因子21在糖脂代谢中的研究进展〔J〕.中华老年心血管病杂志,2014;16(5):550-3.
3 Suzuki M,Uehara Y,Motomura-Matsuzaka K,etal.Betaklotho is required for fibroblast growth factor (FGF) 21 signaling through FGF receptor (FGFR) 1c and FGFR3c〔J〕.Mol Endocrinol,2008;22(4):1006-14.
4 Lin Z,Tian H,Lam KS,etal.Adiponectin mediates the metabolic effects of FGF21 on glucose homeostasis and insulin sensitivity in mice〔J〕.Cell Metab,2013;17(5):779-89.
5 Hart AW,Baeza N,Apelqvist A,etal.Attenuation of FGF signalling in mouse beta-cells leads to diabetes〔J〕.Nature,2000;408(6814):864-8.
6 Rutter GA,Pullen TJ,Hodson DJ,etal.Pancreatic beta-cell identity,glucose sensing and the control of insulin secretion〔J〕.Biochem J,2015;466(2):203-18.
7 Gregg B,Elghazi L,Alejandro EU,etal.Exposure of mouse embryonic pancreas to metformin enhances the number of pancreatic progenitors〔J〕.Diabetologia,2014;57(12):2566-75.
8 Titchenell PM,Chu Q,Monks BR,etal.Hepatic insulin signalling is dispensable for suppression of glucose output by insulin in vivo〔J〕.Nat Commun,2015;6:7078.
9 Zhang T,Kim DH,Xiao X,etal.FoxO1 plays an important role in regulating beta-cell compensation for insulin resistance in male mice〔J〕.Endocrinology,2016;157(3):1055-70.
10 Zou P,Liu L,Zheng L,etal.Targeting FoxO1 with AS1842856 suppresses adipogenesis〔J〕.Cell Cycle,2014;13:3759-67.
11 Rysz J,Gluba-Brzozka A,Mikhailidis DP,etal.Fibroblast growth factor 19-targeted therapies for the treatment of metabolic disease〔J〕.Exp Opin Invest Drugs,2015;24(5):603-10.
12 Lien F,Berthier A,Bouchaert E,etal.Metformin interferes with bile acid homeostasis through AMPK-FXR crosstalk〔J〕.J Clin Invest,2014;124(3):1037-51.
13 Nishimura T,Nakatake Y,Konishi M,etal.Identification of a novel FGF,FGF-21,preferentially expressed in the liver〔J〕.Biochim Biophys Acta,2000;1492(1):203-6.
14 Kim EK,Lee SH,Jhun JY,etal.Metformin prevents fatty liver and improves balance of white/brown adipose in an obesity mouse model by inducing FGF21〔J〕.Mediators Inflamm,2016;2016:5813030.
15 Cyphert HA,Ge X,Kohan AB,etal.Activation of the farnesoid X receptor induces hepatic expression and secretion of fibroblast growth factor 21〔J〕.J Biol Chem,2012;287(30):25123-38.
16 Shao S,Yang Y,Yuan G,etal.Signaling molecules involved in lipid-induced pancreatic beta-cell dysfunction〔J〕.DNA Cell Biol,2013;32(2):41-9.
〔2016-07-15修回〕
(编辑 袁左鸣)
Effects of metformin on FGF19 and FGF21 and pancreatic FGFR1 in normal diet male rats
WANG Yan,SUN Pei,XIA Jin,etal.
Shandong University School of Medicine,Jinan 250013,Shandong,China
Objective To examine metformin's effects on FGF19 and FGF21 serum levels as well as pancreatic FGFR1 protein levels.Methods 40 male Wistar rats were randomly assigned to control group (Con) and metfromin group (METF) with or without metformin treatment (500 mg·kg-1·d-1).Biochemical parameters and serum FGF19 and FGF21 levels were evaluated after 24 weeks intervention.Pancreatic tissues were collected to assess FGFR1,Akt and FoxO1 protein levels by Western blot.Results Metformin reduced body weight,fasting plasma glucose (FPG),low-density lipoprotein cholesterol (LDL-C) and total bile acids (TBAs) levels compared to those of Con group.Besides,serum FGF21 level was higher and FGF19 level was lower in METF rats. Moreover,protein levels of pancreatic FGFR1,phosphorylated Akt (p-Akt) and phosphorylated-FoxO1 (p-FoxO1) were significantly increased in METF rats.Conclusions Metformin might have an impact on beta cells by increasing protein levels of FGFR1,p-Akt and p-FoxO1.
Metformin;FGF19;FGF21;FGFR1
国家自然科学基金(81170771);山东省科技发展计划(2012GSF11803);山东省重点研发项目(2016GSF201019);济南市国际合作项目(201011008)
逄曙光(1966-),女,博士,教授,博士生导师,主要从事糖尿病和胆汁酸代谢的基础和临床研究。
王 燕(1989-),女,在读硕士,主要从事糖尿病和胆汁酸代谢的基础及临床研究。
R587.1
A
1005-9202(2017)04-0817-03;
10.3969/j.issn.1005-9202.2017.04.014
1 山东大学附属济南市中心医院内分泌科
2 泰山医学院

