ATP发光法在纺织品抗菌防霉性能测试中的应用
季学海, 谭玉静, 薛咏梅, 骆迎华, 黄志斌, 陈 璐, 韩莹莹
(上海市质量监督检验技术研究院,上海 200040)
研究与技术
ATP发光法在纺织品抗菌防霉性能测试中的应用
季学海, 谭玉静, 薛咏梅, 骆迎华, 黄志斌, 陈 璐, 韩莹莹
(上海市质量监督检验技术研究院,上海 200040)
近年来,纺织品抗菌测试手段得到了长足的发展,但是由于种种技术条件的限制,传统的纺织品抗菌测试方法仍暴露出了诸多弊端,因此,新的检测方法的探索势在必行。ATP发光法作为非传统的抗菌测试手段,相对于传统测试方法具有方便快捷、准确度高、时效性强等诸多优点,在其他工业领域已得到了广泛应用。文章阐述了ATP发光法的试验原理及其发展历程,探讨了此法应用于纺织品抗菌性能检测的优越性及发展方向,从而论证了ATP发光法用于纺织品抗菌性能测试的可行性,将ATP发光法应用于纺织品的抗菌防霉效果测试具有重要的研究价值和现实意义。
ATP发光法;纺织品;抗菌防霉;生物技术;性能测试
进入21世纪之后,随着人们对生活质量要求的不断提高,抗菌纺织品产业得到了迅速发展。抗菌纺织品市场容量的不断扩大及市场竞争的日益激烈,对准确、快速的检测手段提出了新的要求。目前,国内、国际上普遍采用的纺织品抗菌防霉性能测试方法大体分为定性判定和定量测定两大类,涵盖了细菌、真菌、螨虫等诸多微生物。但是在日常实际检测中,也逐渐凸显出了一些缺陷,尤其是在测试纺织品抗真菌性能时,实验结果存在对照样增长值过低[1-2]、不易计数、测试周期较长、检测准确度不高等问题,从而严重影响抗菌测试结果的客观评定,这对准确评价纺织品的抗菌防霉效果是极为不利的。因此,进一步完善传统测试方法、建立健全新的测试体系,对于抗菌纺织品市场的良性发展尤为重要。
ATP生物发光法技术于20世纪70年代兴起,在之后不足十年的时间里,ATP检测仪检测系统便被英国人首先研制成功,随后该项技术便在欧洲、美国、日本等工业发达国家得到普遍关注。1998年日本率先将ATP生物发光法技术纳入检测法,即《关于食品制造过程管理高度化临时措施法》,并于次年成立了ATP涂抹检查研究会,以专门研究该技术的适用领域及使用效率。中国于20世纪末将ATP检测技术引进国内,并要求相关研究机构对此技术进行深入研究。进入21世纪前十年,ATP生物发光法作为一种非传统的、快速的微生物检测技术已基本成熟。目前,ATP生物发光技术应用领域主要包括食品工业中微生物的检测[3]、医疗及卫生行业[4]、环境及安全领域[5]的检测,以及快速细胞计数、细胞增殖、细胞毒理和荧光素酶检测[6]等其他生物学检测。
与此同时,世界各国纺织科研工作者都对该项技术进行了积极研究,期望以此带动纺织品抗菌检验技术的飞跃,并已取得了一定成果。这不仅证实了将ATP发光法用于纺织领域的可行性,大体掌握了ATP发光法用于纺织品抗菌检测的一般流程,更是对该技术的优点与不足有了更深层次的认识。大量的研究成果表明,将ATP发光法应用于纺织品的抗菌防霉效果测试具有重要的研究价值,同时对客观评价纺织品的抗菌性,完善抗菌纺织品相关测试标准具有重要意义。
1 ATP发光法的试验原理
ATP(腺嘌呤核苷三磷酸),是由一分子核糖、一分子腺嘌呤和三个相连的磷酸基团有机结合而成的一种不稳定的高能化合物,其分子结构如图1所示。
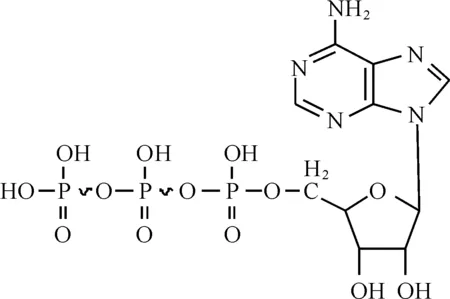
图1 ATP分子结构式Fig.1 The molecular structural formula of ATP
ATP在细胞核、线粒体、染色体等细胞器中大量存在,是细胞内部自由能量的有机载体。在适宜条件下,ATP、ADP和AMP可以相互转化,并伴随大量能量的释放与吸收。三者之间的相互转化如下式所示:
任何生物的生命活动都需要能量的供应,同时,处于一定生理时期的活体微生物,其体内的ATP数量基本恒定,而当微生物生命活动消失后,其体内细胞中的ATP会很快被相应的蛋白酶降解,不会对活体微生物的测定产生影响[7]。换言之,ATP作为生物体生命活动不可或缺的能量供应者,其密度能够反映出生物体的数量[8]。正是ATP的这一特点,使得利用ATP生物发光法来测试活体微生物的数量指标成为可能,即通过测定样品中的ATP浓度,便可推算出活菌数。
ATP的生物发光技术作为一项非传统的生物技术,最早是由McElroy和Strehler于1949年提出[9]。但是,由于当时的客观条件限制,直到20世纪70年代中期,该项技术才开始逐渐形成。1983年,英国生物学家Moyer等[10]最早提出细胞内源性ATP的含量与活细胞的数量即活性之间存在客观联系。同年瑞典学者Gronroos等[11]也通过多次试验论证,证实了ATP生物发光法是一种确定细胞活性度的可靠的、灵敏度高的检测方法。紧随其后,爱尔兰科学家McElroy[12]最先引入荧光素酶-ATP检测法。
简单地说,ATP荧光反应具体的反应过程可用以下方程式表示:
该技术主要包括以下环节:取得样品→萃取样品ATP→加入荧光素和荧光素酶混合物→测定发光量→计算ATP浓度→计算得到活菌数。通常情况下,该项技术需要注意以下两点:1)ATP在细胞内部,因此提取ATP前需要处理微生物的细胞壁和细胞膜;2)只有ATP与荧光素及生物发光试剂作用后,才可以用荧光仪测定生物发光量[13]。
2 ATP发光法在纺织品抗菌检测中的应用
2.1 传统纺织品抗菌性能测试方法的缺陷
近十年来,国内外研制生产了多种抗菌防霉纺织产品,涉及一次性使用卫生用品、公共用纺织品及个人用纺织品等诸多领域。如何准确评价这些纺织产品的抗菌性能,对抗菌防霉纺织品工业的良性发展至关重要。目前,国内外测试纺织品抗菌性能的标准有很多,如:中国纺织行业标准FZ/T 73023—2006《抗菌针织品》、FZ/T 62015—2009《抗菌毛巾》和国家标准GB/T 20944.1—2007《纺织品 抗菌性能的评价 第一部分:琼脂扩散法》;日本标准有JIS L1902:2002《纺织制品抗菌活性及效果测试》;美国标准有AATCC 100—2004《纺织品材料上耐细菌整理:评定》等。整体来看,这些方法虽然原理相似,但要求的试验条件却各有不同,这就使纺织品抗菌测试处于操作不统一,结果无对比性的尴尬地步。同时,纺织品的抗菌性能主要包括两方面内容,即纺织品的抗细菌性能与防霉性能。一直以来,由于真菌相对细菌而言存在生长周期过长(在适宜情况下,细菌培养18~24 h即可观察试验结果,而霉菌则需培养2~4周才能进行评价);不能进行准确的菌落计数,只能通过霉菌覆盖试样的面积进行定性判定;可操作性较差、技术难度大等特点,成为摆在广大纺织科研工作者面前的一大难题。因此,为了更加客观、准确地对纺织品抗菌性能进行评价,防霉检测手段需要突破各种技术壁垒或者采用更为先进的技术手段。
2.2 ATP发光法在纺织品抗菌检测中的应用
纺织品的抗菌性能检测归根结底还是对微生物进行检测,因此,在其他工业领域大放异彩的ATP发光法也同样进入纺检工作者的视线。事实上,在前人研究的基础上,无数试验结果表明,将ATP发光法运用到纺织品的抗菌检测潜力无限。
2003年前后,日本科学家把纤维制品的洗涤液加入到具有测定用缓冲液的试管内,依次加入ATP提取剂和发光试剂,然后用测定发光量的方法来测定纤维制品的抗菌性,试验结果表明,此法测得数据准确度较高,且方便快捷。同年,台湾《染化杂志》发表了题为《纤维制品的抗菌性试验方法与评估—ATP发光测定法》的专辑,较为详尽地阐释了ATP发光法应用于纺织品生物测试的可行性。
2007年,国际标准化组织ISO在博采众长的基础上,发布了ISO 20743—2003《纺织品-抗菌整理纺织品抗菌性能测定》,此标准中采用的细菌计数方法即为ATP生物发光法,并明确指出此法适用于经过各种形式抗菌整理后的纤维、纱线、服装、家庭装饰品等纺织品。同时,针对AATCC 30—2004《纺织品材料抗菌性能评定-抗霉烂》中琼脂平板法、湿度瓶法和土埋法三种测试方法测试周期长,不具有可比性,不适用于非溶出型抗菌产品的缺陷,ISO纺织品技术委员会(TC38)专案工作组抗微生物纺织品工作组(WG23)紧锣密鼓地研究制定新的相关标准,并于2012年8月制定出采用ATP发光法进行抗菌检测的国际标准ISO 13629—1:2012《纺织品的抗真菌活性测定 第1部分:荧光法》。
作为纺织工业大国,目前中国在纺织领域的所有国家和行业标准仍采用传统的琼脂培养计数法,在相当长的一段时间内,ATP发光法在纺织品中的应用研究未见诸报道。2013年,中国上海质检院的谭玉静、王志惠、林圣光等选用黑曲霉、产黄青霉和白色念珠菌为抗真菌测试菌种,针对振荡法测试中白色念珠菌对照样增长值过低的问题和平皿培养法测试中操作条件多变的问题,对两个测试方法体系分别进行了优化,建立了抗真菌检测的ATP发光法,并以防霉整理的纯棉织物为对象,比较了平皿培养法和ATP发光法两种测试方法,得出了ATP法比平皿培养法不仅快速而且灵敏的结论[14]。
与此同时,国内外研究表明,ATP发光法还可用于纺织品防螨性能的测试。Takao EBINA等[15]采用ATP发光法成功地将不同生活期的植物类产品中螨虫活度进行了再现,从而扩展了ATP发光法的检测范围与检测准确性,有望使该方法在抗螨纺织品的功效评价中得到广泛应用。
3 ATP发光法应用于纺织品抗菌检测的优越性及发展方向
3.1 ATP发光法应用于纺织品抗菌检测的优越性
随着功能性纺织品的快速发展,目前各国均制定了与之配套的国家标准。这些国家标准虽各有不同,但总的来说,均是从美国和日本最初的相关检测方法或国家标准中发展而来。美国现行AATCC 30—2010标准即是在AATCC 30—2004标准的基础上改进后,于2010年开始执行。中国的纺织品防霉性能评价方法主要分为平皿培养法和悬挂法两类,采用的菌种均为混合菌种,其原理就是在适宜的外界条件下,将待测样品在不含碳源的无机盐琼脂培养基[16]上培养一定时间后,观察菌落在培养基表面的生长情况,并据此对纺织品防霉性能进行等级评定。相对于这些传统的检测方法,将ATP发光法应用于纺织品的抗菌性能检测,主要具有以下优点:
1)时效性。目前不少传统的检测标准均能对纺织品抗霉菌性能进行测试,但均耗时较长。以GB/T 24346—2009《纺织品防霉性能的评价》为例,使用该方法进行测试时,试验中霉菌的培养大概需要2~4周,然后通过观察测量霉菌的生长面积来判定纺织品的抗菌性能。而使用ATP发光法进行测试时,菌种的培养时间只需(42±2)h,抗菌性能的判定通过ATP检测仪进行,5 s内便可得到结果。
2)定性测试与定量测试的差别。传统的纺织品防霉性能检测只能通过试样上霉菌生长的面积来做基本的定性评价,无法给出准确数值;而用ATP发光法测试时,培养基上的霉菌浓度可以通过ATP检测仪给出准确数字,经过简单计算便可得到抑菌率。
3)自动化程度和可操作性。传统检测方法操作复杂,步骤繁琐,自动化程度低,而ATP发光法相对而言操作简便、快速,可以自动化操作。
4)ATP发光法在重现性及测定范围等方面也具有独特优势。
3.2 ATP发光法应用于纺织品抗菌检测的发展方向
将ATP发光法应用于纺织品抗菌性能检测具有检测速度快、测定范围较广、可进行自动化操作、简便快捷等诸多优势,应用前景十分广阔。但是,在现实使用过程中,纺检工作者也逐渐发现现行ATP发光法不完善的一面。首先,ATP发光法要求样品中活菌浓度最少不低于1 000个/mL,但这种灵敏度是达不到某些卫生要求的;其次,ATP检测仪的灵敏度很高,这也造成此法易受游离ATP和体细胞的干扰,测试环境中的无关游离ATP会导致试验测定值偏高;再者,ATP发光法是以局部能量高低来对活菌浓度进行表达,换言之,此法不能确定微生物的种类,且易受外界环境(如养分、pH值、盐)影响,而且ATP提取实验所需的试剂较为昂贵,试成本较大。因此,该方法还有待进一步改进[17]。
鉴于现行ATP生物发光法存在的现实问题,当前对ATP发光法的改进主要围绕以下几方面进行:
1)采用合适的技术手段,对细菌、真菌等微生物进行分级分离工作,以确定菌的种类。这是由于微生物细胞中ATP的含量与菌的种类、大小及细胞生长所处的周期有关。例如,不同的菌种都有其特定的DNA序列,可以尝试将生物发光法与DNA分子识别技术结合起来,如此一来,不仅可以检测出菌落总数,还可以鉴定菌的种属。
2)进一步优化发光体系中荧光素、荧光素酶、缓冲液、样品提取液等“量”的分配。可以尝试用SAS软件进行试验优化设计,以期得到优化后的试验条件。
3)对影响ATP发光反应的各个因素进行深入研究,以期降低甚至消除副反应。
4)对发光反应中使用的荧光素、荧光素酶种类进行优化,在保证不影响测试结果的前提下,降低测试成本。
5)进一步提高发光检测仪的智能化,尽可能地避免因仪器误判造成的试验误差,保证试验的重复性[18]。
4 结 语
ATP发光法作为非传统的抗菌测试手段,相对于传统测试方法具有方便快捷、时效性等诸多优点,因此受到人们的普遍关注,并已逐渐在纺织品抗菌性能检测中得到广泛使用。继续深入研究ATP发光法面临的难题,并运用高科技手段不断改进优化,具有十分重要的现实意义。
[1]郭丽,王建坤.纺织品抗菌性能测试方法及比较[J].河北纺织,2010(3):9-16. GUO Li, WANG Jiankun. Comparing the methods for textile antibacterial activith evaluation[J]. Hebei Textiles,2010(3):9-16.
[2]赵婷,林云周.纺织品抗菌性能评价方法比较[J].纺织科技进展,2010(1):73-76. ZHAO Ting, LIN Yunzhou. Comparing the methods for textile antibacterial activity evaluation[J]. Progress in Textile Science & Technology,2010(1):73-76.
[3]侯玉柱,田雨,柯润辉,等.ATP生物发光法在饮料微生物检验中的应用分析[J].饮料工业,2013,16(11):41-47. HOU Yuzhu, TIAN Yu, KE Runhui, et al. Application of ATP bioluminescence in microbial detection of beverages[J]. Beverage Industry,2013,16(11):41-47.
[4]CREE I A, KURBACHER C M. ATP-based tumor chemo sensitivity testing: assisting new agent development[J]. Anti-cancer Drugs,1999,10(5):431-435.
[5]曹利蓉,张伟,晁蕊.ATP生物发光法在站车食品器具卫生学检验中的应用[J].铁道劳动安全卫生与环保,2004,31(2):86-87. CAO Lirong, ZHANG Wei, CAO Rui. Application of ATP bioluminescence in inspection of train food[J]. Railway Occupational Safety Health & Environmental Protection,2004,31(2):86-87.
[6]张博,康怀兴,米志强,等.基于裂解酶与ATP生物发光法特异定量检测炭疽杆菌方法的研究[J].生物技术通讯,2014,25(1):9-12. ZHANG Bo, KANG Huaixing, MI Zhiqiang, et al. Quantitative specific detection of bacillus anthracis based on bacteriophage lysine and luminescence techniques[J]. Letters in Biotechnology,2014,25(1):9-12.
[7]李春艳,霍贵成,王德国,等.ATP生物发光法快速测定生乳中微生物总数的研究[J].东北农业大学学报,2008,39(7):23-24. LI Chunyan, HUO Guicheng, WANG Deguo, et al. Research on rapid detecting microbial count in raw milk with ATP bioluminescence[J]. Journal of Northeast Agricultural University,2008,39(7):23-24.
[8]陈颖,邹秉杰,朱术会,等.利用ATP扩增反应与生物发光法结合检测微量微生物[J].微生物学报,2009(6):16-19. CHEN Yin, ZOU Binjie, ZHU Shuhui, et al. Detection of low-level microorganism by concomitant use of ATP amplification and bioluminescence assay[J]. Acta Microbiologica Sinica,2009(6):16-19.
[9]李丽霞,常超,伍金娥.ATP生物发光法检测拭子的研究进展[J].粮食科技与经济,2010,35(5):10-11. LI Lixia, CHANG Chao, WU Jin’e. The research progress of ATP bioluminescence in swab detection[J]. Grain Science and Technology and Economy,2010,35(5):10-11.
[10]JAMES D M, HENDRSON J F. Nucleoside triphosphate specificity of firefly luciferase[J]. Analytical Biochemistry,1983,131(1):187-189. [11]GRONROOS M, MAENPAA J, NIEMINEN A L, et al. 548 Correlation of steroid receptor contents with medroxyprogesterone and tamoxifen effects in endometrial cancer assayed by barin vitro ATP-bioluminescence method[J]. Journal of Steroid Biochemistry,1983,19(1):194.
[12]王凌.ATP再生系统结合生物发光法检测微量微生物含量的研究[D].武汉:武汉轻工大学,2013:3-15. WANG Lin. Research on the Contents of Trace Microbial Using Regeneration System Combined with ATP Bioluminescent Method[D]. Wuhan: Wuhan Polytechnic University,2013:3-15.
[13]NYREN P. Apyrase immobilized on paramagnetic heads used to improve detection limits in bioluminometric ATP monitoring[J]. Journal of Bioluminescence and Chemiluminescence,1994,9:29-34.
[14]王志惠.纺织品抗真菌性能评价方法的研究与改进[D].上海:东华大学,2015:4-7. WANG Zhihui. Research and Improvement of Evaluation Methods on Anti-Fungal Activity of Textile[D]. Shanghai: Donghua University,2015:4-7.
[15]EBINA T, OHTO K. ATP assay for determining the viability of the two-spotted spider mite and the European red mite during diapauses[J]. Applied Entomology and Zoology,2007,42(2):291-296.
[16]FZ/T60030-2009家用纺织品防霉性能测试方法[S].2009. FZ/T 60030-2009 Home textiles mouldproof performance test methods[S].2009.
[17]尹子波,侯玉柱,尹建军,等.ATP生物发光技术在微生物检测中的应用[J].食品研究与开发,2012,33(2):228-231. YING Zibo, HOU Yuzhu, YIN Jianjun, et al. Study and application of adenosine triphosphate(ATP)bioluminescence in microbes determination[J]. Food Research and Development,2012,33(2):228-231.
[18]唐倩倩,叶尊忠,王剑平,等.ATP生物发光法在微生物检验中的应用[J].食品科学,2008,29(6):460-465. TANG Qianqian, YE Zunzhong,WANG Jianpin, et al. Application of ATP bioluminescence in microbial detection[J]. Food Science,2008,29(6):460-465.
Discussion on application of ATP luminescence method in antibacterial and anti-mold property testing of textiles
JI Xuehai, TAN Yujing, XUE Yongmei, LUO Yinghua, HUANG Zhibin, CHEN Lu, HAN Yingying
(Shanghai Institute of Quality Inspection and Technical Research, Shanghai 200040, China)
Antibacterial testing methods of textiles have developed greatly in recent years. However, due to the limitations of various technical conditions, the traditional antibacterial testing methods of textiles have also revealed many disadvantages. Thus, it is imperative to explore a new testing method. As a non-traditional antibacterial testing method, ATP method has many advantages, such as convenience, high accuracy and timeliness. It has been widely used in many industrial fields. This article expounds the principle of ATP luminescence and its development course, discusses the superiority and development direction when it is applied in textile antibacterial test. In addition, this article demonstrates the feasibility of ATP luminescence application in textile antibacterial test and gets the conclusion that it has an important research value and practical significance when ATP luminescence method is applied to test the antibacterial and anti-mold property.
ATP luminescence method; textiles; antibacterial and anti-mold; biotechnology; property testing
10.3969/j.issn.1001-7003.2017.03.005
2016-07-31;
2016-12-30

TS101.4
A
1001-7003(2017)03-0028-05 引用页码: 031105

