miR-26b的表达及其与Foxf2相互作用在乳腺癌细胞生物学行为中的作用
王雷,陈传波,马明德
(河南大学附属淮河医院 乳腺外科,河南 开封 475001)
乳腺癌是女性常见的恶性肿瘤,其发病率居于女性恶性肿瘤首位,具有较高的复发率和病死率[1]。因此,寻找能够抑制乳腺癌细胞侵袭迁移的的分子靶点对改善患者预后、延长生存期具有重要意义。微小RNA(miRNA)是一种由17~25个氨基酸组成的短片段非编码RNA,其能够通过与靶基因的mRNA结合,调控基因转录翻译,进而参与细胞增殖、分化等生物学进程,在恶性肿瘤的疾病进展中发挥重要作用。近年来有研究发现miR-26b在肝癌、胃癌、乳腺癌等多种恶性肿瘤中均出现表达异常,研究表明其乳腺癌细胞中呈低表达,但其具体分子机制尚不明确[2-4]。生物信息学分析预测miR-26b是Foxf2的一种miRNA调节因子,以往有研究[5-6]显示叉头框转录因子Foxf2的表达水平升高与乳腺癌、宫颈癌的迁移侵袭具有密切相关性。因此,本研究通过转染技术使miR-26b在人乳腺癌细胞MCF-7过表达,旨在探讨miR-26b对细胞迁移、侵袭及Foxf2表达的影响。
1 材料与方法
1.1 实验材料及设备
1.1.1 细胞系 人乳腺癌细胞系MCF-7细胞株、人乳腺上皮细胞MCF-10A,购自于中国科学院细胞典藏库。
1.1.2 主要试剂 胎牛血清、RPMI 1640培养基,购自美国Gibco公司;miR-26b minic,购自美国Applied biosystems公司;脂质体Lipofectamine 2000、TRIZOL®Reagent Cat购自美国 Invitrogen公司;MTT,购自美国Sigma公司;引物,由上海生工生物工程有限公司合成;miScript Reverse Transcription Kit逆转录试剂盒、SYBR Premix EX Taq荧光定量试剂盒,购自日本Takara公司;Dual-Glo®双萤光素酶报告基因检测系统购自美国Promega公司;PVDF膜购自美国Millipore公司;RIPA蛋白裂解液、BCA 蛋白浓度测定试剂盒,购自北京康为世纪生物技术有限公司;鼠抗人Foxf2抗体、β-actin抗体,购自美国Abcam公司;兔抗鼠免疫球蛋白G(IgG)二抗,购自北京博奥森生物技术有限公司;ECL显色剂,购自上海西唐生物科技有限公司。
1.1.3 主要仪器 CO2培养箱,购自美国Thermo公司;细胞培养瓶、培养板,购自于美国Corning公司;倒置显微镜及数码采集系统,购自日本Olympus公司;Mastercycler PCR仪、全波长酶标仪,购自德国Eppendorf公司;荧光定量PCR仪,购自美国ABI公司;流式细胞仪,购自于美国BD公司;离心机购自美国Beckman公司;电泳仪、转膜仪,购自北京六一仪器公司;全自动凝胶成像系统购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 细胞培养和转染 将MCF-7、MCF-10A细胞接种于含10%胎牛血清的RPMI 1640培养基中,其中含100 U/mL青霉素和100 mg/mL链霉素,于37 ℃、5% CO2饱和湿度培养箱中进行培养,根据生长情况进行换液或传代,经3次稳定传代后,可取对数期细胞进行实验。根据实验设计将MCF-7细胞分为空白对照组、阴性对照组和miR-26b组,其中空白对照组细胞不做任何处理,阴性对照组按照说明书要求转染空质粒,miR-26b组转染miR-26b 模拟物;转染完成后通过qRT-PCR法检测miR-26b mRNA及蛋白表达情况评估转染效果。
1.2.2 MTT检测细胞增殖 将转染24 h后的MCF-7细胞以7 000个/孔的密度接种于96孔培养板中,置于37 ℃、5% CO2饱和湿度培养箱中培养,分别于24、48、72、96 h向每孔中加5 mg/mL的MTT 20 μL,继续培养4 h,吸弃培养基加入150 μL DMSO,水平震荡10 min后于酶标仪490 nm波长下进行吸光值测定,每孔设3个重复。
1.2.3 细胞划痕实验 将转染24 h后的MCF-7细胞接种于6孔板中进行培养,待细胞融合度在90%以上时,吸弃培养基采用磷酸盐缓冲液PBS洗涤3次,使用200 μL枪头在孔中央对细胞作水平划线,划线完成后采用PBS吸取脱落细胞,加入2 mL含10%胎牛血清的RPMI 1640培养基进行培养,于划线后0、48 h采用倒置显微镜观察细胞迁移情况,并进行拍照记录,通过测定划痕宽度变化评估miR-26b对MCF-7细胞迁移的影响。
1.2.4 Transwell迁移实验 将Transwell小室置于24孔培养板中,先在Transwell小室的膜上室加入100 μL含有1×1640培养基稀释基质胶进行包被,再将转染48 h后的MCF-7细胞悬浮于无血清培养基中,以每孔250 μL接种于Transwell小室的膜上室,在培养孔中加入500 μL含10%血清的RPMI 1640培养基,置于培养箱中进行培养,24 h后吸弃上室培养基,采用无菌棉签擦拭上室,对下室细胞采用4%多聚甲醛进行固定,0.1%结晶紫染色,显微镜下对下室细胞数量进行计数。
1.2.5 qRT-PCR 采用TRIzol法提取细胞总RNA, 采 用miScript Reverse Transcription Kit将RNA逆转录为cDNA,采用qRT-PCR法检测MCF-7、MCF-10A细胞中miR-26b mRNA表达量及转染miR-26b模拟物后的MCF-7细胞中miR-26b和Foxf2 mRNA表达量。采用ABI公司7500荧光定量测定仪进行测定,反应程序95 ℃ 10 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s 扩增 40 个循环,72 ℃ 10 min,共40个循环;反应体系为:2SYBR Premix 12.5 μL, 上 下 游 引 物 各 1.0 μL(10 mmol/L),cDNA 样本 2 μL,ddH2O 8.5 μL。最终结果以β-actin作为内参,采用2−ΔΔCt法计算miR-26b、Foxf2 mRNA相对表达量,每组重复3次。引物序列见表1。

表1 基因的引物序列Table 1 The primer sequences
1.2.6 Western blot 采用RIPA法裂解细胞提取总蛋白,采用BCA蛋白浓度检测试剂盒检测蛋白浓度,并调整抑制后,上样20 μL通过10%十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离蛋白,将蛋白电转至PVDF膜上,采用5%的脱脂乳进行室温封闭1 h,吸弃封闭液,加入预先按照说明书推荐比例稀释后的一抗,置于4 ℃孵育过夜,采用TBST洗涤膜3次,每次5 min,加入IgG二抗,室温孵育2 h,TBST洗涤膜3次,每次5 min,加入ECL显色剂进行显色,采用全自动凝胶成像仪采集图片,并使用Quantity One软件进行条带灰度值分析,本研究结果以目的蛋白Foxf2与内参蛋白β-actin条带的比值表示目的蛋白的相对表达量。
1.2.7 双荧光素酶报告实验 通过TargetScan软件预测miR-26b的可能靶基因,并分析其相互作用的序列位点,扩增Foxf2基因的3'-UTR,其中包含miR-26b的结合序列,同时通过重叠PCR法构建Foxf2基因3'-UTR中miR-26b结合区域的突变位点,构建表达海肾荧光素酶的载体,构建完成后与miR-26b模拟物或空质粒和荧光素酶报告载体共转染MCF-7细胞,主要分为Foxf2 3'-UTR与miR-26b或空质粒共转染、突变体与miR-26b或空质粒转染4组,转染48 h后,收集细胞,采用双萤光素酶报告基因检测试剂盒检测各组荧光素酶活性,以萤火虫荧光素酶与海肾荧光素酶的比值代表各组报告基因的转录活性。
1.3 统计学处理
采用SPSS 19.0对实验数据进行统计分析,计量资料采用均数±标准差(±s)表示,多组间比较采用One-Way ANOVA分析,两两比较方差齐次用LSD法,方差非齐次用Dunnett's T3法,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-26b在乳腺癌细胞中的表达情况
miR-26b在乳腺癌细胞系MCF-7中的相对表达量为0.47±0.03,在乳腺上皮细胞系MCF-10A中的相对表达量为0.95±0.05,miR-26b在乳腺癌细胞中的表达水平明显低于正常乳腺上皮细胞(P<0.05)。
2.2 miR-26b模拟物转染效果评价
与空白对照组和阴性对照组比,miR-26b组miR-26b相对表达量明显升高,差异有统计学意义(P<0.05)(图1)。
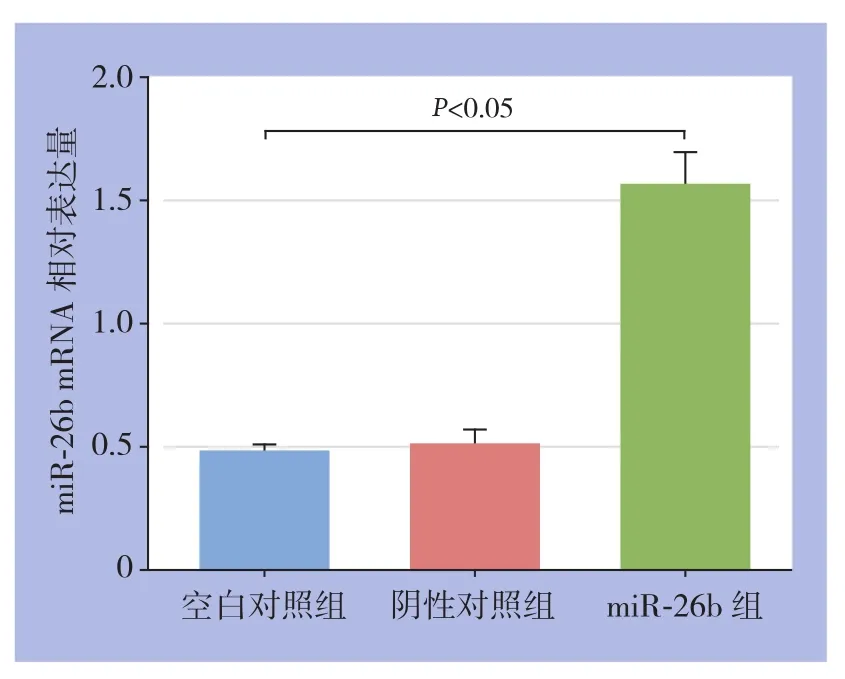
图1 各组细胞miR-26b的表达水平比较Figure 1 Comparison of the miR-26b expression levels among groups of cells
2.3 miR-26b对MCF-7细胞增殖的影响
转染miR-26b模拟物后,MCF-7细胞的增殖率随着时间延长逐渐降低,且在48、72、96 h活力均明显低于空白对照组和阴性对照组,差异有统计学意义(均P<0.05)(图2)。

图2 各组细胞增殖情况比较Figure 2 Comparison of the proliferation abilities among groups of cells
2.4 miR-26b对MCF-7细胞迁移的影响
与空白对照组比较和阴性对照组比较,miR-26b组细胞的迁移能力明显降低,差异有统计学意义(均P<0.05)(图3)。

图3 各组细胞迁移能力检测Figure 3 Determination of the migration ability in each group of cells
2.5 miR-26b对MCF-7细胞侵袭的影响
与空白对照组和阴性对照组比较,miR-26b组Transwell小室内细胞穿膜数量明显减少,差异有统计学意义(均P<0.05)(图4)。
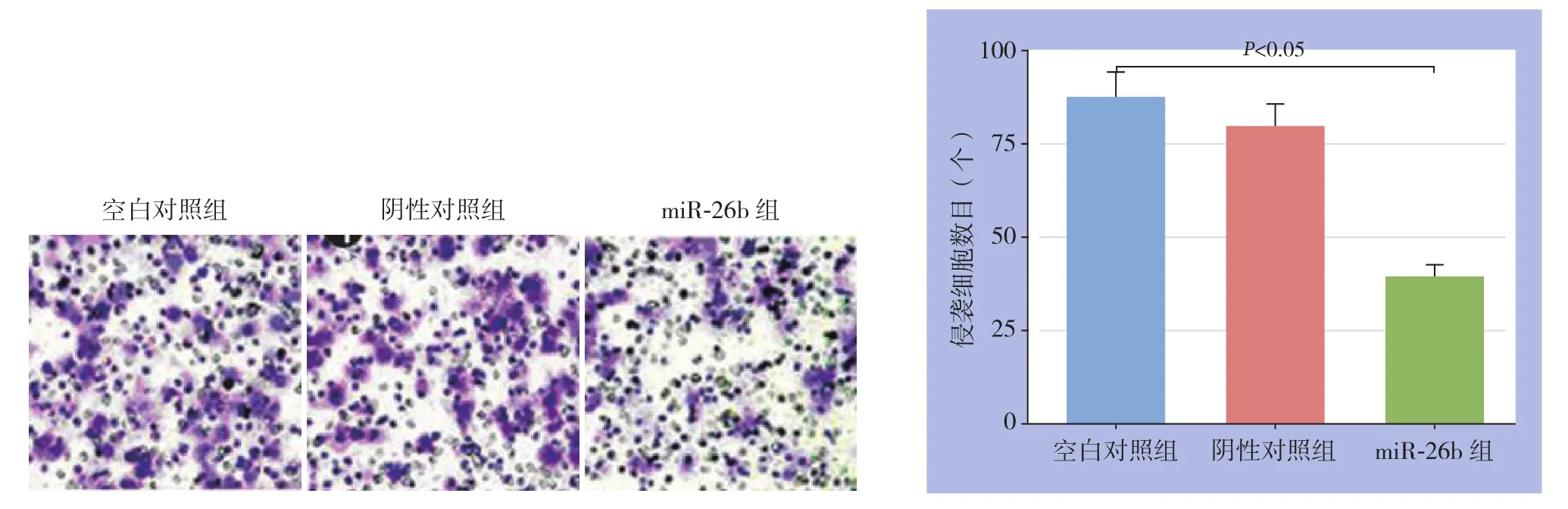
图4 各组细胞侵袭能力检测(×200)Figure 4 Determination of the invasion ability in each group of cells (×200)
2.6 miR-26b模拟物转染MCF-7细胞后Foxf2的 mRNA与蛋白表达情况
与空白对照组和阴性对照组比较,miR-26b组Foxf2 mRNA与蛋白表达水平均明显降低,差异有统计学意义(均P<0.05)(图5)。
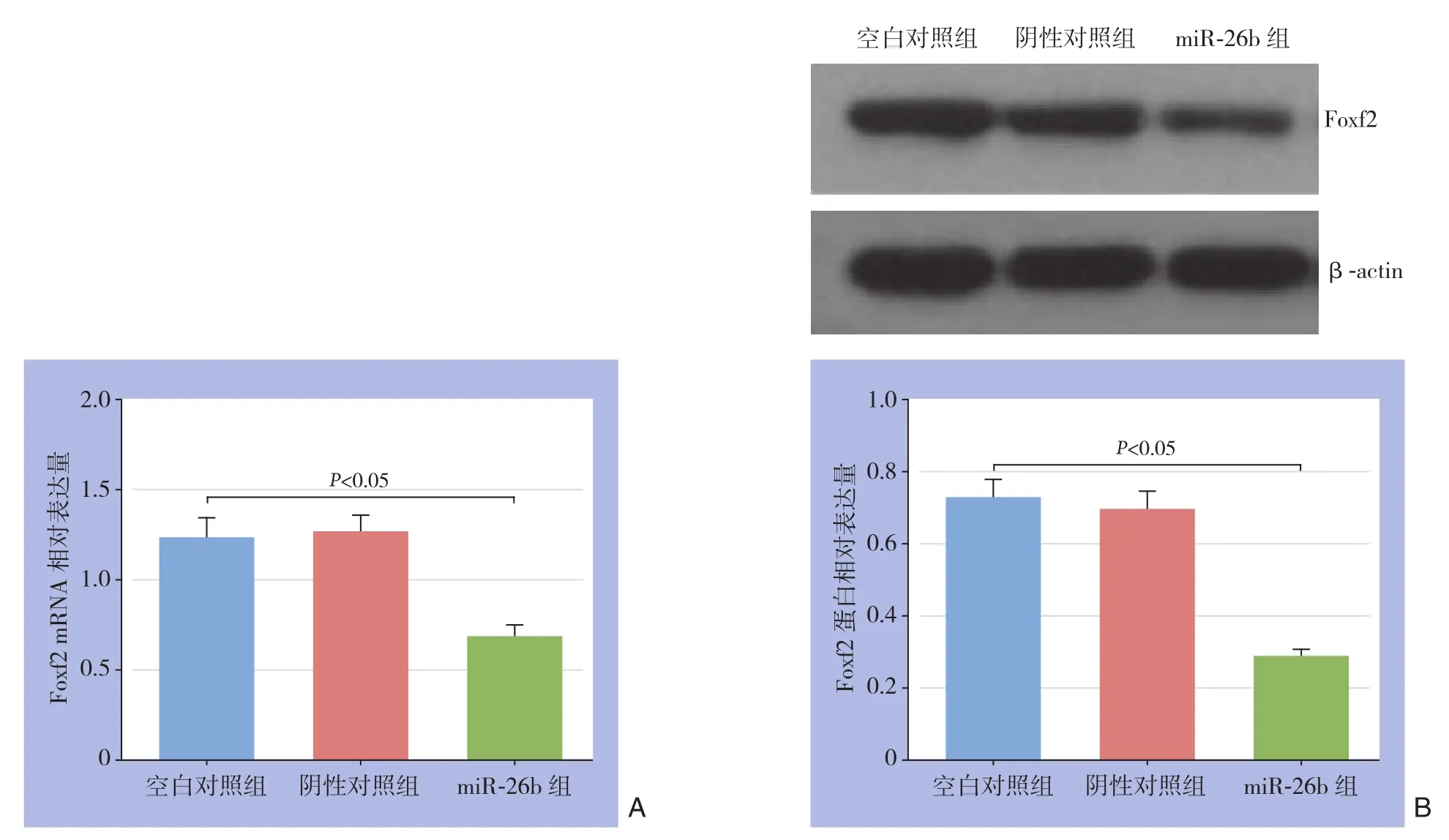
图5 各组细胞Foxf2表达检测 A:mRNA表达;B:蛋白表达Figure 5 Determination of the Foxf2 expression in each group of cells A: The mRNA expressions; B: The protein expressions
2.7 miR-26b对Foxf2基因3’-UTR的调控
双荧光素酶报告基因检测结果显示,miR-26b能够明显抑制MCF-7细胞中Foxf2-3'UTR的荧光素酶活性(P<0.05),但对Foxf2-3'UTR突变体的荧光素酶无明显抑制作用(P>0.05)(图6)。

图6 miR-26b对MCF-7细胞中Foxf2基因转录活性的影响Figure 6 The in fl uence of miR-26b on transcriptional activity of Foxf2 in MCF-7 cells
3 讨 论
近年来miRNA参与肿瘤进展成为多数研究学者关注的热点,其能够与靶基因的3'-UTR结合,降解靶基因或抑制靶基因转录,进而调控细胞增殖、分化、凋亡等生理过程[7-8]。MiR-26b与miR-26a、miR-1297、miR-4465共同构成miR-26家族,其中miR-26b主要存在于2号染色体CTDSP1基因的第4个内含子上,最早对miR-26b的研究多集中于脂肪细胞、骨髓间充质干细胞等正常细胞的分化[9-10]。近年来不断有研究[11-12]显示miR-26b亦参与恶性肿瘤的增殖分化。目前有关恶性肿瘤与miR-26家族成员miR-26a的研究较为成熟,但有关miR-26b的研究相对较少,其发挥抗肿瘤作用的具体功能及相关机制尚未阐明。
陈政纲等[13]发现miR-26b在神经胶质瘤中表达降低,且与肿瘤级别具有密切相关性,随着级别的升高表达呈下降趋势,上调miR-26b的表达能够抑制胶质瘤细胞体外增殖、迁移和侵袭;叶劲军等[14]显示miR-26b在胃癌细胞系MGC803、MKN-45中均表达下调,而过表达miR-26b后则会抑制MKN-45细胞增殖,促进正常胃上皮细胞增殖。本研究通过将miR-26b模拟物转染人乳腺癌细胞系MCF-7细胞株使miR-26b过表达,结果显示miR-26b过表达会抑制乳腺癌细胞的增殖分化。结合过往研究推测[15-16],miR-26b过表达能够阻断细胞周期G1/S时相的转化,进而抑制肿瘤细胞增殖。乳腺癌后期的淋巴结及肝脏、肺部等远端器官的转移是导致其病死率高的主要原因之一,因此抑制癌细胞迁移、侵袭是控制疾病进展、改善预后的关键[17]。本研究采用划痕实验和Transwell小室实验对转染miR-26b后的MCF-7细胞的体外迁移、侵袭能力进行检测,结果显示,miR-26b的过表达对MCF-7细胞的迁移侵袭具有显著抑制作用,提示miR-26b在乳腺癌疾病进展中发挥重要作用。
Foxf2是叉头框转录因子Fox家族的主要成员,该家族具有高保真DNA编码区和组织特异性,在胚胎形成、发育及细胞生长分化中发挥重要作用。最近研究证实Fox家族能够介导上皮间质转化,与肿瘤的转移侵袭进程具有密切相关性[18-19]。刘丽敏等[20]研究显示采用siRNA沉默宫颈癌细胞中Foxf2的表达能够增强癌细胞的增殖能力和迁移能力,促进癌细胞体外转移;朱麟等[21]研究显示在低氧环境诱导下,Foxf2在胰腺癌细胞中表达升高,促进细胞间质化。目前有关Foxf2与乳腺癌的研究相对不足,尚存在部分争议,有研究指出Foxf2的表达缺失能够促进乳腺上皮细胞间质化,进而增强基底样乳腺癌细胞的转移,另有研究证实Foxf2启动子区CpG岛甲基化能够促进乳腺癌细胞的增殖,推测Foxf2可能在乳腺癌发展中通过不同作用机制发挥双重作用[11,13-23]。近年来,有研究[24]表明微小RNA miR-182能够通过靶向抑制Foxf2的表达抑制乳腺癌细胞的增殖迁移,目前尚无miR-26b对Foxf2基因的影响的相关报道。本研究通过多过表达miR-26b的MCF-7细胞中Foxf2基因及蛋白表达水平进行测定,结果显示miR-26b过表达组,Foxf2的mRNA和蛋白水平均明显降低,同时通过双荧光素酶报告系统进行验证,结果显示miR-26b能够靶向调控Foxf2的转录,结合前期miR-26b转染后MCF-7细胞迁移侵袭能力下降的结果,初步表明下调Foxf2表达可能是miR-26b抑制乳腺癌转移侵袭的分子机制之一。
综上所述,miR-26b具有抑制乳腺癌细胞体外增殖、迁移、侵袭的作用,提高MCF-7细胞miR-26b表达水平可使Foxf2表达下调,这可能是miR-26b发挥抑制乳腺癌转移的机制之一。故miR-26b可能成为后期乳腺癌诊断及分子靶向治疗的分子标志物。
[1]王乐, 张玥, 石菊芳, 等. 中国女性乳腺癌疾病负担分析[J].中华流行病学杂志, 2016, 37(7):970–976. doi:10.3760/cma.j.issn.0254–6450.2016.07.013.Wang L, Zhang Y, Shi JF, et al. Disease burden of famale breast cancer in China[J]. Chinese Journal of Epidemiology, 2016,37(7):970–976. doi:10.3760/cma.j.issn.0254–6450.2016.07.013.
[2]张向前, 张敏, 张静, 等. 过表达miR-26b抑制MKN-45人胃癌细胞的增殖[J]. 细胞与分子免疫学杂志, 2016, 32(8):1078–1082.Zhang XQ, Zhang M, Zhang J, et al. Overexpression of miR-26b inhibiting proliferation in human gastric cancer MKN-45 cells[J].Chinese Journal of Cellular and Molecular Immunology, 2016,32(8):1078–1082.
[3]陈浩宇, 嘉红云, 吴晓蔓, 等. 肝细胞癌患者外周血中miR-26b的表达及意义[J]. 中华实用诊断与治疗杂志, 2016, 30(12):1215–1216. doi:10.13507/j.issn.1674–3474.2016.12.023.Chen HY, Jia HY, Wu XM, et al. Expression and significance of microRNA-26b in peripheral blood of patients with hepatocellular carcinoma[J]. Journal of Chinese Practical Diagnosis and Therapy, 2016, 30(12):1215–1216. doi:10.13507/j.issn.1674–3474.2016.12.023.
[4]Xia M, Duan ML, Tong JH, et al. MiR-26b suppresses tumor cell proliferation, migration and invasion by directly targeting COX-2 in lung cancer[J]. Eur Rev Med Pharmacol Sci, 2015, 19(24):4728–4737.
[5]Lo PK, Lee JS, Liang X, et al. The dual role of FOXF2 in regulation of DNA replication and the epithelial-mesenchymal transition in breast cancer progression[J]. Cell Signal, 2016, 28(10):1502–1519.doi: 10.1016/j.cellsig.2016.06.021.
[6]徐丽平, 李佳, 房林, 等. 微小RNA-26b在乳腺癌中的作用及其分子机制研究[J]. 中国全科医学, 2013, 16(33):3923–3926.doi:10.3969/j.issn.1007–9572.2013.33.011.Xu LP, Li J, Fang L, et al. The Role of miR-26b in Invasive Ductal Breast Cancer and Its Molecular Mechanism[J]. Chinese General Practice, 2013, 16(33):3923–3926. doi:10.3969/j.issn.1007–9572.2013.33.011.
[7]黄辰, 刘利英, 倪磊, 等. 肿瘤 miRNAs 调控机制的研究进展与展望[J]. 西安交通大学学报: 医学版, 2015, 36(4):429–434.doi:10.7652/jdyxb201504001.Huang C, Liu LY, Ni L, et al. Outlook and advances in research on miRNAs in cancer[J]. Journal of Xi'an Jiaotong University: Medical Sciences, 2015, 36(4):429–434. doi:10.7652/jdyxb201504001.
[8]王晨, 杨红健, 凌志强, 等. MicroRNA在雌激素受体阳性乳腺癌中的研究进展[J]. 中国肿瘤, 2016, 25(4):286–289. doi:10.11735/j.issn.1004–0242.2016.04.A009.Wang C, Yang HJ, Ling ZQ, et al. Research Progress in microRNA in Estrogen Receptor Positive Breast Cancer[J]. China Cancer,2016, 25(4):286–289. doi:10.11735/j.issn.1004–0242.2016.04.A009.
[9]Wang H, Luo J, He Q, et al. miR-26b promoter analysis reveals regulatory mechanisms by lipid-related transcription factors in goat mammary epithelial cells[J]. J Dairy Sci, 2017, 100(7):5837–5849.doi: 10.3168/jds.2016–12440.
[10]史春梅, 徐广峰, 季晨博, 等. miR-26b过表达对不同时间点人脂肪细胞分泌脂因子的影响[J]. 临床儿科杂志, 2013, 31(10):914–916. doi:10.3969/j.issn.1000–3606.2013.10.004.Shi CM, xu GF, Ji CB, et al. Secretion of adipokines in miR-26b over-expressed human adipocytes differentiation process[J].Journal of Clinical Pediatrics, 2013, 31(10):914–916. doi:10.3969/j.issn.1000–3606.2013.10.004.
[11]John Clotaire DZ, Zhang B, Wei N, et al. miR-26b inhibits autophagy by targeting ULK2 in prostate cancer cells[J]. Biochem Biophys Res Commun, 2016, 472(1):194–200. doi: 10.1016/j.bbrc.2016.02.093.
[12]黄维甄, 李俊, 郭晓红, 等. miR-26b在肝癌组织中的表达及与肝癌患者预后的关系[J]. 广东医学, 2015, 36(24):3804–3806.Huang WZ, Li J, Guo XH, et al. MiR-26b expression in liver cancer tissue and its relationship to prognosis in liver cancer patients[J].Guangdong Medical Journal, 2015, 36(24):3804–3806.
[13]陈政纲, 王子珍, 郑传宜, 等. MiR-26b通过下调COX-2表达抑制神经胶质瘤的增殖、侵袭和迁移[J]. 中南大学学报: 医学版,2017, 42(2):139–146. doi:10.11817/j.issn.1672–7347.2017.02.004.Chen ZG, Wang ZZ, Zheng CY, et al. MiR-26b inhibits proliferation,invasion, and migration of glioma by targeting cyclooxygenase-2[J]. Journal of Central South University: Medical Science, 2017,42(2):139–146. doi:10.11817/j.issn.1672–7347.2017.02.004.
[14]叶劲军, 周国仁, 张治, 等. miR-26a/b调控p53/MDM2通路对胃癌细胞凋亡的影响[J]. 临床肿瘤学杂志, 2015, 20(11):972–976.Ye JJ, Zhou GR, Zhang Z, et al. The apoptosis effect of miR-26a/b by regulating p53/MDM2 pathway in gastric cancer cells[J].Chinese Clinical Oncology, 2015, 20(11):972–976.
[15]Xu G, Ji C, Song G, et al. Obesity-associated microRNA-26b regulates the proliferation of human preadipocytes via arrest of the G1/S transition[J]. Mol Med Rep, 2015, 12(3):3648–54. doi:10.3892/mmr.2015.3858.
[16]陈诚, 游雪云, 付子毅. miR-26b在卵巢癌组织中的表达与功能[J]. 中国老年学杂志, 2017, 37(1):15–17. doi:10.3969/j.issn.1005–9202.2017.01.006.Chen C, You XY, Fu ZY. Expression of miR-26b in ovarian cancer tissue and its function[J]. Chinese Journal of Gerontology, 2017,37(1):15–17. doi:10.3969/j.issn.1005–9202.2017.01.006.
[17]黄佳慧, 陈小松, 沈坤炜. 肿瘤浸润淋巴细胞在乳腺癌中的研究进展[J]. 中华外科杂志, 2015, 53(9):714–717. doi:10.3760/cma.j.issn.0529–5815.2015.09.021.Huang JH, Chen XS, Shen KC. Research progress of tumor infiltrating lymphocytes in breast cancer[J]. Chinese Journal of Surgery, 2015, 53(9):714–717. doi:10.3760/cma.j.issn.0529–5815.2015.09.021.
[18]蒋宗胜, 阮君山, 王少明. FOX家族介导的上皮间质转化在肿瘤转移中的研究进展[J]. 中国药理学通报, 2016, 32(8):1053–1058.doi:10.3969/j.issn.1001–1978.2016.08.005.Jiang ZS, Ruan JS, Wang SM. Research progress of epithelial mesenchymal transition mediated by FOX family in tumor metastasis[J]. Chinese Pharmacological Bulletin, 2016, 32(8):1053–1058. doi:10.3969/j.issn.1001–1978.2016.08.005.
[19]van den Brink GR, Rubin DC. Foxf2: a mesenchymal regulator of intestinal adenoma development[J]. Gastroenterology, 2013,144(5):873–876. doi: 10.1053/j.gastro.2013.03.016.
[20]刘丽敏, 刘丽洲, 赵娟, 等. SiRNA沉默FOXF2基因对宫颈癌Hela细胞迁移与增殖的影响[J]. 中国医药科学, 2017, 7(3):30–33.doi:10.3969/j.issn.2095–0616.2017.03.009.Liu LJ, Liu LZ, Zhao J, et al. Impact of SiRNA silencing FOXF2 gene to migration and proliferation of cervical cancer Hela cells[J].China Medicine and Pharmacy, 2017, 7(3):30–33. doi:10.3969/j.issn.2095–0616.2017.03.009.
[21]朱麟, 张坤东, 夏翔, 等. 低氧培养对胰腺癌 CFPAC-1细胞 miR-301 a表达的影响[J]. 中华胰腺病杂志, 2016, 16(3):164–169.doi:10.3760/cma.j.issn.1674–1935.2016.03.005.Zhu L, Zhang KD, Xia X, et al. The efect of hypoxic culture on miR-301a expressi on in pancreatic cancer CFPAC-1 cells[J].Chinese Journal of Pancreatology, 2016, 16(3):164–169.doi:10.3760/cma.j.issn.1674–1935.2016.03.005.
[22]Wang QS, Kong PZ, Li XQ, et al. FOXF2 deficiency promotes epithelial-mesenchymal transition and metastasis of basal-like breast cancer[J]. Breast Cancer Res, 2015, 17:30. doi: 10.1186/s13058–015–0531–1.
[23]Tian HP, Lun SM, Huang HJ, et al. DNA Methylation Affects the SP1-regulated Transcription of FOXF2 in Breast Cancer Cells[J].J Biol Chem, 2015, 290(31):19173–19183. doi: 10.1074/jbc.M114.636126.
[24]Yu J, Shen W, Gao B, et al. MicroRNA-182 targets FOXF2 to promote the development of triple-negative breast cancer[J].Neoplasma, 2017, 64(2):209–215. doi: 10.4149/neo_2017_206.

