新生豚鼠急性高胆红素血症模型的听性脑干反应特征
赵振鹿 丛涛 杨驹 张超 袁硕龙 赵立东 乔月华
新生儿高胆红素血症是新生儿时期最常见的病理生理状态,当血清胆红素浓度达到一定水平时,可以引起听觉障碍、神经行为异常、智能发育迟缓等,甚至引发高胆红素脑病,危及生命。研究发现,高胆红素血症是引起新生儿听力损失的高危因素之一,高胆红素血症既可以引起中枢听觉系统损伤,也可以引起周围听觉系统损伤。本实验通过建立高胆红素血症新生豚鼠动物模型,观察其听性脑干反应的特征,探讨高胆红素血症对听觉系统损伤的部位,比较不同程度的高胆红素血症对听觉系统的影响。
1 材料与方法
1.1 实验动物
选用出生3天的健康豚鼠73只,纯白红目,由北京金牧阳实验动物技术有限公司提供,体重60~80 g,雌雄不限,耳廓反射灵敏,无强噪声暴露及耳毒性药物使用史,ABR测试正常,电耳镜检查,排除患有中耳炎的动物。本研究使用的动物及动物实验操作均经解放军总医院动物实验伦理审查委员会批准,符合委员会的规章制度。
1.2 实验材料
胆红素(Sigma公司),NaOH(天津市永大化学试剂有限公司),HCL(北京化工厂),PH试纸(上海三爱思试剂有限公司),PBS(北京天悦东方基因技术有限公司),0.9%生理盐水(石家庄四药有限公司),测听设备(美国TDT公司TDTⅢ设备)。
1.3 实验方法
1.3.1 动物分组 通过随机数的方法将全部动物随机分为3组:对照组(C)10只,低剂量组(T1)40只,高剂量组(T2)23只。
1.3.2 ABR测试 清醒豚鼠,动物保定器固定(根据解放军耳鼻咽喉科研究所电生理研究室研制的啮齿类动物保定器改装)。记录电极经豚鼠颅顶两耳廓前缘连线中点,穿过皮肤插入颅骨与硬脑膜之间,参考电极刺入给声耳垂皮下,地线刺入对侧耳垂皮下,每根电极电阻不超过2 Ω。开放声扬声器放置距外耳道口0.5 cm处,避免接触耳廓。采用美国TDT公司TDTⅢ设备和SigGen RP系统软件。刺激声为click声,强度范围100~10 dB SPL连续给声,间隔10 dB SPL逐渐衰减,接近阈值时,声音衰减5 dB SPL。滤波带宽300~3000 Hz,刺激频率一般为10~20次/s,信号采集放大50000倍,观察窗为10 s,叠加1024次。记录刺激声强100 dB SPL时各波潜伏期、波间期及Ⅱ波反应阈。Ⅱ波的分化较其他波形更好,波幅较大,更适合做阈值判断。给药前及给药后1 h、4 h、8 h后分别进行ABR动态监测,给药1 h后ABR无异常的豚鼠继续测给药后2 h。
1.3.3 动物模型的建立 胆红素溶液配制:准确称取胆红素粉末40.0 mg,加入0.5 ml 0.5 mol/L NaOH溶液和3 ml蒸馏水,摇匀至完全溶解,逐滴加入1 mol/L HCL调其PH至8.4,蒸馏水定容至4 ml,0.22 μm滤器过滤得无菌10 mg/ml胆红素溶液。C组腹腔注射生理盐水1 ml;T1组按体重腹腔注射胆红素溶液75 μg/g;T2组按体重腹腔注射胆红素溶液100 μg/g。给药后1 h、4 h、8 h后分别进行ABR动态监测,ABR异常者判定造模成功,给药1 h后ABR无异常的豚鼠继续测给药后2 h。
1.3.4 取血测血清总胆红素的量 取造模成功的豚鼠T1组10只,T2组10只,对照组10只,给药8 h后心脏取血,离心取上清,送解放军总医院生化科测其血清总胆红素的量。
1.4 统计学分析
数据应用SPSS 16.0软件处理,实验数据用均数±标准差(±s)表示,两组间比较用独立样本t检验,假设检验水准α=0.05,P<0.05差异有统计学意义。
2 结果
2.1 动物模型鉴定
2.1.1 动物行为学观察 T1、T2组分别有10只豚鼠给药1~2 h后出现明显行为异常,表现为运动减少、反应迟钝、平衡差,8 h症状最明显,T1组较T2组程度较轻,T1组另有4只豚鼠给药4 h后出现行为异常,其余豚鼠观察8 h后均无明显行为异常。
2.1.2 血清总胆红素量的测定 T1、T2组给药后1~2 h ABR异常的10只豚鼠及C组10只豚鼠,给药8 h后T2组血清TSB高于T1组高于C组(T2>T1>C)差异有统计学意义,见图1。

图1 3组给药8小时后血清TSB水平比较
2.2 对照组腹腔注射生理盐水后ABR变化
C组10只豚鼠腹腔注射生理盐水1 h、4 h、8 h后,ABR波Ⅰ、Ⅱ、Ⅲ、Ⅳ潜伏期,Ⅰ-Ⅱ、Ⅰ-Ⅲ、Ⅰ-Ⅳ、Ⅱ-Ⅲ、Ⅱ-Ⅳ、Ⅲ-Ⅳ波间期及阈值较给药前无明显变化(P>0.05),见图2,3。

图2 C组给药后各时间点ABR变化情况

图3 C组给药后各时间点与给药前(B0)ABR变化情况
2.3 T1组腹腔注射胆红素溶液后ABR变化
T1组40只豚鼠给药后,14只ABR各波潜伏期、波间期延长。其中3只豚鼠给药1 h后ABR各波潜伏期及波间期延长,7只豚鼠给药2 h后ABR各波潜伏期及波间期延长,统计时都是按2 h统计。以上10只豚鼠监测8 h后,除2 h Ⅲ~Ⅳ波间期差异无统计学意义(P>0.05)外,其余时间点各波潜伏期、波间期延长差异有统计学意义(P<0.05),且给药4 h后ABR各波潜伏期、波间期延长达最大值,但阈值无明显升高(P>0.05)见图4,5。另外4只ABR异常的豚鼠,给药4 h后ABR各波潜伏期及波间期开始延长,24 h后恢复正常见图6,7。余下26只豚鼠监测8 h后ABR均未见明显异常(P>0.05)。

图4 TI组给药1~2 h后ABR异常的10只豚鼠各时间点ABR变化情况

图5 T1组给药1~2 h后ABR异常的10只豚鼠各时间点与给药前(B1)ABR变化情况

图6 T1组给药24 h后ABR恢复正常的4只豚鼠各时间点ABR变化情况

图7 T1组给药24 h后ABR恢复正常的4只豚鼠各时间点与给药前(B1)ABR变化情况
2.4 T2组腹腔注射胆红素溶液后ABR变化
T2组23只豚鼠给药后,10只豚鼠ABR各波潜伏期、波间期延长,阈值升高,除给药2 h阈值升高差异无统计学意义外(P>0.05),其余差异均有统计学意义(P<0.05)。其中4只豚鼠给药1 h后各波潜伏期及波间期延长,6只豚鼠给药2 h后各波潜伏期及波间期延长。统计时都是按2 h统计。给药4小时后ABR各波潜伏期、波间期延长达最大值,但阈值从1~8 h逐渐升高见图8,9。余下豚鼠监测8 h后,ABR均未见异常(P>0.05)。

图8 T2组给药后ABR异常的10只豚鼠各时间点ABR变化情况

图9 T2组给药后ABR异常的10只豚鼠各时间点与给药前(B2)ABR变化情况
2.5 不同剂量的胆红素对听觉系统功能的影响
T1组、T2组给药后1~2 h ABR异常的10只豚鼠给药前ABR各波潜伏期、波间期及阈值无明显差异(P>0.05)。给药后除2 h Ⅰ~Ⅱ、Ⅲ~Ⅳ波间期和阈值差异无统计学意义外(P>0.05),其余时间点T2组较T1组ABR各波潜伏期及波间期延长程度大且阈值升高,差异有统计学意义(P<0.05)见图10,11。

图10 T1、T2组给药1~2 h后ABR异常的豚鼠给药前及给药后ABR变化情况
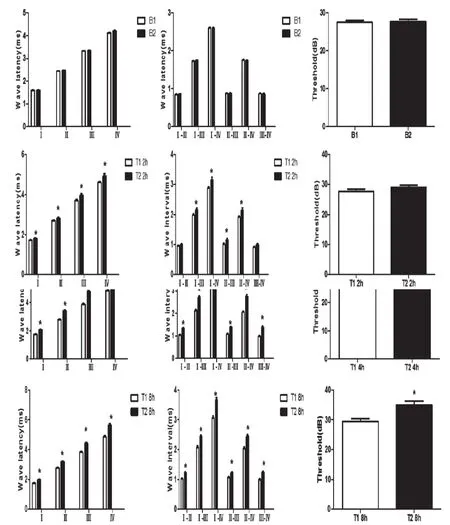
图11 T1、T2组给药1~2 h后ABR异常的10只豚鼠给药前及给药后各时间点ABR变化情况
3 讨论
目前建立高胆红素血症动物模型有以下几种方法:腹腔或静脉注射胆红素溶液[1,2]、直接从动物延髓注射胆红素溶液[3]、腹腔注射盐酸苯肼诱发溶血[4]、利用基因缺陷的动物(Gunn大鼠)[5]等。本实验采用的是陈舜年腹腔注射胆红素溶液的方法诱发高胆红素血症,此方法简便易行,监测的是清醒状态下新生3天的豚鼠急性期(8 h内)ABR的变化。新生3天的豚鼠ABR波Ⅴ引出率不高,未做统计,结果与宋鹏研究相似[6]。清醒状态下进行监测,一是消除了麻醉药对ABR潜伏期及波间期的影响,二是避免了腹腔注射胆红素后,再给麻醉药引起的动物死亡。实验组部分豚鼠给药后ABR未见明显异常,可能与豚鼠个体差异有关。
3.1 高胆红素血症可以同时损伤外周听觉系统和低位脑干听觉系统
听性脑干反应(ABR)或脑干听觉诱发电位(BAEP)可以反映耳蜗、耳蜗后神经和脑干听觉通路的功能,且不受受试者状态的影响。通常认为ABR的波Ⅰ来源于耳蜗,波Ⅱ来源于耳蜗核,波Ⅲ来源于上橄榄核,波Ⅳ来源于外侧丘系,波Ⅴ来源于下丘,各波潜伏期及波间期的异常通常对应着相应部位的损伤。最早使用ABR等电生理检查研究听觉通路损害部位的是Chisin R等人,他们检测了13例因新生儿期高胆红素血症致听力损失的患者,结果发现11例ABR未引出,另2例只有在高强度刺激下才能记录到反应[7]。张红和丁辉等研究发现胆红素增高引起ABR的异常,主要表现为Ⅰ波潜伏期长,指出胆红素首先侵犯的是周围听觉系统[8,9]。Shapiro SM和Ahlfors等利用先天性基因缺陷的Gunn大鼠建立高胆红素血症动物模型,对生后18天的Gunn大鼠进行BAEPs检测,发现其Ⅰ~Ⅱ、Ⅰ~Ⅲ波间期延长,指出病变部位在听神经和脑干[10,11]。梁勇等研究则发现胆红素增高引起ABR的异常,主要表现为Ⅲ波、Ⅴ波、Ⅰ~Ⅲ波间期长,由此指出胆红素首先侵犯的是中枢听觉系统[12]。
通常认为ABR各波均为突触后电位,胆红素是亲脂性物质,神经突触膜上约有20%的神经节苷脂和神经鞘磷脂,胆红素与这两种物质结合形成静电复合物,导致神经突触膜静息电位和动作电位下降,ABR各波潜伏期及波间期延长。国内外其他高胆红素血症动物模型研究,大多是给药8 h后进行ABR测定,发现ABR各波潜伏期、波间期延长,但之前ABR的变化情况并没有描述。本实验动物腹腔注射胆红素溶液后1 h开始检测,发现给药1~2 h后,ABR各波潜伏期、波间期同时延长,表明胆红素可以同时引起外周和低位脑干听觉系统损伤。此次研究与前人研究结果差异可能与造模的方式不同、胆红素试剂批次不同、动物年龄大小不同有关。
3.2 随着血清胆红素量的增加,听力损伤逐渐加重
高胆红素血症引起的病理损伤主要是由血清中未结合胆红素(UCB)引起,由于UCB测定比较困难,故血清总胆红素(TSB)仍是评估病损的重要指标。赵赛等对两组新生儿进行脑干听觉诱发电位检查,发现高胆红素血症新生儿脑干听觉诱发电位检查异常率较对照组高,且与胆红素浓度呈正相关[13]。姜苏敏等分析胆红素水平、黄疸出现时间与ABR反应阈的相关性,发现当血清胆红素<342 μmol/L时,黄疸出现时间≤18小时组出现听力损失的比例高于黄疸出现时间>48小时组;而血清胆红素≥342 μmol/L时,两组听力损失比例无明显差异,由此指出黄疸出现越早听力损失的可能性越大[14]。De VL等研究发现,血清胆红素的浓度和暴露时间均与听力损失有关,并指出胆红素水平>1768 μmol/L可能是重要危险因素[15]。Sheyholeslami K等认为听力损失主要发生在血清胆红素水平中度增高时(TSB>1768 μmol/L)[16]。但Newman TB和董淑兰等研究发现较安全的血清胆红素水平也可以引起听觉系统异常[17,18]。也有研究发现,高胆红素血症患儿听力损失与胆红素的量无直接关系。Newman等进行了一项包括12个研究中心共41324例出生低体重患儿的前瞻性研究,发现感音神经性听力损失与胆红素水平没有直接相关性[19]。Jiang ZD等研究也发现,高胆红素血症患儿听力损失与胆红素的量无关[20]。
本实验设定了低剂量75 μg/g(T1)和高剂量100 μg/g(T2)两组动物,发现低剂量组给药后ABR各波潜伏期、波间期延长,但阈值无明显升高。低剂量组中有4只豚鼠给药4 h后ABR各波潜伏期、波间期开始延长,24 h后恢复正常,提示低剂量的胆红素引起的听觉系统损伤有恢复的可能。研究还发现,高剂量组较低剂量组ABR各波潜伏期、波间期延长程度大,且阈值升高,高剂量组血清胆红素的水平也高于低剂量组,说明血清胆红素水平越高,听觉系统损伤越重。T1、T2组给药4 h后ABR各波潜伏期、波间期延长达最大值,与陈舜年造模时发现给药4 h后血清胆红素达峰值相符,也说明了表明血清胆红素水平越高,听觉系统损伤越重。之前研究报道高胆红素血症患儿听力损失与胆红素的量无直接关系,可能是因为胆红素的安全剂量范围比较小,稍高浓度的胆红素即可引起严重的病理损害。这或许可以给我们提示,临床上并不能依据ABR阈值或血清TSB的量来判定新生儿高胆红素血症听觉系统损害的严重程度,ABR各波潜伏期、波间期的变化更敏感,更适用于早期发现高胆红素血症引起的病理损害。所以对于血清胆红素高的新生儿,我们应该早期进行ABR监测,以便早发现,及时干预,从而降低高胆红素血症的致残、致死率,减轻家庭和社会的负担。
4 结论
高胆红素血症可以同时损伤外周和低位脑干听觉系统;低剂量的胆红素引起的听觉系统损伤部分可以恢复;随着胆红素量的增加,听力损失逐渐加重;ABR各波潜伏期、波间期的变化较ABR阈值和血清TSB水平更敏感,更适用于早期发现高胆红素血症引起的听觉系统损伤。
[1]王晓丽,郭明星,梁俊辉,等.新生大鼠高胆红素血症及脑病模型的建立与评价[J].中国病理生理杂志,2014,30:1523-1531.
[2]陈舜年,贲小明,李佩红,等.胆红素脑病动物模型的制作与鉴定[J].新生儿科杂志,1997,12:166-168.
[3]Song S,Hu Y,Gu X,et al.A novel newborn rat kernicterus model created by injecting a bilirubin solution into the cisterna magna[J].PLoS One,2014,9:e96171.
[4]Rice AC,Shapiro SM.A new animal model of hemolytic hyperbilirubinemia-induce bilirubin encephalopathy(kernicterus)[J]. Pediatr Res,2008,64:265-269.
[5]Nguyen N,Bonzo JA,Chen S,et al.Disruption of the ugt 1 locus in mice resembles human Crigler-Najjar type I disease[J]. J Biol Chem,2008,283:7910-7911.
[6]宋鹏,罗凌蕙,黄翔,等.急性高胆红素血症豚鼠听功能研究[J].听力学及言语疾病杂志,2005,13:352-355.
[7]Chisin R,Perlman M,Sohmer H.Cochlear and Brain Stem Responses in Hearing Loss following Neonatal Hyperbilirubinemia.Ann Otol Rhinol Laryngol,1979,88:352-357.
[8]张红,时锋,毛继芳,等.高胆红素血症新生儿脑干听觉诱发电位研究[J].临床神经电生理学杂志,2005,14:90-92.
[9]丁辉,何平.诱发电位在新生儿高胆红素血症中的应用[J].国外医学妇幼保健分册,2005,16:90-91.
[10]Shapiro SM,Te Selle ME. Cochlear Microponics in the Jaundiced Gunn Rat[J]. Am J Otolaryngol,1994,15:129-137.
[11]Ahlfors CE, Shapiro SM. Auditory Brainstem Response and Unbound Bilirubin in Jaundiced(jj)Gunn Rat Pups[J]. Biol Neonate,2001,80:158-162.
[12]梁勇,周晰.急性高胆红素血症对豚鼠周围听觉系统影响的形态学研究[J].听力学及言语疾病杂志,2010,18:580-582.
[13]赵赛,程怀平,田兆方.脑干听觉诱发电位对高胆红素血症新生儿的早期诊断效果[J].中国实用神经疾病杂志,2015,18:86.
[14]姜苏敏,刘世琳,张莉,等.高胆红素血症新生儿血清胆红素水平与听力损失程度的相关性分析[J].听力学及言语疾病杂志,2015,23:37-39.
[15]De Vries LS,Lary S,Dubowitz LM.Relationship of serumbilirubin level to ototoxicity and deafness in high-risk lowbirth-weight infants[J]. Pediatrics,1985,76:351-354.
[16]Sheyholeslami K,Kaga K.Otoacustic emissions and auditory brainstem responses afer neonatal hyperbilirubinemia[J].Int J Pediatr Otorhinolaryngol,2002,52:65-73.
[17]Newman TB,Mairsels MJ.Evaluation and treatment of jaundice in the term newborn:a kinder, gentler approach[J].Pediatrics,1992,89:809-818.
[18]董淑兰.新生儿高胆红素血症对远期预后的影响[J].实用儿科临床杂志,2004,12:1056-1057.
[19]Newman TB,Klebanoff.Neonatal hyperbilirubinemia and long-term outcome:another look at the Collaborative Perinatal Project[J].Collaborative Periniatal Project,1993,92:651-657.
[20]Jiang ZD,Chen C,Liu TT,et al.Changes in brainstem auditory evoked response in term neonates with hyperbilirubinemia[J]. Pediatr Neurol,2007,37:35-41.

