药食用真菌提取物抗氧化活性研究
秦铭铭, 耿 燕, 栾 雪, 曾美珍, 邵瑞华,陈和地, 齐 鹏, 史劲松, 许正宏
药食用真菌提取物抗氧化活性研究
秦铭铭, 耿 燕*, 栾 雪, 曾美珍, 邵瑞华,陈和地, 齐 鹏, 史劲松, 许正宏
(江南大学 药学院,江苏 无锡 214122)
为了探究猴头菌、蜜环、灵芝、虫草头孢和虫草被孢等5种药食用真菌菌粉中小分子的抗氧化能力,利用正己烷、氯仿、乙酸乙酯和甲醇等4种有机溶剂按极性提取各菌粉,建立了5种利用96微孔板快速检测物质的抗氧化指标的方法,并比较了不同菌粉提取物的抗氧化活性。结果表明,5种菌粉提取物对·O2-均有着良好的清除能力,虫草被孢和猴头菌提取物对DPPH·清除率比较高,在质量浓度达到8 mg/mL时的清除率分别达到94.91%和92.26%。灵芝氯仿提取物在质量浓度为8 mg/mL时,·OH清除率达到90%,接近VC的清除能力。
抗氧化活性;DPPH自由基;超氧自由基;灵芝;虫草被孢
衰老及许多疾病,如脑缺血、心肌缺血、糖尿病、动脉粥样硬化、肿瘤、炎症等均与氧自由基有着密切关系[1-2],可被自由基清除剂等抗氧化物质所改善,因此抗氧化物质一直备受关注,其中包括药食用真菌来源的天然抗氧化化合物[3-4]。
我国具有丰富的药食用真菌资源,并且分布广泛,种类繁多,其中大多数对人体健康有一定的改善调节作用。灵芝,作为一种营养和保健价值较高的大型担子菌,可显著减少脂质过氧化产物丙二醛(MDA)的含量,增强抗氧化酶如超氧化歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)以及其它抗氧化酶的活性。灵芝在多种不同动物和细胞模型中表现出抗氧化清除自由基功能,表明其可能对于免疫调节、抗肿瘤、降血压、保肝、抗衰老等方面均有一定的功效[5]。灵芝菌粉在因摄入乙醇而造成的小鼠抗氧化系统紊乱的动物模型中,有效抵抗了脂质过氧化,减少了MDA的生成,从而对乙醇性肝损伤有一定的保护作用[6]。研究表明,猴头菌提取物是一种良好的生物活性物质,可有效提高小白鼠大脑和肝脏中的SOD[7];猴头菌子实体也具有清除自由基的功能,其醇提物显示出良好的总还原能力与DPPH·清除能力,且水提物具有很好的清除DPPH·、·OH和·O2-活性[8]。蜜环是我国一种珍贵的药食用真菌,经常食用可增强机体免疫力,具有镇静、抗惊厥、抗衰老、增强耐缺氧能力等作用[9]。实验证明,蜜环菌的醇提物对DPPH·、·OH和·O2-这3种自由基都表现出较强的清除能力,且清除效率与浓度成正相关[10]。动脉粥样硬化兔喂食虫草头孢之后,其机体SOD和GSH-Px活力增强,说明虫草头孢具有增加机体抗氧化功能的作用[11]。此外,虫草被孢的热水和乙醇提取物也均具有一定的抗氧化活性[12]。综上可知,虫草被孢、猴头菌、蜜环、灵芝、虫草头孢这5种药食用真菌均有一定程度的抗氧化能力,但对其有效抗氧化组分还不是很清晰,有待于进一步的研究。
作者利用正己烷、氯仿、乙酸乙酯和甲醇根据极性从小到大分步对猴头菌、蜜环、灵芝、虫草头孢和虫草被孢等5种药食用真菌菌粉进行提取,得到了20个提取组分,建立了5种利用96微孔板检测物质的抗氧化指标的方法,并分别评价并比较了这20种提取物的抗氧化活性。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 猴头菌菌粉、蜜环菌粉、虫草头孢菌粉、虫草被孢菌粉、灵芝菌粉:购自江苏省神华药业公司,4℃保存。DPPH标准品、氯化硝基四氮唑、还原性烟酰胺腺嘌呤二核、吩嗪硫酸二甲酯:购自Sigma公司;其余药品均购自国药。
1.1.2 仪器 EL204电子天平:博特勒托利多公司产品;MD酶标仪:美国MD公司产品;冷冻干燥机:美国Labconco公司产品;电热恒温水浴锅:上海精鸿实验设备有限公司产品;R-200型旋转蒸发仪:瑞士Buchi公司产品;数显鼓风干燥箱:上海博讯实业有限公司产品。
1.2 方法
1.2.1 物质提取 称取一定量的猴头菌菌粉,按照固液质量体积比1 g∶5 mL加入正己烷,室温下搅拌提取12 h后过滤,滤液浓缩冻干即为猴头菌菌粉正己烷提取物,向滤渣中继续以同样固液质量体积比加入氯仿,提取,过滤,重复上述方法,依次得到猴头菌菌粉氯仿提取物、乙酸乙酯提取物和甲醇提取物。采用同样的方法对灵芝、蜜环、虫草头孢和虫草被孢进行各个有效组分的提取,最终得到的产物经过浓缩冻干后保存于-20℃[13]。
1.2.2 DPPH自由基清除能力测定 将50 μL不同待测样品与150 μL DPPH溶液分别加入孔板中,摇匀,室温静置20 min后于517 nm处测定吸光度(分别以不同体积分数的标准液与95%甲醇溶液调零)[12]。
清除率=(1-(A1-A2)/A0)×100%
A0为50 μL蒸馏水+150 μL DPPH溶液的吸光值;A1为50 μL样品溶液+150 μL DPPH溶液的吸光值;A2为50 μL样品溶液+150 μL蒸馏水的吸光值。以样品含量和清除率分别为横纵坐标,作图。
1.2.3 总还原能力测定 在1.5 mL ep管中分别加入0.2 mol/L pH 6.6的磷酸缓冲液250 μL和不同浓度的待测样品溶液100 μL,加入250 μL 1 g/dL铁氰化钾,混合均匀后于50℃反应20 min。取出后加入250 μL 10 g/dL三氯乙酸终止反应,5 000 r/ min离心10 min。取上清液100 μL,加入100 μL蒸馏水和20 μL 0.1 g/dL FeCl3溶液,混匀后静置10 min,在700 nm处检测吸光值。VC作为阳性对照[14]。
1.2.4 羟基自由基清除能力测定 向50 μL不同待测样品中加入50 μL 9 mmol/L FeSO4和50 μL 9 mmol/L水杨酸-乙醇溶液于孔板中。然后加50 μL 8.8 mmol/L H2O2溶液,在510 nm下测定各浓度的吸光度。以50 μL蒸馏水代替H2O2溶液测定所得吸光值作为样品的本底吸收值[15]。按下式计算·OH清除率:
·OH清除率=(1-(A1-A2)/A0)×100%
式中,A0为空白对照液的吸光度;A1为样品溶液后的吸光度;A2为显色剂H2O2样品溶液本底的吸光度。
1.2.5 超氧自由基清除能力测定 (PMS-NADHNBT法) 向90 μL不同待测样品溶液中加入30 μL 468 μmol/L还原型烟酰胺腺嘌呤二核苷(NADH)和30 μL 300 μmol/L氯化硝基四氮唑(NBT),然后加入30 μL 60 μmol/L吩嗪硫酸二甲酯(PMS),25℃水浴5 min,于560 nm处读取吸光值(以上试剂均溶解于pH为8.0的16 mmol/L Tris-HCl缓冲溶液中),结果按以下公式进行计算[16]。
清除率=(1-A1/A0)×100%
式中,A0为空白值 (缓冲液代替样品);A1为样品吸光值。
1.2.6 超氧自由基清除能力测定 (邻苯三酚法)
采用邻苯三酚自氧化法测定,具体实验方法参照文献[17]进行。
1.2.7 数据统计 实验中所有数据均是3次测定的平均值,用Mean±SD(标准偏差)来表示Graph Pad。Prism 5.0分析软件用于作图和方差分析(ANOVA)。
2 结果与讨论
2.1 清除DPPH·活性
各提取物对DPPH·均有良好的清除效果,且基本表现量效正相关,结果见图1。总体看来,对于清除DPPH·,各个物质的甲醇提取组分和氯仿提取物组分有比较好的清除活性,其中虫草被孢的甲醇提取物和猴头菌的氯仿提取物在质量浓度为8 mg/mL时,其清除率分别达到94.91%和92.26%,表现出较高的抗氧化能力;头孢氯仿提取物在质量浓度达到8 mg/mL时,其清除率也达到了81.32%,而蜜环和灵芝氯仿提取物的清除率则也在最高质量浓度时达到60%~70%,具有比较强的抗氧化活性。但各个物质的正己烷提取物的清除DPPH·能力相对较差,且清除效果随着浓度增大变化不大。
2.2 总还原能力
如图2所示,相比较之下,5种菌粉中虫草被孢氯仿提取物总还原能力较强,在质量浓度为8 mg/ mL时,与VC标准品相比,相当于其在相同浓度下活性的50%。其各个有机试剂提取物的总还原能力依次为氯仿>乙酸乙酯>甲醇>正己烷。
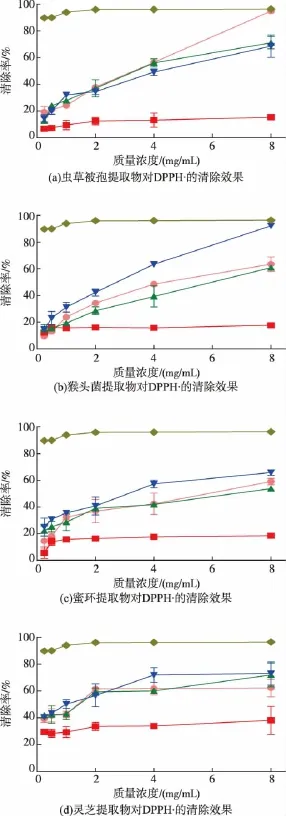

图1 各提取物对DPPH·的清除效果Fig.1 Scavenging activity to DPPH·of extracts


图2 各提取物的总还原能力Fig.2 Total reducing power of extracts


图3 各提取物对·OH的清除效果Fig.3 Scavenging activity to hydroxyl radical of extracts
2.3 对·OH的清除效果
如图3所示,猴头菌对·OH活性的清除作用并不显著,而虫草被孢、灵芝、蜜环和虫草头孢均表现出一定的清除能力。其中灵芝提取物对·OH的清除能力最强,灵芝氯仿提取物在质量浓度为8 mg/mL时,清除率达到90%,接近于VC的清除能力。
2.4 超氧自由基清除能力(PMS-NADH-NBT法)
如图4所示,各个物质的提取物在清除超氧自由基水平上均有着良好的能力,均表现出比较好的清除效果,且清除能力呈剂量正相关。其中虫草头孢的乙酸乙酯提取物,其超氧自由基清除能力在质量浓度达到8 mg/mL时,与VC的清除能力不相上下。而虫草被孢乙酸乙酯提取物、猴头菌氯仿提取物、蜜环乙酸乙酯和氯仿提取物、灵芝乙酸乙酯提取物均在8 mg/mL时达到了80%~90%的超氧自由基清除能力。

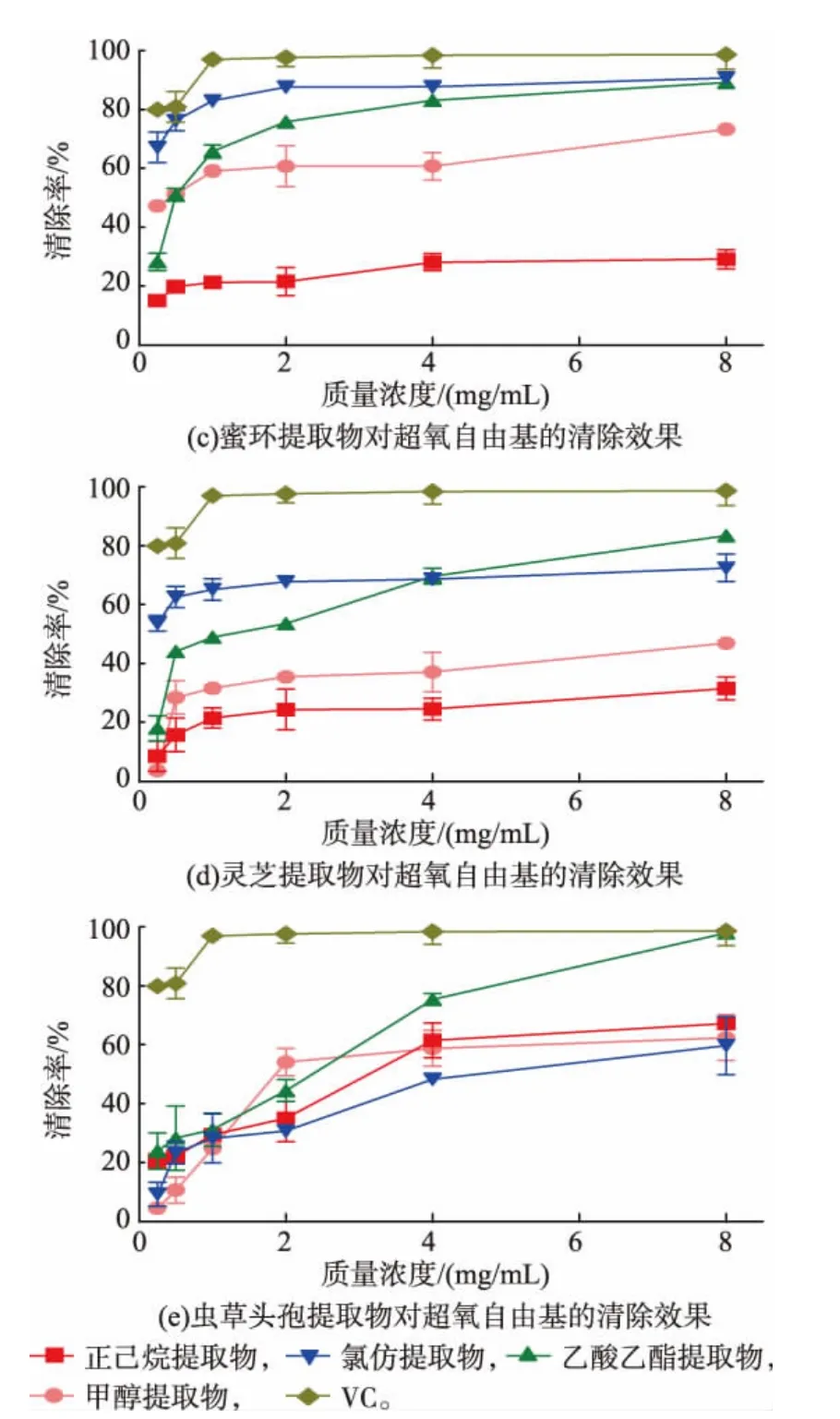
图4 各提取物对超氧自由基的清除效果Fig.4 Scavenging activity to superoxide radical of extracts


图5 各提取物对·O2-的清除效果Fig.5 Scavenging activity to·O2-of extracts
2.5 超氧自由基清除能力(邻苯三酚法)
如图5所示,虫草被孢的各提取物在清除·O2-方面具有比较好的活性,且不同有机试剂提取物的抗氧化活性大小依次为甲醇>氯仿>乙酸乙酯>正己烷。蜜环和虫草头孢的氯仿提取物的清除·O2-能力其次。
3 结语
研究指出,自由基和活性氧是细胞癌变的原始引发机制,自由基是机体的正常代谢产物,在平衡状态下发挥重要作用,如抑制肿瘤、消炎和抗菌等;一旦平衡被打破,如机体受到疾病或某些外源性药物和毒物的侵害,自由基便会产生强大的伤害作用,造成生物膜损伤,引起蛋白质、酶等的氧化破坏,从而影响免疫系统和内脏器官的形态功能,引发机体疾病,甚至死亡[18]。很多疾病的发生都与自由基有关,如癌症、动脉粥样硬化症、老年痴呆症、帕金森综合症等,因此抗自由基药物,特别是对机体副作用小的药物的开发刻不容缓。
作者建立了5种用96微孔板检测各个物质的抗氧化指标效的方法,分别评价了猴头菌、蜜环、灵芝、虫草头孢和虫草被孢的正己烷、氯仿、乙酸乙酯和甲醇提取物的抗氧化活性。结果表明,相同组分对于不同的自由基所表现出的抗氧化能力不尽一致,如虫草被孢甲醇提取物对DPPH及·O2-有较好的清除效果,但对于·OH的清除效果则不足20%。此外,对于同一个自由基,同种物质的不同组分之间也存在着比较大的抗氧化能力差异。总体看来,每种有机试剂萃取组分都有一定的抗氧化活性,但相较之下发现,甲醇和氯仿萃取的组分表现出相对较高的抗自由基能力,尤其是虫草被孢甲醇提取物和猴头菌氯仿提取物,在质量浓度为8 mg/mL时,对DPPH·清除率超过了92%,灵芝的氯仿提取物在该作用浓度时对·OH的清除效果也达到了90%的清除效果。而各药食用真菌的正己烷组分对各个自由基的清除能力则处于较弱水平。总的来说,极性较小的有机试剂萃取组分抗氧活性较低,而其余极性较大的有机试剂萃取组分对某种自由基或几种自由基表现出较好的清除能力,可能是不同极性有机溶剂萃取组分差异所致。
药食用真菌的抗氧化活性研究一直是人们探究机体氧化抗氧化平衡的研究热点,不少研究都表明其含有比较好的抗氧化功能[7],作者利用极性不同的有机试剂对其进行提取,所得提取物也表现出比较良好的抗氧化活性,可能是有机试剂本身具有极性,所以根据相似相溶所得到的不同提取物中也含有相应的极性小分子物质,由于小分子物质在机体中易于被吸收,生物利用度比较高,所以这些含有抗氧化因子的活性组分值得被进一步的研究与利用。因此,后续实验中可以对这些有效活性组分的提取物进行深一步的开发,从而为抗氧化药物的研究与开发奠定基础。
参考文献:
[1]COYLE J T,PUTTFARCKEN P.Oxidative stress,glutamate,and neurodegenerative disorders[J].Science,1993,262(5134):689-695.
[2]HALLIWELL B,GUTTERIDGE J M.Role of free radicals and catalytic metal ions in human disease:an overview[J].Methods Enzymol,1990,186:1-85.
[3]KIM J P,YUN B S,SHIM Y K,et al.Inoscavin A,a new free radical scavenger from the mushroom Inonotus xeranticus[J]. Tetrahedron Letters,1999,40(36):6643-6644.
[4]KIM W G,LEEe I K,KIM J P,et al.New indole derivatives with free radical scavenging activity from Agrocybe cylindracea[J]. Journal of Natural Products,1997,60(7):721-723.
[5]LIN Zhibin.Study on anti-oxidative and free radical scavenging activity of Ganoderma lucidum[J].Journal of Fungal Research,2014,12(2):63-70.
[6]XUE Li.Effect of extract from cordyceps power,ganoderma lucidum power,kudzuvine toot on anti-oxidiazing system of mice after acute alcohol administration[J].Shanxi Med J,2014,43(17):1999-2002.
[7]LIU Jinqing,ZHANG Song,YANG Xiaobing.Advances in studies on antiaging effect of bioactive components of medicinal fungi [J].Life Science Research,2005,9(4):82-86.
[8]PAN Wei,LIU Ruina,ZHANG Lujun,et al.Antioxidant activity of Hericium erinaceus fruit body extracts[J].Acta Edulis Fungi,2012,19(2):95-99.
[9]ZHOU Rong,KANG Jichuan.A review on Armillaria mellea[J].Journal of Mountain Agriculture and Biology,2005,24(3):260-264.
[10]ZHAI Fengyan,ZHANG Fangpeng,CUI Mingyang,et al.Antioxidant and antibacterial activities of Armillaria mellea extracts[J]. Journal of Hennan Institute of Science and Technology,2013,41(3):71-74.
[11]JIN Wanbing,DENG Zuyue,KANG Hua,et al.Effect of Cordyceps fungus powder on experimental atherosclerosis rabbits blood lipid,antioxidant system factors and inflammation[J].Chinese Journal of Traditional Medical Science and Technology,2012,19(4):322-324.
[12]HAN Hongkun,YANG Xiaotong,YANG Qingyao,et al.Antioxidant activity of Hirsutella sinensis mycelial extract measured by ferric ion reducing antioxidant power(FRAP)[J].Journal of Shanghai Normal University(Natural Science),2011,40(3):271-275.
[13]GENGY,ZHUS,LUZ,etal.Anti-inflammatory activity of mycelial extracts frommedicinal mushrooms[J].Int J Med Mushrooms,2014,16(4):319-325.
[14]OYAIZU M.Studies on products of browning reaction-antioxidative activities of products of browning reaction prepared from glucosamine[J].The Japanese Journal of Nutrition,1986(44):307-315.
[15]CHEN Zhikun,LIANG Chengyuan,LI Weilin,et al.Study on the antioxidant activity of different extracts from Mentha canadensis L[J].Science and Technology of Food Industry,2013,34(3):100-103.
[16]SUN C,WANG J W,FANG L,et al.Free radical scavenging and antioxidant activities of EPS2,an exopolysaccharide produced by a marine filamentous fungus Keissleriella sp.YS 4108[J].Life Sci,2004,75(9):1063-1073.
[17]LI Shunfeng,ZHANG Lihua,FU Juanni,et al.Antioxidant properties of polysaccharide extracts from fruitbodies of Hypsizigus marmoreus[J].Acta Agriculturae Boreali-occidentalis Slinica,2008,17(4):302-305.
[18]LI Yong,KONG Lingqing,GAO Hong,et al.Progress on free radical and disease[J].Progress in Veterinary Medicine,2008,29(4):85-88.
Antioxidant Activity of Mycelial Extracts From Medicinal Mushrooms
QIN Mingming, GENG Yan*, LUAN Xue, ZENG Meizhen, SHAO Ruihua,CHEN Hedi, QI Peng, SHI Jinsong, XU Zhenghong
(School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China)
The antioxidant activity of mycelial extracts from medicinal mushrooms was investigated. They were from Cephalosporium sinensis,Cordyceps mortierella,Hericium erinaceum,Ganoderma lucidum and Armillaria mellea using N-hexane,chloroform,ethyl acetate and methanol,respectively. The detection of antioxidant activity was established by five methods by microtiter plates with 96 wells.Their antioxidant activities were then compared and assessed.The results showed that all the extracts could effectively scavenge·O2-.Extracts from C.mortierella and H.erinaceum had strong scavenging activity to DPPH·,showing up to 94.91%and 92.26%at 8 mg/mL,respectively.The scavenging activity to·OH of extract from G.lucidum by chloroform was up to 90%at 8 mg/mL,which was comparable to that of Vc.It was demonstrated that the antioxidant activity of these extracts from mushrooms was different from each other.More study will carry out to discuss the small active compounds with antioxidant activity in extracts.
antioxidant activity,DPPH·,·O2-,Ganoderma lucidum,Cordyceps mortierella
TS 255
A
1673—1689(2017)01—0080—07
2015-03-26
江苏省产学研联合创新资金-前瞻性联合研究项目(BY2012052);国家大学生创新创业训练立项项目 (201310295020)。
*通信作者:耿 燕(1984—),女,江苏无锡人,理学博士,副教授,主要从事天然药物筛选及分子机制研究。E-mail:gengyanjnu@163.com
秦铭铭,耿 燕,栾 雪,等.药食用真菌提取物抗氧化活性研究[J].食品与生物技术学报,2017,36(01):80-86.

