杏鲍菇多糖的超滤分离及其理化特性和生物活性分析
薛令坤, 张劲松, 唐庆九, 刘艳芳*,周 帅,杨 焱, 张 忠, 吴 迪
杏鲍菇多糖的超滤分离及其理化特性和生物活性分析
薛令坤1,2, 张劲松1, 唐庆九1, 刘艳芳*1,周 帅1,杨 焱1, 张 忠1, 吴 迪1
(1.国家食用菌工程技术研究中心/农业部南方食用菌资源利用重点实验室/上海市农业科学院食用菌研究所,上海201403;2.上海海洋大学食品学院,上海201306)
采用超滤法将杏鲍菇下脚料水提物分为不同相对分子质量范围3个部分,并对各部分样品的得率、总糖和β-葡聚糖质量分数、相对分子质量分布、单糖组成及其对巨噬细胞释放NO的影响进行了考察。结果表明,PU1得率远高于PU10和PU100,为14.6%,其总糖质量分数最高,达到62.75%。PU10和PU100中的β-葡聚糖质量分数较高,分别为18.38%和19.91%,在总糖中所占比例超过50%。相对分子质量分析结果表明,粗多糖可以按照超滤膜的截留范围实现较好的分离,且PU100和PU10均含有多个组分,其中PU100中重均相对分子质量>100 000组分约占73%,PU10中两个组分的相对分子质量均超过10 000;而PU1主要含有一个组分,其重均相对分子质量为1 110×103。超滤各部分样品中的多糖分别由4~7种单糖组成,但种类及摩尔分数具有较大差异。活性测试结果显示,超滤所得各样品均具有体外刺激巨噬细胞释放NO的活性,在低质量浓度(50 μg/mL)时PU100活性最高。
杏鲍菇下脚料;超滤;相对分子质量分布;单糖组成;巨噬细胞
杏鲍菇(Pleurotus eryngii),俗称刺芹侧耳等,具有菌肉肥厚、质地脆嫩、口感极佳的特点,同时,杏鲍菇还具有多种药用功效,是一种集食用和食疗于一体的大型食用真菌[1]。现有研究结果表明杏鲍菇多糖是其主要活性成分之一,在抗血栓、调血脂、调节免疫、抗肿瘤和抗辐射方面都具有显著的效果[2-4]。杏鲍菇下脚料是菇脚、菇片、菌柄基部等加工副产物,主要做为饲料或肥料使用,利用率不高。经研究表明,杏鲍菇下脚料营养成分与其子实体类似[5],含有丰富的多糖,因此利用下脚料来提取多糖,不仅可以降低成本,提高产品附加值,还可以节约资源,促进杏鲍菇产业多元化良性发展。
据报道,多糖的生物活性与多种因素有关,包括多糖的结构、相对分子质量、溶解度等,因此,提取纯化技术的不同,会对多糖组分的生物活性产生影响[6]。目前,对杏鲍菇多糖的提取多采用传统水提醇沉工艺,该工序繁杂、能耗高且多糖得率低,不太利于工业化应用。而超滤是一种新型膜分离技术,利用不同的孔径截留不同分子量物质,具有常温操作、无相态变化,可以防止杂菌污染和热敏性物质失活等特点[7],近年来越来越多地被用于真菌多糖的提取、分离和纯化[8-9]。作者采用3种不同截留相对分子质量的超滤膜对杏鲍菇下脚料粗多糖提取液进行分离,并对各部分样品进行分析,比较其生物活性,为杏鲍菇多糖的进一步研究和应用提供依据。
1 材料与方法
1.1 材料与试剂
杏鲍菇下脚料:上海国森生物科技有限公司提供,经低温烘干后置于干燥器中保存备用。
DMEM高糖培养基、RPMI-1640、胎牛血清(FBS)、 胰酶:Gibco公司产品; 细菌脂多糖(Lipopolysaccharide,LPS):Sigma公司产品;三氟乙酸 (TFA):Merck公司产品;RAW 264.7细胞株:购自中科院细胞所。
1.2 仪器
超滤设备为纳滤超滤反渗透一体机 (BH-UFNF-RO-3-2012):上海贝鸿生物科技有限公司产品,截留相对分子质量100 000、10 000和1 000的卷式超滤膜(型号PSI1):安得膜分离技术工程有限公司产品;冷冻干燥机:Thermo Savant公司产品;Synergy HT多功能酶标仪:Bio-Tek公司产品;CyberScan CON500台式电导仪:Eutech公司产品;ICS-2500型高效离子色谱仪:Dionex公司产品;二氧化碳培养箱:Thermo Forma公司产品;细胞计数仪:Beckman Coulter公司产品。
高效凝胶尺寸排阻色谱-多角度激光散色仪-示差折光检测仪联用分析法 (HPSEC-MALLS-RI System):由Waters2695型高效液相色谱仪,氦-氖激光光源的八角度激光光散射检测器(MALLS,Wyatt公司)和Waters 2414示差检测器(RI)组成。
1.3 方法
1.3.1 多糖提取 取杏鲍菇下脚料碎块1 000 g于蒸馏水 (料液质量体积比为1 g∶12 mL)中浸泡40 min,沸水提取2 h,提取液过滤,滤液10 000 r/min离心15 min,残渣重复上述操作再提取一次,合并两次上清液,得杏鲍菇下脚料水溶性粗多糖提取液。
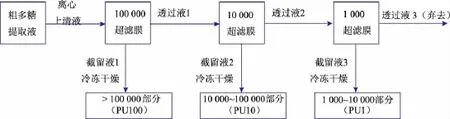
1.3.2 超滤工艺流程
串联使用截留相对分子质量分别为100 000、10 000和1 000的3个超滤膜组件,将杏鲍菇粗多糖提取液在室温、压力0.2~0.3 MPa条件下依次同时进行连续超滤处理,超滤时间3.5 h,期间加约3倍体积蒸馏水稀释>100 000截留液 (截留液1),直到透过液3电导值小于80 μs,超滤结束,得到相对分子质量段分别为>100 000(命名为PU100,下同)、10 000~100 000(PU10)、1 000~10 000(PU1)3部分截留液,经浓缩、冷冻干燥得粗多糖干品。
1.3.3 超滤各部分粗多糖得率及粗多糖中总糖和β-葡聚糖含量测定 称取粗多糖干品,加蒸馏水充分溶解,离心,采用苯酚-硫酸法测定总糖质量分数[10]。
粗多糖得率(%)=粗多糖质量(g)/称取样品质量(g)×100%
多糖中β-葡聚糖含量测定,参照Megazyme公司的酵母和蘑菇β-葡聚糖检测试剂盒中的方法对粗多糖中β-葡聚糖含量进行测定。
1.3.4 粗多糖分子量分布比较分析 采用高效凝胶尺寸排阻色谱-多角度激光光散射-示差折光检测仪联用分析技术(HPSEC-MALLS-RI)对杏鲍菇粗多糖的相对分子质量分布进行分析。称取5 mg粗多糖样品,加入1 mL流动相充分溶解,离心,上清液用0.25 μm的水相微孔膜过滤后取100 μL进样分析。具体色谱条件为:以TSK-GEL系列G6000PWXL和G4000PWXL色谱柱(7.8 mm×300 mm,TOSOH公司产品)为分析柱,以0.15 mol/L NaNO3和 0.05 mol/L NaH2PO4(pH=7,质量分数0.02%叠氮钠)为流动相,在35℃条件下,以0.5 mL/min流量进行洗脱分析。其中8角度激光光散射仪的光源波长选用623.8 nm,多糖在溶液中的折光指数增量按照0.146 mL/g计算。使用 Astra(version 6.1.1)数据分析软件对光散射数据进行采集和分析,计算相对分子质量。
1.3.5 粗多糖的单糖组成分析 分别称取2 mg粗多糖加入带盖玻璃瓶,加入3 mL 2 mol/L的三氟乙酸(TFA),110℃油浴2 h,冷却至室温,50℃氮吹仪吹干,再加3 mL甲醇并吹干,重复加甲醇2~3次至TFA完全除去,用超纯水冲洗玻璃瓶并将酸解液转移至50 mL容量瓶中,定容。
色谱条件:参考文献[11]测定超滤各部分多糖PU100、PU10、PU1的单糖组成。
1.3.6 粗多糖对RAW264.7细胞释放NO量的影响称取粗多糖5 mg加入灭菌的离心管中,用无菌的PBS配制成5 mg/mL的溶液,充分溶解,15 000 r/min离心30 min,无菌条件下将上清液转移至新的无菌eppendorf管中,然后取一定量稀释成2 mg/mL,0.5 mg/mL的质量浓度,并以10 μg/mL LPS为阳性对照,以PBS为阴性对照,按文献[12]的方法测定巨噬细胞释放NO的产量。
2 结果与分析
2.1 超滤各部分得率及其总糖和β-葡聚糖质量分数比较
由表1可知,杏鲍菇下脚料水提物经超滤分离后,粗多糖的总得率(PU100、PU10、PU1得率之和)为20.29%,其中PU1得率最高,为14.6%,占总得率的71.96%,PU10得率次之,PU100最低,仅为2.7%,说明杏鲍菇下脚料中相对分子质量小于10 000部分占较大比重,而相对分子质量大于100 000部分所占比重最小。糖质量分数测定结果表明,PU1总糖质量分数最高,为62.75%,而PU100和PU10中β-葡聚糖质量分数较高,分别为19.91%和18.38%,在总糖中所占的比例均超过50%,说明杏鲍菇下脚料中的β-葡聚糖主要富集在相对分子质量较大的粗多糖部分。

表1 超滤所得粗多糖得率及总糖和β-葡聚糖质量分数分析Table 1 Yield,total sugar and β-glucan content of crude polysaccharides obtained by ultrafiltration
2.2 粗多糖的相对分子质量分布特征分析
超滤所得杏鲍菇各部分粗多糖的相对分子质量分布如图1和表2所示。PU100主要包含3个组分,其中组分1(Peak1)和组分2(Peak2)重均相对分子质量分别为7.188×106和1.565×105,均超过1× 105,两者质量分数占总组分的73%,但两组分的多分散系数较大,表明组分1和组分2的相对分子质量分布较宽;PU10含有两个组分,其中组分 2(Peak2)重均相对分子质量为1.807×104,在10 000~ 100 000范围内,约占总组分的81.6%;而PU1只有一个组分,其重均相对分子质量为1.414×103,属于1 000~10 000的范围。此结果表明,超滤法可以按照超滤膜的截留相对分子质量范围对粗多糖进行有效分离。

图1 超滤各部分粗多糖的高效液相图谱Fig.1 HPSEC chromatograms of crude polysaccharides obtained by ultrafiltration

表2 超滤各部分粗多糖的相对分子质量分布范围Table 2 Molecular weight distributions of crude polysaccharides obtained by ultrafiltration
2.3 超滤各部分粗多糖的单糖组成
超滤不同部分杏鲍菇下脚料粗多糖经高效阴离子色谱(HPAEC)检测后所得单糖组成及摩尔百分比结果如图2和表3所示。不同相对分子质量段多糖的单糖组成种类及组成摩尔百分比差异性较大。PU100主要由葡萄糖、半乳糖、阿拉伯糖和甘露糖4种单糖组成,且葡萄糖所占摩尔分数最高,为71.12%。PU10包含的单糖种类最多,其中半乳糖和甘露糖摩尔分数较高。而PU1所含单糖种类最少,基本由葡萄糖组成,仅含少量岩藻糖、阿拉伯糖和半乳糖。
2.4 超滤各部分对体外刺激巨噬细胞释放NO产量的影响

图2 超滤各部分粗多糖的单糖组成Fig.2 Monosaccharide compositions of crude polysaccharides obtained by ultrafiltration
真菌多糖的活性依赖于一定的相对分子质量,一般认为多糖相对分子质量大于一定的范围才表现出较好的生物学活性[13]。由图3可以看出超滤所得3部分粗多糖均具有体外刺激巨噬细胞释放NO的活性。低质量浓度时(50 μg/mL)3者活性具有较大差异,PU100活性最高,PU10和PU1活性较弱;而在中等质量浓度(200 μg/mL)和高质量浓度(500 μg/mL)时,3种粗多糖活性均较好。

表3 超滤各部分粗多糖的单糖组成摩尔分数Table 3 Molar ratio of monosaccharide in crude polysaccharides obtained by ultrafiltration %

图3 超滤各部分多糖对体外刺激巨噬细胞释放NO产量的影响Fig.3 Effect of crude polysaccharides obtained by ultrafiltration on NO release from RAW264.7 cells
3 结语
真菌多糖的生物活性与其一结结构和高级构象密切相关,多糖分子在溶液中的链构象又受其分子质量的影响,一般具有100 000~200 000的高分子组分呈现较强的活性[14-15],如杨阳等[6]测得灰树花子实体多糖的活性部位主要位于100 000~1 000 000范围之间。因此将多糖按相对分子质量分段并研究各个相对分子质量段多糖的特性及药理活性是非常有意义的。杏鲍菇下脚料多糖提取液经过超滤后,可以将粗多糖按照超滤膜的截留相对分子质量范围实现较好的分离,表现为相对分子质量大于100 000组分主要位于PU100部分,相对分子质量为10 000~100 000组分主要位于PU10部分,PU1部分粗多糖相对分子质量均小于10 000。同时HPSEC测定结果也显示3部分粗多糖不能完全按照截留相对分子质量范围分离,存在部分重合,尤其是PU100和PU10部分,可能原因是多糖分子链间的相互作用或者超滤不彻底,因而其超滤工艺需要进一步研究。
超滤所得3部分粗多糖在得率、糖含量、多糖相对分子质量、单糖组成及其刺激巨噬细胞活性方面存在差异。其中PU100(>100 000)部分得率最低,但粗多糖的β-葡聚糖质量分数最高,为19.91%,且PU100在低质量浓度(50 μg/mL)时刺激巨噬细胞活性明显高于PU10和PU1,这也说明杏鲍菇多糖中大相对分子质量的部分活性较好。PU1部分得率最高,是PU100和PU10得率之和的2.56倍,说明杏鲍菇下脚料中小相对分子质量组分占较大比重。PU1单糖组成主要由葡萄糖组成,其摩尔分数为95.75%,进一步对PU1进行了分析,发现其中富含海藻糖,可能是导致其单糖组成葡萄糖摩尔分数高的原因,因而可以考虑将超滤技术作为海藻糖提取工艺的手段。
[1]YAO Z Q,LAN J.Advances in the research of Pleurotus eryngii[J].Acta Edulis Fungi,2004,11(1):52-58.
[2]CHI G R,XU L,WU J W,et al.Studies on anti-virus and anti-tumors exocellular poly-saccharides of Pleurotus eryngii[J]. Journal of Laiyang Agricultural College(Natural Science),2006,23(3):174-176.
[3]JUNG H Y,BAE I Y,LEE S Y,et al.Effect of the degree of sulfation on the physicochemical and biological properties of Pleurotus eryngii polysaccharides[J].Food Hydrocolloid,2011(25):1291-1295.
[4]CHEN J J,MAO D,YONG Y Y,et al.Hepatoprotective and hypolipidemic effects of water-soluble polysaccharidic extract ofPleurotus eryngii[J].Food Chem,2012(130):687-694
[5]ZHANG Q,LIN K,XIANG W L,et al.Optimization of polysaccharide from the residue of Pleurotus eryngii using response surface methodology[J].Journal of Xihua University:Natural Science,2014,33(2):88-92.
[6]YANG Y,LIU C C,ZHOU C Y,et al.Study on ultrafiltration separation and immunocompetence of polysaccharides from Grifola frondosa[J].Food Science,2008,29(9):277-280.
[7]YUAN X Q,GU X H,YE J,et al.Separation of aqueous extract of Momordica charantia L.Var.Abbreviata Ser.with hypoglycemic effect by ultrafiltration[J].Journal of Food Science and Biotechnology,2009,28(3):342-346.
[8]YAN J Z,LIAO Q,LI X N.Purification of polysaccharide from Poria Cocos by ultrafiltration membrane technology[J].Journal of Zhejiang University Technolugy,2013,41(2):122-125.
[9]JI L J,CHEN S C,TIAN Z B,et al.Study on microfiltration-ultrafiltration preparation technology of Coriolus versicolor polysaccharides[J].Food and Fermentation Technology,2014,50(2):27-30.
[10]ZHANG W J.Sugar complex biochemical research technology[M].Zhejiang:Zhejiang University Press,1994.
[11]YANG Y,ZHANG J S,LIU Y F,et al.Structural elucidation of a 3-O-methyl-galactose-containing neutral polysaccharide from fruiting bodies of Phellinus igniarius[J].Carbohydrate Research,2007,342:1063-1070.
[12]KIM G Y,CHOS G S,LEE S H,et al.Acidic polysaccharide isolated from Phellinus linteus enhances through the up-regulation of nitric oxide and tumor necrosis factor-alpha from peritoneal macrophages[J].Ethnopharmacol,2004,95:69-76.
[13]SUN P L,HU J R,ZHANG A Q,et al.Research advancement of β-glucan in edible and medicinal mushroom[J].Edible Fungi of China,2008,27(1):9-13.
[14]CHEN C F,YANG X T.Progresses in the studies of structure-activity correlation and detection methods of medicinal fungal β-(1,3)-D-glucans[J].Microbiology China,2006,33(5):150-153.
[15]CALAZANS G M T,LIMA R C,FRANCA F P,et al.Molecular weight and antitumor activity of Zymonaonas mobilis levans[J]. Intern J of Bio Macrom,2000,27(1):245-247.
会议消息
Physicochemical Analysis and Bioactivity Investigation of Polysaccharides Separated from Pleurotus eryngii by Ultrafiltration
XUE Lingkun1,2, ZHANG Jingsong1, TANG Qingjiu1, LIU Yanfang*1,ZHOU Shuai1, YANG Yan1, ZHANG Zhong1, WU Di1
(1.National Engineering Research Center of Edible Fungi/Key Laboratory of Edible Fungi Resources and Utilization (South),Ministry of Agriculture/Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences,Shanghai 201403,China;2.College of Food Science,Shanghai Ocean University,Shanghai 201306,China)
Three different molecular weight fractions,i.e.,100 kD(PU100),10 kD-100 kD(PU10)and 1~10 kD(PU1),were separated from the extracts of Pleurotus eryngii leftover in hot water(100℃)by membrane ultrafiltration.The physicochemical characteristics of fractions in the extracts were characterized including the product yield,the content of total sugar and β-glucan,the distribution ofmolecular weight,the composition of monosaccharide and its effects on the NO release from macrophages.PU1 showed the highest yield of 14.6%,which was much higher than that of either PU10 or PU100.The β-glucan (over 50%of β-glucan)contents of PU10 and PU100 were 18.38% and 19.91%,respectively.The crude polysaccharide could be efficiently separated by ultrafiltration membrane within the range of molecular weight as HPSEC analysis suggested.There were several fractions in both PU100 and PU10.Around 73%of PU100 was the polysaccharides with molecular weight>100 kD,while the molecular weights of two components in PU10 were larger than 10 kD and the main component in PU1 was 1.11 kD.Monosaccharide composition analysis indicated 4 and 7 monosaccharides composed the polysaccharides in different fractions with significant differences in types and molar ratios of monosaccharide.The activity of stimulating RAW264.7 macrophages to release nitric oxide (NO)was observed for all of the ultrafiltration fractions,among which PU100 represented the highest activity at low concentration(50 μg/mL).
Pleurotus eryngii leftover,ultrafiltration,the molecular weight distribution,monosaccharide composition analysis,macrophages-activation activity
Q 539
A
1673—1689(2017)01—0074—06
2015-03-27
农业部公益性行业(农业)科研专项(201303080)。
*通信作者:刘艳芳(1980—),女,山东曲阜人,副研究员,主要从事食药用菌深加工研究。E-mail:aliu-1980@163.com
薛令坤,张劲松,唐庆九,等.杏鲍菇多糖的超滤分离及其理化特性和生物活性分析[J].食品与生物技术学报,2017,36(01):74-79.

