甲状腺低分化癌3例临床病理分析
许婷婷,李 楠,谢峰梅,宋雪雪,杨茹雪,冯振中
甲状腺低分化癌(poorly differentiated thyroid carcinoma, PDTC)是指临床病理学特征介于甲状腺高分化癌(well differentiated thyroid carcinomas, WDTC)与甲状腺未分化癌(undifferentiated thyroid carcinomas, UTC)之间的滤泡源性的恶性肿瘤。1983年Sakamoto等[1]将有实性、梁状及硬化性结构的甲状腺癌命名为低分化甲状腺癌,随后Carcangiu等[2]根据肿瘤的生长方式首次提出岛状癌(insular carcinoma)。WHO(2004)甲状腺肿瘤组织学分类中正式把含有实性、岛状及梁状成分的癌称为低分化癌并单独分类,2006年《都灵提议》中的描述则更为严谨[3]。WHO(2017))甲状腺肿瘤新分类对PDTC重新诠释并采用都灵提议。本文现报道3例PDTC,探讨其临床病理学特征,旨在提高对这一亚型的认识水平。
1 材料与方法
1.1材料收集2013~2015年蚌埠医学院第一附属医院病理科存档的甲状腺手术切除标本6 245例,其中良性肿瘤1 407例(22.53%),恶性肿瘤1 329例(21.28%)。在1 329例恶性肿瘤中1 231例为甲状腺滤泡来源的恶性肿瘤,经病理科两位高级职称专家对其重新审定,确定其中3例为PDTC。本组PDTC中女性1例,男性2例;年龄61~62岁,中位年龄61岁。3例均表现为颈部甲状腺肿块并在近期逐渐增大(表1)。影像学资料及辅助检查:例1颈部MRI示颈部右侧占位,性质待定;例2细针吸取细胞学检查提示转移癌(倾向低分化癌)。例3未行辅助检查。
1.2方法标本均经10%中性福尔马林固定,取材,脱水,石蜡包埋,4 μm厚切片,HE染色,免疫组化染色采用EnVision法。所用单克隆抗体包括thyroglobulin(TGB04+TGB05)、TTF-1(SPT24)、p53(DO-7)、Ki-67(MIB-1)、CK(AE1/AE3)、vimentin(V9)、Syn(SP11)、CgA(SP12)、Calcitonin(SP17)等,一抗及EnVision试剂盒均购自福州迈新公司。
2 结果
2.1眼观例1、2为灰红色甲状腺组织,大小分别为4.5 cm×3.0 cm×2.0 cm、9.0 cm×5.5 cm×5.5 cm,切面均见灰红色结节1个,长径分别为8.0 cm、2.0 cm;其中1例局部伴坏死,坏死灶长径3.5 cm。例3甲状腺组织切面见灰红色结节1个,长径0.6 cm。
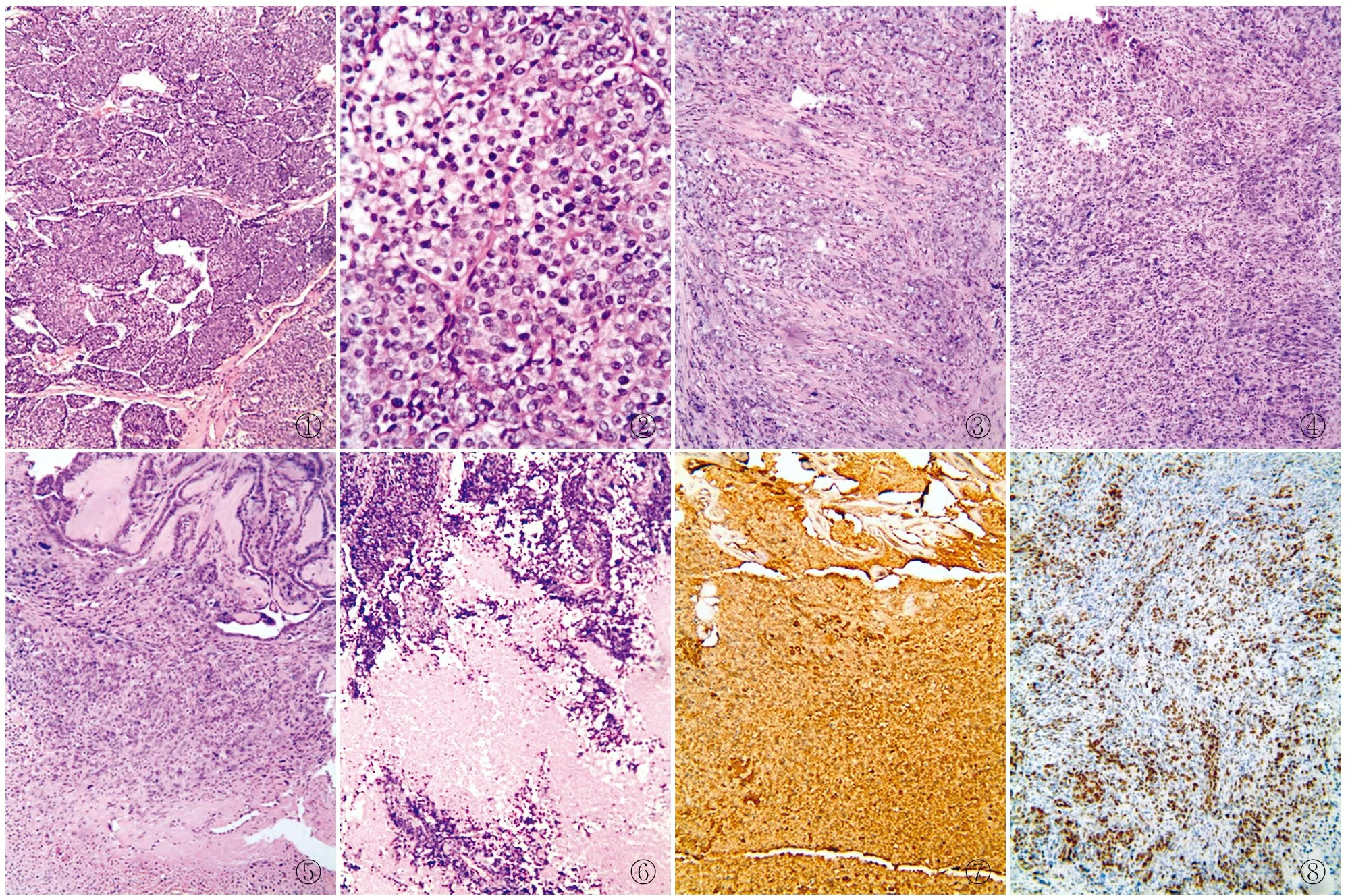
2.2镜检肿瘤呈梁状、实性或岛状生长,三种形态结构混合存在。1例主要以纤维组织分隔包绕呈岛状排列,散在分布小滤泡结构(图1),淋巴管和血管侵犯易见。其瘤细胞形态较一致,核质比高,核圆形或卵圆形,核浓染,核仁不明显,核分裂象易查见(图2)。1例主要呈小梁状生长方式,瘤细胞伸长呈束状或条索状(图3)。1例主要呈实性巢片状生长,其瘤组织呈片状,伴数量不等的纤维性间质(图4)。1例可见灶性并存的甲状腺乳头状癌成分(图5),乳头状癌成分<5%。3例核分裂象均≥3/10 HPF。2例见肿瘤性坏死(图6)。
2.3免疫表型例1:TTF-1、Tg、CD56、CK均阳性;例2:TTF-1、Tg、CD56、Syn、BCL-2均阳性,Cyclin D1强阳性;例3:TTF-1、CK(图7)、vimentin、Galectin 3、CK19、p53(图8)均阳性。3例Ki-67增殖指数分别为10%、10%和40%~50%。3例Calcitonin、CgA、MC均阴性。

表1 3例甲状腺低分化癌的临床特征
①②③④⑤⑥⑦⑧
图1瘤细胞呈岛状排列,由纤维组织分隔包绕图2瘤细胞形态一致,细胞较小,核圆形或卵圆形,胞质透亮,核分裂象≥3/10 HPF图3瘤细胞呈小梁状排列图4瘤细胞呈实性巢片状排列图5瘤组织中灶性存在甲状腺乳头状癌成分图6肿瘤性坏死
图7瘤细胞CK阳性,EnVision两步法图8瘤细胞p53阳性,EnVision两步法
2.4随访本组3例PDTC均为住院患者,2例患者随访至今无复发及远处转移,生存良好;另1例失访。
3 讨论
3.1临床特点PDTC是介于WDTC和UTC之间的恶性肿瘤,由于过去的诊断标准不统一,其确切发病率较难统计。本组中2例男性,1例女性,但多数大样本报道中,男性与女性发病率为1 ∶2,其好发于中老年人。患者一般表现为孤立的甲状腺肿物,常为多年肿物并在近期快速增大。少数患者表现吞咽不适感、声音嘶哑、皮下结节等初发症状[4]。超声表现为边界不清、回声不均匀的实性肿块。CT检查可见肿块浸润颈部周围结构。
3.2病理学特征WHO(2004)把PDTC确定为甲状腺肿瘤中独立的实体亚型。其瘤组织特征主要以实性、小梁状、岛状生长模式,伴有明显坏死和血管侵犯。瘤细胞形态均一,细胞较小,染色质浓染,核仁不清楚,核分裂象常见。2006年基于对WHO标准的诠释制定了《都灵提议》[3]。WHO(2017)采用《都灵提议》,具体诊断标准如下:(1)滤泡上皮细胞来源的恶性肿瘤;(2)实体、梁状、岛状生长模式;(3)无典型甲状腺乳头状癌的细胞核特征(毛玻璃样核、核沟、核内假包涵体);(4)至少出现以下3种形态学特征之一:肿瘤性凝固性坏死或核分裂象≥3个/10 HPF或迂曲核。迂曲核:核稍小,外形多轻度不规则,类似葡萄干样,核较一致,染色质浓染,均匀分布,无核内假包涵体,核沟罕见,其潜在的生物学意义是甲状腺乳头状癌部分去分化。坏死常为实性细胞巢或细胞岛中心境界清楚的凝固性坏死。PDTC核分裂数较高分化肿瘤增多。对于在肿瘤组织中存在最低比例的上述形态结构才能诊断PDTC,WHO(2017)甲状腺肿瘤分类未给出具体标准,以致于对PDTC诊断目前尚有争议。部分学者认为肿瘤组织出现>10%的梁状、岛状或实性区域就有意义[5],但大部分学者认为梁状、岛状或实性结构在肿瘤组织中>50%则强烈提示患者预后不良。本组分析采用WHO(2017)甲状腺肿瘤新分类及大部分学者观点(岛状、梁状或实性结构>50%)作为PDTC诊断标准,3例均诊断为PDTC。对于肿瘤组织中表现上述三种结构≤50%的甲状腺肿瘤,本次复查过程中未做具体统计。
3.3免疫表型目前尚未发现PDTC特异的免疫组化标志物,诊断PDTC主要依据组织病理学特征。PDTC的免疫组化标志物中Tg、TTF-1、Galectin 3、CK、p53常呈阳性,CK19部分阳性;CT、CgA、Syn常呈阴性;少数病例CgA、Syn弱阳性。PDTC与WDTC相比,Tg和TTF-1阳性水平降低。有文献报道,PDTC中广谱CK阳性率可达100%。p53标记恶变中的甲状腺癌,在WDTC中p53常为阴性。CK19、Galectin 3主要用于标记甲状腺乳头状癌,但在甲状腺滤泡状癌和PDTC中也可表达。PDTC瘤细胞的高增殖率可通过免疫组化Ki-67来证实,但有文献报道在两组按照都灵标准诊断的PDTC患者中评估Ki-67增殖指数,一组增殖指数为13%(3%~40%),另一组Ki-67增殖指数确为3.7%(2%~10.7%)[6-7]。说明并不是所有PDTC的Ki-67都有较高增殖指数,诊断PDTC主要依据不是细胞分裂活跃程度而是肿瘤性坏死。与正常甲状腺及WDTC相比,PDTC中Cyclin D1表达升高,这可能提示Cyclin D1与PDTC的发生有重要关联。本组3例PDTC中1例Galectin 3、CK19、p53均呈阳性,这可能与甲状腺乳头状癌部分去分化有关;CT均阴性充分证明PDTC来源于滤泡上皮,符合PDTC特征。
3.4遗传学PDTC的发病因素尚不明确,可能有3种机制:(1)滤泡癌部分去分化;(2)乳头状癌部分去分化;(3)不经过WDTC阶段。甲状腺癌的DNA相关标志物包括BRAF、Ras、Pax-8/PPARγ和RET/PTC等[8]。在PDTC中体细胞突变分为两组。一组:BRAF和Ras突变。一组:发生于低分化癌和间变性癌,不见于WDTC的TP53和β-catenin(CTNNB1)突变。克隆性RET/PTC和Pax-8/PPARγ重排却很少见于PDTC,提示致癌基因不能产生促进肿瘤去分化的“分子环境”。Ras基因的突变与预后有关。
3.5诊断及鉴别诊断由于PDTC罕见,且无特异性临床表现,诊断主要依据病理学检查,需与以下疾病鉴别:(1)髓样癌:两者均有实性、岛状生长方式并缺乏腔内胶样物。部分甲状腺髓样癌由于细胞之间的挤压,细胞间和细胞质内的淀粉样物不明显,这与岛状癌更难鉴别,但甲状腺髓样癌核质比与核分裂象低于PDTC,坏死罕见。免疫表型:髓样癌Tg阴性,CT、CgA、Syn、CEA均阳性。(2)广泛侵袭性滤泡癌:由于缺乏乳头状癌核特征与低分化癌很难鉴别,滤泡癌肿瘤性坏死不明显,核分裂象低于PDTC。免疫表型:甲状腺滤泡状癌除Tg、TTF-1阳性外,多数低分子量CK及E-cadherin阳性。(3)乳头状癌实体亚型:肿瘤实体或梁状区域>50%肿瘤成分,可有鳞状化生,但具有乳头状癌典型核特征。(4)未分化癌:瘤细胞的大小和形态呈多形性(圆形、梭形或卵圆形)并见瘤巨细胞。其细胞及细胞核较PDTC大,核分裂高于PDTC。免疫表型:CK呈局灶阳性,Tg、TTF-1常呈阴性,Ki-67增殖指数50%~60%。(5)甲状腺转移癌:免疫组化显示Tg在正常滤泡细胞和腔内胶样物均可表达,具有较高的组织特异性。可以根据免疫组化Tg阳性进行鉴别。
3.6治疗及预后近年报道PDTC患者的生存时间平均为5.9年,5年及10年生存率为45%~62%[9]和46.3%[6],明显低于WDTC患者。PDTC易复发和远处转移,肺和脑为常见的转移部位[10],骨和肝也可发生转移,有文献报道少数病例在卵巢、皮肤出现转移病灶[11-12]。肿瘤的治疗措施至今尚未标准化。甲状腺全切+淋巴结清扫术是首选。手术后外照射和放射性碘治疗作用尚未明确。抑制BRAF激酶的靶向性治疗及TP53基因治疗,可能成为一种有前景的治疗方案。
[1] Sakamoto A, Kasai N, Sugano H. Poorly differentiated carcinoma of the thyroid: a clinicopathologic entity for a high-risk group of papillary and follicular carcinomas[J]. Cancer, 1983,52(10):1849-1855.
[2] Carcangiu M L, Zampi G, Rosai J. Poorly differentiated (“insular”) thyroid carcinoma:a reinterpretation of Langhans “wuchernde Struma”[J]. Am J Surg Pathol, 1984,8(9):655-688.
[3] Volante M, Collini P, Nikiforov Y E,etal. Poorly differentiated thyroid carcinoma: the turin proposal for the use of uniform diagnostic criteria and an algorithmic diagnostic approach[J]. Am J Surg Pathol, 2007,31(8):1256-1264.
[4] Yaghoobi R, Ranjbari N, Derakhshandeh V,etal. Skin metastasis as the initial manaifestation of poorly differentiated thyroid carcinoma[J]. Acta Dermatovenerol Croat, 2014,22(3):218-220.
[5] Ibrahimpasic T, Ghossein R, Carlson D L,etal. Outcomes in patients with poorly differentiated thyroid carcinoma[J]. J Clin Endocrinol Metab, 2014,99(4):1245-1252.
[6] Asioli S, Erickson L A, Righi A,etal. Poorly differentiated carcinoma of the thyroid: validation of the Turin proposal and analysis of IMP3 expression[J]. Mod Pathol, 2010,23(9):1269-1278.
[7] Gnemmi V, Renaud F, Do Cao C,etal. Poorly differentiated thyroid carcinomas: application of the Turin proposal provides prognostic results similar to those from the assessment of high-grade features[J]. Histopathology, 2014,64(2):263-273.
[8] 周 元, 蒋红钢, 李 克. 甲状腺癌分子标志物研究进展[J]. 临床与实验病理学杂志, 2015,31(5):565-568.
[9] 李 媛, 霍 真, 陈 杰. 甲状腺癌病理诊断中的若干问题[J]. 中华病理学杂志, 2014,43(5):348-352.
[10] Phay L E, Ringel M D. Metastatic mechanisms in follicular cell-derived thyroid cancer[J]. Endocr Relat Cancer, 2013,20(6):307-319.
[11] Sabih Q, Spafford M F, Dietl C A. Poorly differentiated thyroid carcinoma with sternal invasion. A case report and review of the literature[J]. Int J Surg Case Rep, 2014,5(11):816-820.
[12] Ling M, Wong T, Bui C D,etal. Tumor within another tumor : an unusual case of metastatic poorly differentiated thyroid carcinoma within an intracranial meningioma[J]. J Clin Endocrinol Metab, 2014,99(10):3513-3514.

