肱骨奇异性骨旁骨软骨瘤样增生及相关病变临床、病理、影像特点对比分析
杨 直,吴婺松,张洪生,刘碧英,黄培生
奇异性骨旁骨软骨瘤样增生(bizarre parosteal osteochondrornatous proliferation, BPOP),又称Nora病,主要由骨、纤维组织和钙化软骨混杂排列而成。其中钙化的软骨即“蓝骨”是诊断BPOP的特征性标志,因软骨细胞具有轻度的异型性,故称之为“奇异性”[1],该病罕见,易误诊,现结合发生于肱骨的类似病变进行临床、病理、影像特点对比分析,以期对BPOP有更深入的认识。
1 材料与方法
1.1临床资料收集2014~2017年福建中医药大学附属人民医院病理科1例右肱骨BPOP、1例左肱骨骨软骨瘤及2015年福州市第二医院病理科1例右肱骨软骨肉瘤的临床、病理、影像资料并随访。病理切片均经两名副主任医师阅片确诊。
1.2方法所有标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚切片及常规HE染色,镜下观察。
2 结果
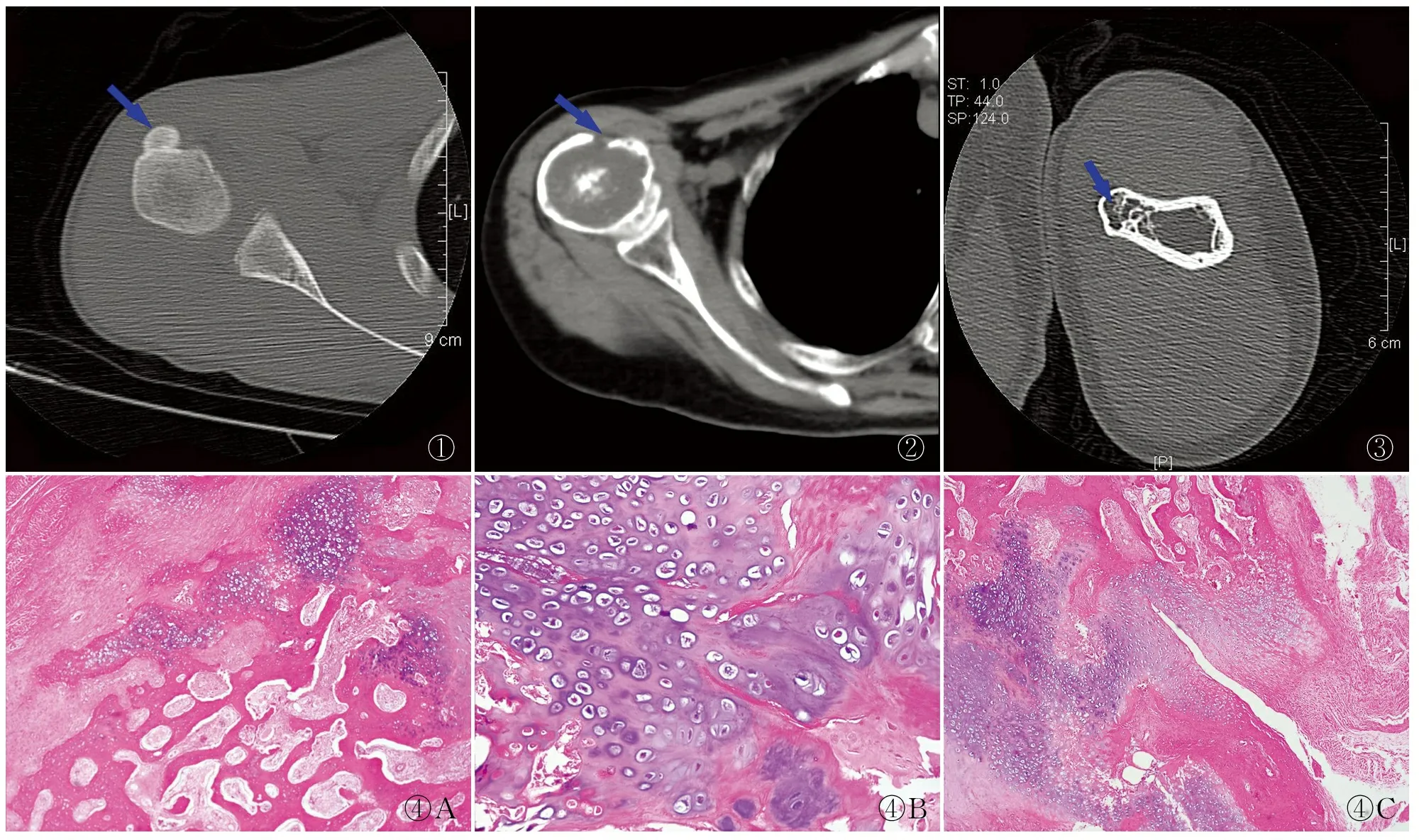
2.1临床及影像学特征例1男性,12岁,发现右上臂近端内侧肿物3个月,右上臂无明显疼痛,X线检查示右肱骨上段外侧缘见一不规则条片状高密度影,边缘清晰,未见明显骨质吸收、破坏;CT示右肱骨中上段骨质膨胀,内侧局部骨质向外突出,局部骨皮质稍变薄,病灶背离关节生长(图1),周围软组织未见异常。例2女性,69岁,右上臂疼痛半年加剧半个月,X线示右肱骨中上段见多发不规则透亮区及斑片状增生硬化影,骨皮质厚薄不均,上段皮质不连;CT及MRI示右肱骨中上段骨质不规则形缺损,病灶呈溶骨性骨质破坏,其内见散在骨碎片(图2),MRI髓腔内见大片稍长T1明显长T2信号,部分呈斑片状短T1短T2信号。例3男性,36岁,发现左上臂肿物10年,局部无压痛,CT示左肱骨中上段骨质膨胀,内侧局部骨质向外突出,病灶呈背离关节生长,髓腔通入性改变(图3),周围软组织未见明显异常;MRI示左肱骨中上段内侧局部骨质向外隆起,基底部骨皮质与母干相连续,病灶背离关节生长。
2.2病理学特征3例均手术完整切除病灶,例1大体见长条形骨组织一块,灰黄色,大小5.0 cm×2.0 cm×1.5 cm,切面灰黄色,质地较硬;镜下见骨旁病变由编织骨、钙化性软骨和纤维组织混合组成,三者排列紊乱无序,无分层结构(图4A),软骨细胞呈巢、片状分布,轻度异型性,密集、核大、深染,并见有特征性“蓝骨”(图4B),瘤细胞穿插生长及软骨化骨(图4C)。例2大体见肱骨上段组织大小17.0 cm×3.5 cm×3.5 cm,上段膨大,肱骨头尚存在,临床已部分纵向切开,肿物位于肱骨上段及干骺端,长约12 cm,髓腔破坏,局部骨皮质不连续,切面部分灰白半透明;镜下见蓝灰色软骨基质中见成簇聚集瘤细胞,细胞密度中等,大小较一致,细胞核轻度异型,可见双核。例3大体见不规则骨组织一块,大小3.2 cm×1.5 cm×1.0 cm,表面见一隆起,大小1.3 cm×1.2 cm×1.0 cm;镜下见肿瘤由软骨膜、软骨及骨组成,分层结构明显,外层为纤维性软骨膜、软骨帽,软骨细胞无异型性,与骨交界处可见软骨化骨现象。
2.3病理诊断例1右肱骨BPOP;例2右肱骨软骨肉瘤Ⅰ级;例3左肱骨骨软骨瘤。
2.4随访右肱骨BPOP、右肱骨软骨肉瘤、左肱骨骨软骨瘤分别随访2、17、37个月,均无瘤生存,未见肿瘤复发、转移。
3 讨论
BPOP、骨软骨瘤及软骨肉瘤病程不一,软骨肉瘤最短,骨软骨瘤最长,临床表现除软骨肉瘤患者有剧烈疼痛外,前两者均无明显临床症状,均经手术完整切除,术后随访患者均无瘤生存,无肿瘤复发及转移,三者主要通过病理及影像特点鉴别。
BPOP或Nora病最初由Nora等[2]于1983年命名并报道35例均发生于手足短小管状骨中,随后Meneses等[3]报道65例中19例发生于手足以外部位,其中36例手部,10例足部,17例长骨(其中6例尺骨、3例桡骨、3例股骨、2例腓骨、2例胫骨、1例肱骨),1例头颅骨,1例未知部位。女性34例,男性31例,男女比例无明显差异,年龄8~73岁(中位年龄33.9岁),认为BPOP发生机制是因软组织出现骨细胞并形成新生骨组织的异位骨化现象。1/3病例有外伤史[4],往往表现为无痛性、缓慢生长的肿块[5]。最近Rushing等[6]报道1例足后跟BPOP,患者出现明显足部疼痛。
BPOP是一类少见的易误诊的良性肿瘤,作出病理诊断具有挑战性,组织学上具有独特的特点,镜下由编织骨、钙化性软骨和纤维组织三种成分混合组成,无序排列。软骨常钙化或骨化,软骨和骨之间有不规则连接,不成熟骨及间质梭形细胞无不典型性[2-3],偶尔可见软骨帽但不伴骨结构破坏,需与骨软骨瘤鉴别,骨软骨瘤分层结构明显,细胞不出现异型性,而诊断BPOP的挑战性在于其常出现奇异性软骨细胞,主要表现在核增大、并出现双核,需注意的是,尤其当肿瘤细胞在编织骨及纤维组织中穿插生长时,极易让人误诊为恶性,特别要与低级别软骨肉瘤鉴别,后者瘤细胞具有类似的异型性,但通常有丰富的灰蓝色软骨黏液样基质及大小形状不规则的软骨小叶,这些小叶被纤维性条索或渗透于其中的骨小梁分隔[7],BPOP另一诊断要点是具有特征性的“蓝骨”,而在骨软骨瘤及软骨肉瘤中无此特征。有学者通过Saranin O染色证实显微镜下的“蓝骨”实际是一种特殊形态的钙化软骨[8]。
①②③④A④B④C
图1例1奇异性骨旁骨软骨瘤样增生:CT示右肱骨中上段内侧局部骨质向外突出,病灶背离关节生长,与髓腔不相连图2例2软骨肉瘤:CT示右肱骨中上段骨质不规则形缺损,病灶呈溶骨性骨质破坏,其内可见散在骨碎片图3例3骨软骨瘤:CT示左肱骨中上段骨质膨胀,内侧局部骨质向外突出,病灶呈背离关节生长,髓腔通入性改变图4例1奇异性骨旁骨软骨瘤样增生:A.骨旁病变由编织骨、钙化性软骨和纤维组织混合组成;B.瘤细胞呈巢、片状分布,轻度异型性,密集、核大、深染及特征性“蓝骨”;C.瘤细胞穿插生长及软骨化骨
影像学对BPOP的诊断与鉴别诊断十分重要,BPOP的X线表现均为骨旁的、在母骨骨皮质表面上突起的钙化骨化阴影,CT示病灶位于骨表面,环绕骨皮质生长,无骨皮质破坏,病灶与附着骨之间一般无髓腔相通,少数病例与附着骨存在骨性粘连,甚至与骨髓腔相连[9-10]。而骨软骨瘤好发长骨干骺端,特征性结构是与基底骨的骨小梁相延续的骨皮质突出物,CT或MRI的典型表现是髓腔通入性改变,此点与BPOP不同。影像学上软骨肉瘤与前两者有显著差异,具有恶性肿瘤的浸润特点,病灶呈溶骨性骨质破坏,其内可见散在骨碎片,边缘可见扇贝状分叶,骨皮质呈不规则形缺损,病变区内均可见散在分布的弓环状、点状、斑块状高密度钙化影[11],“弧形钙化”常常是软骨肉瘤的特征性改变,可压迫骨内膜呈扇形压迹[12],常见周围软组织侵犯[13],通过影像特点比较容易将BPOP与软骨肉瘤区分开。
值得讨论的是BPOP是肿瘤还是增生成为争议的焦点,细胞遗传学也证实了该病与t(1;17)(q32;q21)或t(1;17)(q42;q23)基因重排有关[1],提示其为真性肿瘤。有报道提出BPOP伴inv(7)(q22q32)而无t(1;17)易位,是BPOP发病的另一细胞遗传学基础,该基因异常可能与临床病理表现的差异相关,这类基因异常的BPOP病例中观察到骨皮质与髓质相连续,是BPOP一种少见的特点[14],而在t(1,17)易位病例中无该特点的相关报道,inv(7)(q22q32)而无t(1;17)易位时还可同时伴有inv(6)(p25q15)[15-16]的细胞遗传学异常。
骨软骨瘤是一种发育紊乱还是真性肿瘤争论已久,散发或遗传病例中发现细胞遗传学异常涉及8q22-24.1,定位于EXT1基因,遗传性骨软骨瘤病多数突变位点位于EXT1或EXT2,导致产生缩短或无功能蛋白,约80%散发骨软骨瘤的软骨帽部分EXT1纯合子缺失[7],提示骨软骨瘤为真性肿瘤。
Zhou等[17]通过注释、可视化和整合发现数据库(Database for Annotation, Visualization, and Integrated Discovery, DAVID)分析发现BPOP和骨软骨瘤间存在不同的基因调节机制,包括转录生长因子β受体信号通路、BMP信号通路、Wnt受体信号通路、化学刺激反应、炎症反应的调节、应激反应、黏多糖结合域、多聚糖结合域、细胞外基质成分及生长因子结合域等差异。并且环境因素和炎症刺激可促进两者的发生,不同的细胞外基质可影响两者产生不同的生物学行为。
软骨肉瘤是明确的恶性肿瘤,原发(38%~70%)及继发(86%)性中央型软骨肉瘤和周围型软骨肉瘤(100%)出现IDH1和IDH2突变[13]。Chen等[18]发现软骨肉瘤中存在H3F3A或H3F3B基因K36M突变。
BPOP、骨软骨瘤及软骨肉瘤均可通过手术完整切除治疗,Meneses等[3]报道65例BPOP,随访40例,复发率达55%,但未见转移,本例BPOP术后随访2个月,未见复发,对其长期预后还需进一步观察。总之,BPOP作为一种罕见的良性病变,常易误诊,主要通过结合病理、影像及临床表现进行诊断与鉴别诊断,认真区别BPOP、骨软骨瘤及软骨肉瘤的临床、影像及组织学特点对避免误诊很重要,不易诊断病例可借助细胞遗传学帮助明确诊断。
[1] 夏 燕, 吴玲玲, 封 扬, 等. 奇异性骨旁骨软骨瘤样增生5例临床病理学分析[J]. 临床与实验病理学杂志, 2016,32(9):1033-1036.
[2] Nora F E, Dahlin D C, Beabout J W. Bizarre parosteal osteochondromatous proliferations of the hands and feet[J]. Am J Surg Pathol, 1983,7(3):245-250.
[3] Meneses M F, Unni K K, Swee R G. Bizarre parosteal osteochondromatous proliferation of bone (Nora’s lesion)[J]. Am J Surg Pathol, 1993,17(7):691-697.
[4] Flint J H, Mckay P L. Bizarre parosteal osteochondromatous proliferation and periosteal chondroma: a comparative report and review of the literature[J]. J Hand Surg Am, 2007,32(6):893-898.
[5] Ting B L, Jupiter J B. Recurrent bizarre parosteal osteochondromatous proliferation of the ulna with erosion of the adjacent radius: case report[J]. J Hand Surg Am, 2013,38(12):2381-2386.
[6] Rushing C J, Rogers D E, Spinner S M,etal. A case report of heel pain mimicking plantar fasciitis and osteosarcoma: a unique presentation of a Nora's lesion[J]. Foot Ankle Surg, 2017,56(3):670-673.
[7] Fletcher C D M, Bridge J A, Hogendoom P C W,etal. World Health Organization classification of tumous. Pathology and genetics of turnouts of soft tissue and bone[M]. Lyon: IARC Press, 2013:247-250.
[8] Sakamoto A, Imamura S, Matsumoto Y,etal. Bizarre parosteal osteochondromatous proliferation with an inversion of chromosome 7[J]. Skeletal Radiol, 2011,40(11):1487-1490.
[9] Berber O, Dawson-Bowling S, Jalgaonkar A,etal. Bizarre parosteal osteochondromatous proliferation of bone: clinical management of a series of 22 cases[J]. Bone J Surg Br, 2011,93(8):1118-1121.
[10] Rybak L D, Abramovici L, Kenan S,etal. Cortico-medullary continuity in bizarre parosteal osteochondromatousproliferation mimicking osteochondroma on imaging[J]. Skeletal Radiol, 2007,36(9):829-834.
[11] 李 军, 李耀光, 刘亚丽, 牛邵瑜. 原发性软骨肉瘤的CT表现与病理关系[J]. 实用医学影像杂志, 2010,11(6):369-371.
[12] Murphy M D, Walker E A, Wilon A J,etal. From the archives of the AFIP: imaging of primary chondrosarcoma: radiologic-pathologic correlation[J]. Radiographics, 2003,23(5):1245-1278.
[13] Fletcher C D M, Bridge J A, Hogendoom P C W,etal. World Health Organization classification of tumous. Pathology and genetics of turnouts of soft tissue and bone[M]. Lyon: IARC Press, 2013:266-267.
[14] Zambrano E, Nosé V, Perez-Atayde A R,etal. Distinct chromosomal rearrangements in subungual (Dupuytren) exostosis and bizarre parosteal osteochondromatous proliferation (Nora lesion)[J]. Am Surg Pathol, 2004,28(8):1033-1039.
[15] Joseph J, Ritchie D, Macduff E, Mahendra A. Bizarre parosteal osteochondromatous proliferation: a locally aggressive benign tumor[J]. Clin Orthop Relat Res, 2011,469(7):2019-2027.
[16] Teoh K H, Shortt N, Wilkinson G,etal. Bizarre parosteal osteochondromatous proliferation of the metatarsal:a pediatric case report and archival review[J]. Foot Ankle Surg, 2009,48(6):690e7-690e11.
[17] Zhou X, Deng L, Han X,etal. Differences in molecular regulation between osteochondroma and bizarre parostealosteochondromatous proliferation[J]. Mol Med Rep, 2017,16(1):801-805.
[18] Chen W, DiFrancesco L M. Chondroblastoma: an update[J]. Arch Pathol Lab Med, 2017,141(6):867-871.

