花椒属环八肽Zanriorb A1的固相合成*
吴 也,凌保东,2,宋 丽,莫金秋,廖洪利,2△
1.成都医学院 药学院(成都 610083);2.四川省高校结构特异性小分子药物重点实验室(成都 610083)
花椒属环八肽Zanriorb A1的固相合成*
吴 也1,凌保东1,2,宋 丽1,莫金秋1,廖洪利1,2△
1.成都医学院 药学院(成都 610083);2.四川省高校结构特异性小分子药物重点实验室(成都 610083)
目的 合成能够诱导T淋巴细胞白血病Jurkat细胞凋亡的花椒属环八肽Zanriorb A1。 方法 通过9-芴甲氧羰基(Fmoc)固相合成法,以2-氯三苯基氯树脂(CTC)为载体,Fmoc-Gly-OH为起始原料,N,N-二异丙基乙胺(DIEA)/6-氯苯并三氮唑-1,1,3,3-四甲基脲六氟磷酸酯(HCTU)为缩合体系,在液相经1-羟基苯并三氮唑(HOBt)/苯并三唑-1-基氧三吡咯烷基六氟磷酸(PyBOP)/DIEA实现环合,所得化合物通过RP-HPLC、MS等光谱表征。 结果 通过本法顺利得到纯度>98%的花椒属环八肽Zanriorb A1,总收率为48%。 结论 该合成方法具有可行性,操作简单,总收率高,目标化合物可用于抗Jurkat细胞的药物研究。
Zanriorb A1;花椒属;Jurkat细胞;固相合成;环肽
芸香科花椒属,分布于热带和亚热带地区,有250多个种类。该类植物的树叶和树皮化学成分主要包括生物碱、酰胺、香豆素、木酚素及萜类等化合物[1],具有消炎[2]、镇痛[3]、解痉[4]和驱虫[5]等药理活性。Dos等[6]从花椒属riedelianume的枯叶中分离得到一种新型环八肽Zanriorb A1,其能诱导T淋巴细胞白血病Jurkat细胞的凋亡(IC50 218 nM),这是继柑橘属[7]、吴茱萸属[8]和黄皮属[9]之后,又一个芸香科中具有生物活性的环肽,随着环肽的重新定义[10],这一类分子正逐渐成为有前景的药物研发途径。
Zanriorb A1由8个氨基酸残基构成,结构为:Cyclic[Gly-Phe-Phe-Pro-Pro-Gly-Phe-Gly](图 1),相对分子质量为806.38 Da。国内外关于Zanriorb A1的化学合成未见文献报道,本研究旨在通过Fmoc固相合成法,获得目标产物,为其进一步的药物开发提供原料,以及规模化制备提供参考。
1 材料与方法
1.1 主要仪器与试剂
仪器:气浴恒温振荡器(常州国宇仪器制造有限公司);低温冷却循环泵(上海东玺制冷仪器设备有限公司);LC-6A制备液相色谱仪、Prominence LC-20AD高效液相色谱仪(日本岛津公司);6538 UHD Accurate Mass Q-TOF LC/MS质谱仪(美国Agilent公司)。试剂:Fmoc-Gly-OH(甘氨酸)、Fmoc-Phe-OH(苯丙氨酸)、Fmoc-Pro-OH(脯氨酸)、2-氯三苯基氯树脂、6-氯苯并三氮唑-1,1,3,3-四甲基脲六氟磷酸酯(HCTU)(上海吉尔生化有限公司);N,N-二异丙基乙胺(DIEA)、1-羟基苯并三氮唑(HOBt)、苯并三唑-1-基氧三吡咯烷基六氟磷酸(PyBOP)、三氟乙酸(TFA),乙腈(色谱纯)(北京百灵威科技有限公司);茚三酮、N,N-二甲基甲酰胺(DMF)、二氯甲烷(DCM)、哌啶、甲醇均为分析纯(国药集团化学试剂北京有限公司)。
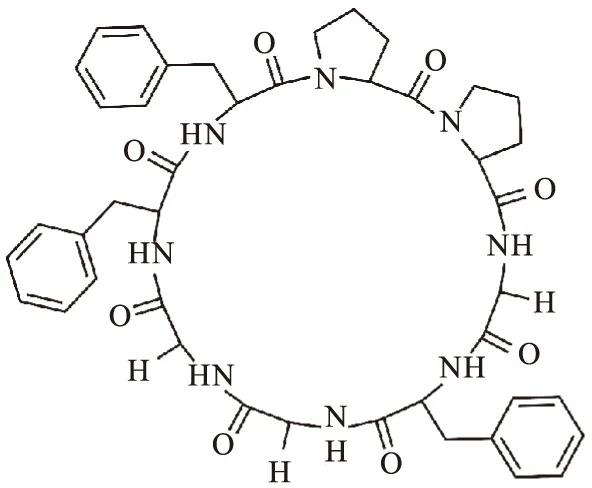
图1 Zanriorb A1的化学结构式
1.2 方法
1.2.1 Zanriorb A1的直链合成 本研究首先合成Zanriorb A1的前体直链肽(图2)。取2-氯三苯基氯树脂500 mg(载样量为0.20 mmol/g)加入到固相合成反应管中,用DCM浸泡20 min使树脂充分溶胀,抽干待用。将Fmoc-Gly-OH(297 mg,1 mmol)和DIEA(365.0 μL,2 mmol)混溶于7 mL DMF,加入到树脂中摇晃3 h,依次用DCM、DMF洗涤树脂各3次,然后加入7 mL MeOH反应20 min,封闭未反应的树脂。树脂洗净后,加入20 %哌啶-DMF溶液10 mL,振荡10 min×2脱去Gly上的Fmoc保护基,依次用DCM、DMF洗涤树脂各3次。随后根据多肽序列将Fmoc-氨基酸(1 mmol)、HCTU(0.9 mmol)和DIEA(2 mmol)混溶于7 mL DMF,加入到树脂中,分别振荡1 h,重复脱保护→缩合→脱保护的操作步骤,依次偶联Fmoc-Phe-OH、Fmoc-Phe-OH、Fmoc-Pro-OH、Fmoc-Pro-OH、Fmoc-Gly-OH、Fmoc-Phe-OH、Fmoc-Gly-OH,直到所有氨基酸连接完成。缩合反应中通过Kaiser试剂(茚三酮定性显色)监测反应进程。

图2 Zanriorb A1的合成路线
1.2.2 直链肽的游离 直链完成后,将树脂洗净抽干,加入TFA∶DCM =1∶1(V/V)15 mL,室温振荡1 h,使直链肽与树脂分离,过滤,用少许TFA洗涤树脂,减压浓缩滤液得直链肽粗品,对其进行HR-Q-TOF-MS(高分辨基质辅助激光解吸电离飞行时间质谱)测试。
1.2.3 液相环合 将HOBt(5 eq)、PyBOP(5 eq)、DIEA(10 eq)和DMF(1 mL)溶于适量DCM中,氩气置换3遍,于0 ℃缓慢滴入直链肽的DCM溶液,使得肽液的最终浓度为0.5 mg/mL。滴毕自然升至室温搅拌,1 h后浓缩反应液即得Zanriorb A1粗品。
1.2.4 Zanriorb A1的分离纯化和质谱鉴定 将粗肽用甲醇溶解,通过制备型反相高效液相色谱仪(RP-HPLC)纯化。制备柱色谱条件:Grace Vydac “Peptide C18”柱(250×10 mM,10 μM);检测波长214 nm;流动相A为0.1% TFA乙腈溶液,流动相B为0.1% TFA水溶液,梯度洗脱(0~40 min,流动相B:90%~0%);流速4.0 mL/min。制备过程中收集主峰,冷冻干燥后即得目标产物,然后对Zanriorb A1纯品进行HPLC分析和HR-Q-TOF-MS鉴定。
2 结果
2.1 Zanriorb A1纯品的分析
所得Zanriorb A1纯品39 mg,状态为白色粉末,总收率为48%。采用RP-HPLC对其进行纯度和含量的测定,并对液相流出曲线中的色谱峰面积定量积分。结果显示:除去5 min以前的溶剂峰,另外3个色谱峰的保留时间分别为17.422、20.734和21.799 min,峰面积比分别为0.434%、98.979%和0.595%(图3、表1),故样品纯度>98%。HPLC分析条件:分析柱:Grace Vydac “Protein & Peptide C18”(250 × 4.6 mM, 5 μM);检测波长214 nm;流动相A为0.1% TFA乙腈溶液,流动相B为0.1% TFA水溶液,梯度洗脱(0~35 min,流动相B:90%~0%);流速1.0 mL/min;柱温30 ℃,进样量20 μL。

>图3 Zanriorb A1纯品的HPLC图
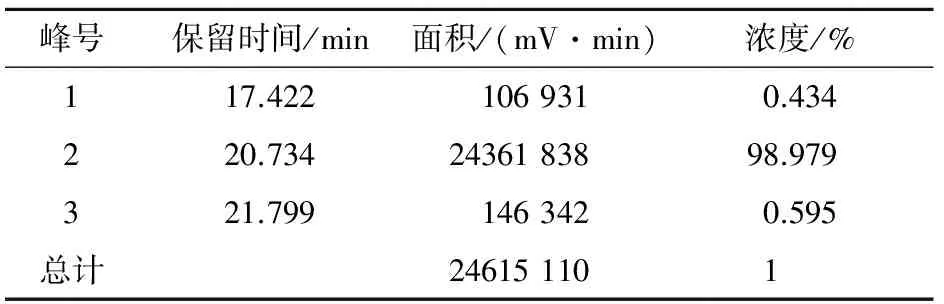
表1 Zanriorb A1纯品的HPLC定量分析
2.2 Zanriorb A1环合前后的质谱分析
经HR-Q-TOF-MS鉴定,环合前的Zanriorb A1直链肽的理论分子量为[M+H]+=825.39,[M+Na]+=847.39,实际分子离子峰为[M+H]+=825.3946,[M+Na]+=847.3766(图4),理论分子量和实际分子量相差在正负1之间,故可认为所合成的Zanriorb A1直链肽正确。同理,环合后化合物脱去一分子水,分子量减少18,计算终产物理论分子量为[M+H]+=807.38,而上述所测纯度>98%的Zanriorb A1纯品质谱实际观测值为[M+H]+=807.3836(图5),与理论值相符,说明所得即为Zanriorb A1。
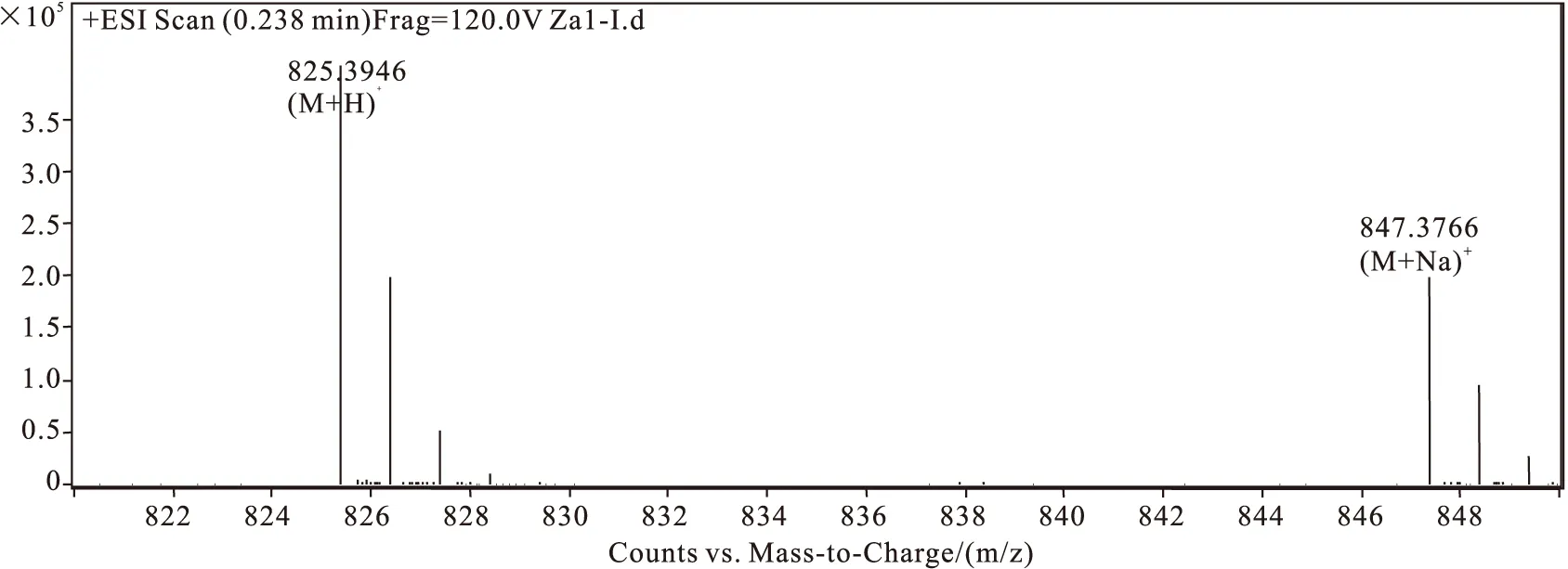
图4 Zanriorb A1直链肽的HR-Q-TOF-MS图

图5 Zanriorb A1纯品的HR-Q-TOF-MS图
3 讨论
以富集脯氨酸为代表的生物活性环肽可以作为一种潜在的新型抗肿瘤候选药物,研究[11-12]发现,脯氨酸基团在定义环肽构象和提供细胞毒机制方面有着重要的意义,这类化合物能够直接作用于Jurkat细胞的细胞膜,使细胞发生凋亡。Zanriorb A1是该类细胞毒性和凋亡活性较高的新型环肽,但由于自然界中花椒属riedelianume体内含有的Zanriorb A1非常少(3 kgriedelianume枯叶中仅分离得到16 mg的Zanriorb A1[6]),且成分复杂,如何提取分离成为研究Zanriorb A1前期必须解决的一道难题。
本研究首次采用Fmoc多肽固相合成法,对Zanriorb A1的全合成进行了研究。在Zanriorb A1的序列中,苯丙氨酸和脯氨酸所在位置均是环合位阻较大的位点,而2个甘氨酸之间位阻最小,更加容易环合;并且选用没有光学活性的甘氨酸为C端残基,能够减小多肽合成中消旋的风险,提高合成产率。Zanriorb A1的合成载体采用了CTC树脂。该树脂满足以下条件:负载在其上的多肽分子切割后可直接生成端基为羧基的多肽,符合环肽的合成需要;甘氨酸、脯氨酸、半胱氨酸和丝氨酸等如果处在C端第1位或第2位时,发生分子内胺解环化的倾向极强,继而导致载体的连接基团发生断裂,肽链合成无法继续进行,而CTC树脂结构上的位阻效应可以避免这种情况的发生[13];以CTC树脂作为载体,省时省力,经济实惠,适合工业化生产。 氨基酸缩合常用的体系有DCC-HOBt、DIC-HOBt、TBTU-DIEA、HATU-DIEA、HCTU-DIEA、PyAOP-HOAt-DIEA和PyBOP-HOBt-DIEA等。其中HCTU和PyBOP体系缩合效率高,反应速度快,不易发生消旋,且廉价易得,有潜在的工业应用价值,故在本研究直链合成的过程中选择HCTU-DIEA,环合反应的关键步骤优选PyBOP-HOBt-DIEA为缩合试剂,并且取得了良好的效果。
综上所述,在本研究的合成工艺下,所得Zanriorb A1纯度>98%,总收率为48%。其结构经质谱确证,合成方法简单易行,反应条件温和,总收率高,合成得到的目标化合物为其进一步的药理学、药效学研究提供原料,并为其规模化生产提供参考。
[1]孙小文, 段志兴. 花椒属药用植物研究进展[J]. 药学学报, 1996, 31(3): 231-240.
[2]Chen J J, Wang T Y, Hwang T L. Neolignans, a coumarinolignan, lignan derivatives, and a chromene: anti-inflammatory constituents from Zanthoxylum avicennae[J]. J Nat Prod, 2008, 71(2): 212-217.
[3]Lima L M, Perazzo F F, Tavares Carvalho J C,etal. Anti-inflammatory and analgesic activities of the ethanolic extracts from Zanthoxylum riedelianum (Rutaceae) leaves and stem bark[J]. J Pharm Pharmacol, 2007, 59(8): 1151-1158.
[4]Jullian V, Bourdy G, Georges S,etal. Validation of use of a traditional antimalarial remedy from French Guiana, Zanthoxylum rhoifolium Lam[J]. J Ethnopharmacol, 2006, 106(3): 348-352.
[5]Navarrete A, Hong E. Anthelmintic properties of alpha-sanshool from Zanthoxylum liebmannianum[J]. Planta Med, 1996, 62(3): 250-251.
[6]Dos S Beirigo P J, Torquato H F, Dos Santos C H,etal. [1-8-NαC]-Zanriorb A1, a Proapoptotic Orbitide from Leaves of Zanthoxylum riedelianum[J]. J Nat Prod, 2016, 79(5): 1454-1458.
[7]Morita H, Takeya K. Bioactive Cyclic Peptides from Higher Plants[J]. Heterocycles , 2010, 80(2): 739-764.
[8]Eggleston D S, Baures P W, Peishoff C E,etal. Conformations of cyclic heptapeptides: crystal structure and computational studies of evolidine[J]. J Am Chem Soc, 1991, 113(12): 4410-4416.
[10] Arnison P G, Bibb M J, Bierbaum G,etal. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature[J]. Nat Prod Rep, 2013, 30(1): 108-160.
[11] Napolitano A, Rodriquez M, Bruno I,etal. Synthesis, structural aspects and cytotoxicity of the natural cyclopeptides yunnanins A, C and phakellistatins 1, 10[J]. Tetrahedron, 2003, 59(51): 10203-10211.
[12] Pettit G R, Lippert J W 3rd, Taylor S R,etal. Synthesis of phakellistatin 11: a micronesia (Chuuk) marine sponge cyclooctapeptide[J]. J Nat Prod, 2001, 64(7): 883-891.
[13] 林浩, 王德心. 哌嗪二酮衍生物的合成研究进展[J]. 药学学报, 2003, 38(5): 395-400.
The Solid-phase Synthesis of Zanriorb A1 of Zanthoxylum Cyclic Octapeptide
WuYe1,LingBaodong1,2,SongLi1,MoJinqiu1,LiaoHongli1,2△.
1.SchoolofPharmacy,ChengduMedicalCollege,Chengdu610083,China; 2.KeyLaboratoryofSmallMoleculeSpecialStructureDrugsofSichuanInstitutionofHigherEducation,Chengdu610083,China
Objective To synthesize the Zanriorb A1 of zanthoxylum cyclic octapeptide which can induce the apoptosis of Jurkat cells. Methods The Fmoc solid-phase polypeptide synthesis (SPPS) was used with 2-chlorotrityl chloride resin as a solid support, Fmoc-Gly-OH as the starting material, and DIEA/HCTU as a condensation system. The cyclization was achieved in the liquid phase by HOBt/PyBOP/DIEA, and the target peptide was confirmed by RP-HPLC and MS. Results The Zanriorb A1 of zanthoxylum cyclic octapeptide was synthesized with the final purity of over 98% and the overall yield of 48%. Conclusion The synthetic method was feasible, simple and practical with high yield, and the desired target peptide could be used for drug screening of anti-Jurkat cells.
Zanriorb A1; Zanthoxylum; Jurkat cells; Solid-phase synthesis; Cyclic peptide
http://www.cnki.net/kcms/detail/51.1705.R.20170111.1045.006.html
10.3969/j.issn.1674-2257.2017.01.010
四川省高校科研创新团队项目资助(No:13TD0028)
R79;R914.5
A
△通信作者:廖洪利,E-mail:liaohl213@126.com

