别克参多糖提取工艺优化及体外抗氧化活性研究
魏鸿++孙玉红++董炜++喻文莹++向雪滢++甘元龙++陈春丽


摘要:以热水浸提法提取别克参[Erythronium japonicum Decne.]多糖,采用单因素和正交试验对其提取工艺进行优化,并考察别克参多糖体外清除DPPH、ABTS、羟自由基的能力,对其抗氧化活性进行研究。结果表明,最佳提取工艺为料液比1∶40(mL∶g),提取温度70 ℃,提取次数3次,提取时间5 h,提取率为41.893 1%。别克参多糖具有一定的抗氧化活性。
关键词:别克参[Erythronium japonicum Decne.];多糖;提取工艺;体外抗氧化活性
中图分类号:R282.2 文献标识码:A 文章编号:0439-8114(2016)21-5595-03
DOI:10.14088/j.cnki.issn0439-8114.2016.21.040
Optimization of Technology of Extracting Polysaccharides from Erythronium japonicum Decne. Bulb and Its Anti-oxidative Effects in Vitro
WEI Hong,SUN Yu-hong,DONG Wei,YU Wen-ying,XIANG Xue-ying,GAN Yuan-long,CHEN Chun-li
(Pharmacy College of Xinjiang Medical University, Urumqi 830011, China)
Abstract:The extraction of Erythronium japonicum Decne. bulb polysaccharides through hot water decoction was optimised using single factor experiment and an orthogonal test. The antioxidant activities of the polysaccharides were assessed in vitro using DPPH radical,ABTS radical and Hydroxyl radical. The resuls showed that the optimum extraction conditions were extraction time of 5 h,extraction temperature of 70 ℃,ratio of liquid to raw material of 1∶40(mL/g) and extraction cycle number of three. The experimental yield was 41.893 1%. The results showed that Erythronium japonicum Decne. bulb polysaccharides exhibited certain effects on radical scavenging.
Key words: Erythronium japonicum Decne.s bulb;polysaccharides;technology of extracting;anti-oxidative effect in vitro
新疆猪牙花(Erythronium japonicum Decne.),又名西伯利亚猪牙花、阿尔泰山猪牙花、鸡腿参,为百合科(Liliaceae)猪牙花属(Erythronium)植物,是哈萨克民族食用和药用的植物之一,其干燥肉质鳞茎别克参有滋补、强身壮体等保健功能,是哈萨克民族治疗体虚多病、腰膝酸软、无力等疾病的民间传统医药材料[1,2]。多糖为别克参的主要成分之一[3]。研究表明,植物多糖具有促进免疫调节、抑制肿瘤、抗癌、抗心肌缺血、抗炎镇痛、抗凝血等药理作用[4-9],但目前国内外针对别克参多糖的研究较少。本试验以热水浸提法提取别克参多糖,采用单因素试验和正交试验对其提取工艺进行优化,并考察别克参多糖体外清除DPPH、ABTS、羟自由基的能力,对其抗氧化活性进行研究,以期为深入研究别克参多糖提供参考。
1 材料与方法
1.1 材料和試剂
别克参药材,产于新疆阿勒泰,经新疆医科大学药学院帕丽达·阿不力孜教授鉴定为新疆猪牙花的鳞茎。
二苯代苦味酰基自由基(DPPH·)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(美国Sigma公司)、无水乙醇、抗坏血酸、邻二氮菲、硫酸铁、过氧化氢、磷酸二氢钾、氢氧化钠、过二硫酸钾、H2O2溶液,均为国产分析纯。
1.2 仪器
旋转蒸发仪(N-1001型,上海爱朗仪器有限公司);电热恒温水浴锅(北京市永光明医疗仪器有限公司);低速台式大容量离心机(TDL-5A型,上海菲恰尔分析仪器有限公司);电子分析天平(BS110S型,北京赛多利斯天平有限公司);真空干燥箱(DZF-6051型,上海齐欣科学仪器有限公司);数控超声波清洗器(KQ-500DE型,昆山市超声仪器有限公司);紫外分光光度计(UV-2550型,日本岛津制作所)。
1.3 方法
1.3.1 药材前处理 称取一定量别克参粉末,加15倍量的95%乙醇在40 ℃下超声30 min。以上操作重复3次后,干燥脱脂,备用。
1.3.2 提取工艺流程 取已脱脂别克参粉末2 g采用热水提法进行提取,离心后上清液浓缩至10 mL,加40 mL无水乙醇放入冰箱过夜,离心,取沉淀减压干燥即得别克参多糖粗品,减重法称得多糖含量。以上提取操作均重复3次。以提取多糖的质量占脱脂别克参质量的百分比为提取率。
1.3.3 单因素试验 分别研究不同料液比、提取温度、提取时间及提取次数对别克参多糖提取率的影响。从以上4个方面设计单因素试验,料液比(m∶V)分别为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40、1∶45;提取温度分别为60、70、80、90、100 ℃;提取时间分别为1、2、3、4、5 h,提取次数分别为1、2、3、4次。
1.3.4 别克参多糖提取工艺参数的优化 在单因素试验的基础上考察料液比、提取时间、提取温度、提取次数4个因素对别克参提取率的影响,采用正交试验(表1)优化别克参多糖提取的工艺条件。
1.3.5 别克参多糖抗氧化活性測定 分别采用ABTS法[10,11]、DPPH法[12,13]、羟自由基法[14,15]测定别克参多糖抗氧化活性。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对别克参多糖提取率的影响 如图1所示,随着料液比的增加,别克参多糖提取率也逐渐升高,当料液比为1∶35时提取率达到峰值,随后提取率变化较小,因此,料液比为1∶35时提取效果较好。
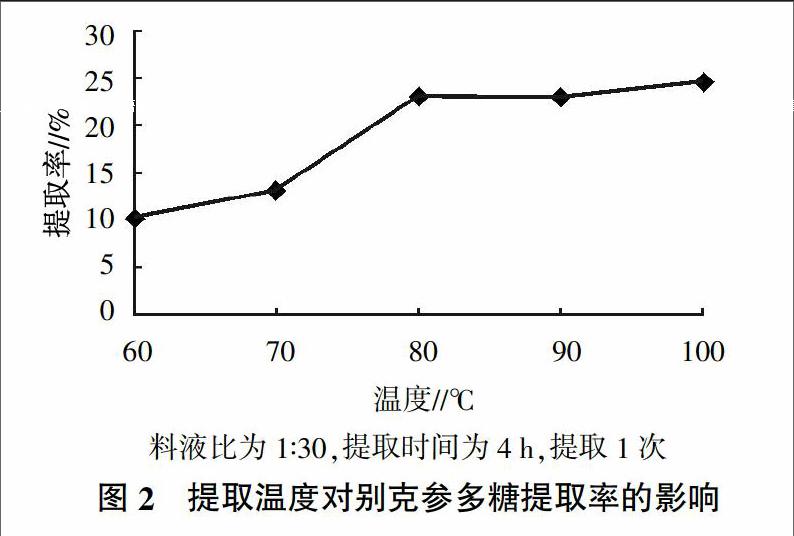
2.1.2 提取温度对别克参多糖提取率的影响 由图2可知,提取温度为60~80 ℃时,对别克参多糖的提取率影响很大,提取率随着提取温度升高而升高,80 ℃时提取率达到最大,之后随着提取温度的升高提取率变化不明显,因此,提取温度为80 ℃时提取别克参多糖的效果较好。
2.1.3 提取时间对别克参多糖提取率的影响 由图3可知,随着提取时间的增加,别克参多糖的提取率逐渐上升,当提取时间增加到4 h以后,随着提取时间的增加,别克参多糖的提取率变化不明显。因此,4 h为较优提取时间。
2.1.4 提取次数对别克参多糖提取率的影响 由图4可知,提取次数对别克参多糖的提取率影响不大,提取2次后多糖基本提取完全,再增加提取的次数,提取率变化不明显,因此提取次数为2时提取效果较好。
2.2 别克参多糖提取的正交试验
在单因素试验的基础上,对别克参多糖的提取条件进行优化,采用L9(34)正交试验,以多糖提取率为考察指标,正交试验结果见表2,方差分析见表3。
由表2可知,4个因素的最佳组合为A1B3C3D3,即料液比1∶40、提取温度70 ℃、提取时间5 h、提取3次。极差分析表明,各因素对别克参多糖提取率的影响大小顺序是提取次数>料液比>提取温度>提取时间。统计分析表明,不同组合之间,4个因素的影响均未达到极显著水平,C、D因素的显著水平明显高于A、B。因此,别克参多糖的最佳提取条件为料液比1∶40、提取温度70 ℃、提取时间5 h,提取3次。
2.3 别克参多糖抗氧化活性分析
2.3.1 清除ABTS+自由基的能力 不同浓度别克参多糖溶液对ABTS+·自由基的清除率如图5所示,不同浓度别克参多糖对ABTS+·自由基均有一定的清除能力,并随着浓度的升高,清除率不断提高,但其清除率明显低于维生素C。
2.3.2 清除DPPH自由基的能力 清除DPPH自由基方法快速、简便,是目前在植物提取物体外抗氧化活性研究中应用最广泛的评价方法之一,别克参多糖对DPPH的清除率见图6。由图6可知,在所选浓度范围内,随着浓度的升高别克参多糖对DPPH·的清除率略有上升,当浓度达到0.672 mg/mL以后清除率基本不变,且均低于20%。
2.3.3 清除羟自由基的能力 羟自由基毒性很强、危害很大,一般很难消除[16]。对羟自由基的清除率是反应样品抗氧化活性的重要指标。由图7可以看出,在所选浓度0.168~1.008 mg/mL中,随着浓度的升高,别克参多糖对羟自由基的清除率略有上升,多糖浓度为0.840 mg/mL时,清除率最大,达到20.97%。
3 小结
别克参作为哈萨克族常用药在临床上也已使用多年,有着广泛的民间用药基础。本试验在单因素试验的基础上,运用正交试验对影响别克参多糖提取率的因素进行了考察,由结果可知,各因素对别克参多糖提取率的影响顺序为提取次数>提取料液比>提取温度>提取时间;别克参多糖的最佳提取条件为料液比1∶40、提取温度70 ℃、提取时间5 h,取次数3次。在该工艺下,别克参多糖的提取率最高为41.893 1%。
别克参多糖体外抗氧化研究表明,别克参多糖对ABTS+·、DPPH·、羟自由基均有一定的清除能力,但清除能力均低于维生素C。
参考文献:
[1] 陈春丽,田 兰,勉强辉,等.别克参提取物抗氧化活性研究[J]. 中国药房,2013(47):4425-4428.
[2] 古丽江·贾曼拜,何春霞,古力西拉·沙菩西,等.新疆猪牙花生物学特性研究[J].新疆林业,2012(2):17-19.
[3] 陈春丽,余志银,严 丹,等.新疆哈萨克民间药材别克参化学成分预实验[J].时珍国医国药,2014(5):1095-1097.
[4] 赵雪迎,丁克俭,胡进维,等.植物多糖的研究进展[J].辽宁中医药大学学报,2008,10(3):140-141.
[5] 冉 靓,杨小生,王伯初,等.抗氧化多糖的研究进展[J].时珍国医国药,2006,17(4):494-496.
[6] 焦连庆,于 敏,焦 莹,等.树舌多糖的分离纯化、理化性质及抗炎镇痛活性研究[J].中国药师,2010,13(5):615-617.
[7] 王 健,龚兴国.多糖的抗肿瘤及免疫调节研究进展[J].中国生化药物杂志,2001,22(1):52-54.
[8] 王 圆.红豆杉多糖的提取、纯化及性质研究[D].杭州:浙江工业大学,2005.
[9] 申利红,王建森,李 雅,等.植物多糖的研究及应用进展[J].中国农学通报,2011,27(2):349-352.
[10] 韩光亮,李翠梅,EDUARDO CACACE,等.改良的ABTS+法及其在优化抗氧化活性物质提取中的应用[J].卫生研究,2004,33(5):620-622.
[11] 邱金东,汤 昆.DPPH和ABTS法测定核桃仁的体外抗氧化活性[J].中成药,2008,30(8):1215-1216.
[12] 钱 力,陈华妮,劳玲玲,等.野生酸荔枝核中多糖的提取及其抗氧化活性[J].湖北农业科学,2014,53(20):4949-4951.
[13] 霍丽妮,陈 睿,廖艳芳,等.黄皮桑寄生不同极性溶剂提取物抗氧化能力研究[J].湖北农业科学,2014,53(11):2631-2633.
[14] 王冬冬,陈雪红,曹冬梅,等.微生物法提取马齿苋和银杏叶黄酮及其抗氧化活性研究[J].湖北农业科学,2015,54(6):1455-1457.
[15] 李顺峰,张丽华,付娟妮,等.真姬菇子实体多糖体外抗氧化特性研究[J].西北农业学报,2008,17(4):302-305.
[16] 魏丕伟,熊 俐,王凌云,等.枳椇多糖体外抗氧化活性研究[J].江苏农业科学,2014(7):316-318,319.

