抗氯吡脲单克隆抗体的制备及其间接竞争ELISA方法的建立
陆健康++艾明艳++李述刚
摘要:在获得高特异性抗CPPU单克隆抗体的基础上,采用活性酯法将CPPU-H1与BSA、CPPU-H2与OVA偶联制备得到免疫抗原CPPU-H1-BSA和包被抗原CPPU-H2-OVA;用CPPU-H1-BSA对小鼠进行免疫,通过杂交瘤技术筛选获得了1株抗CPPU单克隆抗体的杂交瘤细胞株B7B6 24。经过体内诱生腹水法制备抗体,测定抗体亚类为IgG1,效价为1∶32 000。通过对试验条件的优化,建立了一种检测CPPU的方法,该方法IC50值为3.89 ng/mL;该抗体与四螨嗪、赤霉素、噻苯隆几乎不存在交叉反应;利用所建立的间接竞争ELISA法对葡萄样品进行检测,平均加标回收率为91.4%~112.4%,变异系数为5.9%~14.4%。本研究所建立的间接竞争ELISA方法具有低成本、高准确性和高灵敏度的特点,可以用来对葡萄中的CPPU残留情况进行检测。
关键词:氯吡脲;单克隆抗体;间接竞争ELISA
中图分类号:S482.8 文献标识码:A 文章编号:0439-8114(2016)21-5584-04
DOI:10.14088/j.cnki.issn0439-8114.2016.21.037
Preparation of Anti-CPPU Monoclonal Antibody and Development of
an Indirect Competitive ELISA Method
LU Jian-kang,Ai Ming-yan,LI Shu-gang
(Xinjiang Production & Construction Group Key Laboratory of aricultural Products Processing in Xinjiang South,
Tarim University,Alaer 843300,Xinjiang,China)
Abstract: A method to rapidly detect forchlorfenuron(CPPU) was developed by Indirect competitive ELISA on the basis of obtaining the Anti-CPPU Monoclonal Antibody with high specificity. CPPU-H1-BSA(immunogenic antigen) and CPPU-H2-OVA(coating antigen) were prepared by coupling with CPPU-H1 and CPPU-H2 with carrier proteins using active ester method,respectively. Through a hybridoma cell line,a strain of cells B7B6 24 which can produce anti-CPPU on monoclonal antibody was obtained. Ascites was produced by mice vivo culcure,the monoclonal antibody characterized by IgG1 isotype,and the ELISA titer of ascites was 1∶32 000. A indirect competitive ELISA was developed for the detection of CPPU by optimizing experimental conditions. The IC50 value was 3.89 ng/mL,it did not react with clofentezine, gibberellic acid,thidiazuron. The average recovery rate for CPPU from grape samples were ranged from 91.4% to 112.4% and the variation coefficient were between 5.9%~14.4%. The indirect competitive ELISA allows for accurate,sensitive,and low-cost for determination of CPPU residues in grape.
Key words: CPPU; monoclonal antibody; indirect competitive ELISA
氯吡脲(forchlorfenuron)又名吡效隆、CPPU,化学名称为1-(2-氯-4-吡啶基)-3-苯基脲,是膨大剂的主要成分,具有促进细胞增大、分化、分裂、防止落花以及提高座果率等多方面作用[1]。CPPU在西瓜[2]、葡萄[3]、猕猴桃[4,5]、菠萝[6]等瓜果类植物中的应用研究较多。在CPPU的实际使用过程中,存在着片面追求大果形以及高产量而高剂量、高濃度喷洒的问题,从而导致各类瓜果贮藏期缩短以及营养物质和风味物质降低[7]。此外,残留于瓜果以及其他食品中的CPPU还可能对人类以及环境中的其他生物造成潜在的影响,如美国环境保护署指出人类长期接触CPPU会导致体内蛋白质代谢紊乱以及体形消瘦等问题[8]、高剂量CPPU可能诱导雌性大鼠青春期启动延迟[9]等。因此,中国、美国、日本以及欧盟等对CPPU的最大残留量作出了严格的限定,中国规定西瓜和黄瓜中的最大残留量为0.1 mg/kg,猕猴桃和葡萄中的最大残留量为0.05 mg/kg。
目前,对于CPPU残留的检测方法较多,主要包括液相色谱法[10-13]、液相色谱-质谱联用法[14,15]、近红外高光谱成像法[16]以及免疫分析方法[17,18]等。免疫学分析方法具有简便、快速、高通量、灵敏以及成本低等诸多优点,适合于大批量样品的现场检测。本研究使用单克隆抗体技术,制备抗CPPU的高特异性和灵敏度的单克隆抗体,并在此基础上建立了果品中快速检测CPPU的间接竞争ELISA法,为后续开发ELISA试剂盒奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 试剂 牛血清白蛋白(BSA)、卵白蛋白(OVA)、N-羟基硫代琥珀酰亚胺、二环己基碳二亚胺、弗氏完全佐剂、弗氏不完全佐剂,购自Sigma公司;单克隆抗体亚型鉴定试剂盒,购自Thermo公司;CPPU等农药标准品,购自山东西亚化学工业有限公司;其他化学试剂均为分析纯。
1.1.2 细胞株及试验动物 鼠骨髓瘤细胞SP2/0由深圳市易瑞生物技术有限公司提供;清洁级Balb/c纯种雌性小鼠及普通级雌性昆明鼠由广东省医学动物实验中心提供。
1.1.3 仪器与设备 WD-2102A型酶标仪(北京市六一仪器厂);FA/JA2004N型电子天平(上海精密科学仪器有限公司);TDL-5-A(上海安亭科学仪器厂);LHS-150 SC型恒温恒湿培养箱(上海一恒科学仪器有限公司)。
1.2 人工抗原的合成与鉴定
按照文献[17]的方法稍作修改后合成N-(4-羧基苯基)-N-3-氯吡啶基-2-甲酰二胺(CPPU-H1)和N-(4-乙酸苯基)-N-3-氯吡啶基-2-甲酰二胺人工半抗原(CPPU-H2),经质谱鉴定为目标产物。然后采用活性酯法合成CPPU完全抗原,具体操作如下:称取0.1 mmol CPPU-H1(或CPPU-H2)溶解于0.5 mL二甲基甲酰胺中,加入0.2 mmol N-羟基琥珀的酰亚胺和0.2 mmol二环己基碳二亚胺,4 ℃条件下避光搅拌反应过夜后4 000 r/min离心10 min,离心后的上清液为A液。称取6 mmol BSA(或6 mmol OVA)溶于适量0.01 mmol/L磷酸盐缓冲液(PBS,pH 7.4)中,搅拌溶解为B液;4 ℃搅拌条件下,将A液逐滴加入到B液中,4 ℃搅拌反应过夜;将反应液转入透析袋中,4 ℃搅拌条件下透析3 d,每天更换透析液3次;将透析液分装后置于-20 ℃条件下保存备用。
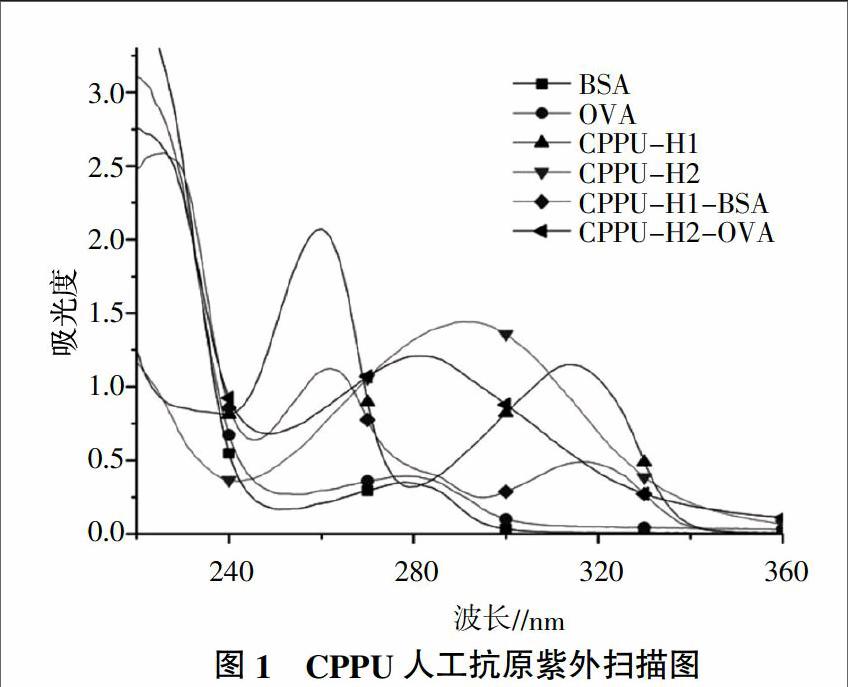
合成的人工抗原CPPU-H1-BSA、CPPU-H1、BSA、CPPU-H2-OVA、CPPU-H2以及OVA在波长200~360 nm范围内分别进行紫外光谱扫描,通过比对扫描曲线判断是否合成成功。
1.3 单克隆抗体的制备
1.3.1 动物免疫 将制备好的免疫抗原CPPU-H2-OVA与等量弗氏完全佐剂乳化完全后对6~8周龄雌性Balb/c小鼠进行皮下多点免疫,100 μg/只。二、三免时采用弗氏不完全佐剂进行乳化,皮下多点以及腹腔免疫,100 μg/只,免疫间隔为2周。第4次免疫后的第7天从小鼠尾部取血测定抗体效价。细胞融合前3 d腹腔免疫CPPU-H2-OVA,50 μg/只以加强免疫。
1.3.2 细胞融合及筛选 取抗血清效价好以及灵敏度高的小鼠的脾细胞与SP2/0骨髓瘤细胞进行细胞融合,然后先后采用含HAT和HT的培养液对融合后的细胞进行培养筛选;待细胞培养板中的细胞贴壁长满1/2~1/3的小孔底部后,取杂交瘤细胞上清液进行间接ELISA检测。取呈现强阳性的亚克隆进行扩大培养,如此反复2~4次,待所克隆孔中上清液中的抗体阳性率为100%时,进行扩大培养,建株后分装、冻存。
1.3.3 腹水的制备及纯化 Balb/c雌性小鼠提前1周腹腔注射0.5 mL降植烷;取冻存细胞株,复苏后,大量培养繁殖,收集细胞,用不完全培养基洗涤2次后,再用10 mL不完全培养基悬浮,计数;每只小鼠腹腔注射1.5×107个单克隆细胞,待小鼠腹部明显膨大时采集腹水,1 000 r/min离心10 min,去除上层脂肪和下层纤维蛋白及细胞,收集中层即为小鼠腹水,取部分腹水利用ELISA法测定其效价,其余分装后于-70 ℃冻存备用。
1.4 单克隆抗体的鉴定
1.4.1 抗体效价的测定 采用间接ELISA法测定单克隆抗体的效价,分别以不同浓度的CPPU-H1-BSA包被抗原包被酶标板,将单克隆抗体从1∶2 000开始倍比稀释作为1抗,以HRP-羊抗鼠IgG作为二抗,进行间接ELISA法测定,选择OD450 nm为1.0左右的抗体最高稀释倍数作为单克隆抗体的效价。
1.4.2 抗体的亚型鉴定 采用间接ELISA法对单克隆抗体的亚型进行鉴定。
1.5 间接竞争ELISA法的建立
1.5.1 标准曲线的绘制 根据间接ELISA棋盘方阵滴定法确定的最佳抗原包被浓度以及抗体稀释倍数进行间接竞争ELISA试验,在此过程中确定最佳竞争时间、封闭时间、酶标二抗反应时间以及竞争模式。根据最佳反应条件,用甲醇将竞争抗原浓度稀释至0.1、0.3、0.9、2.7、8.1、24.3、72.9 ng/mL进行间接竞争ELISA试验。以CPPU的浓度对数为横坐标、竞争抑制率为纵坐标建立间接竞争ELISA标准曲线,计算CPPU的IC50值。
1.5.2 单克隆抗体特异性分析 选择四螨嗪、赤霉素、噻苯隆分别代替CPPU作为竞争抗原,采用间接竞争ELISA法建立标准曲线,并分别计算IC50值,按公式计算交叉反应率CR(%):CR=(IC50 CPPU/IC50其他药物)×100%。
1.6 加标回收率测定
將市场上购买的葡萄经充分破碎后,准确称取5.0 g葡萄浆样品,分别加入一定量的CPPU标准溶液,使其浓度分别为10、20、50 ng/g,每个浓度3个重复;分别往每个样品中加入15 mL乙腈和3 g氯化钠,振荡提取10 min后,4 500 r/min离心10 min,静置20 min,取5 mL上清液氮气吹干后用甲醇复溶后用于ELISA检测,计算相应的加标回收率。
2 结果与分析
2.1 CPPU完全抗原的鉴定
在波长为200~360 nm范围内,对半抗原、载体蛋白以及人工抗原的紫外吸收特性进行分析,以鉴定完全抗原是否合成成功。由图1可知,CPPU-H1-BSA在280 nm处有BSA的特征吸收峰,在316 nm以及260 nm处存在CPPU-H1的2个特征吸收峰,说明CPPU-H1-BSA偶联成功;OVA在279 nm处存在特征吸收峰,CPPU-H2在291 nm处存在特征吸收峰,而CPPU-H2-OVA的特征吸收峰在283 nm处,证明CPPU-H2-OVA偶联成功。
2.2 抗血清效果分析
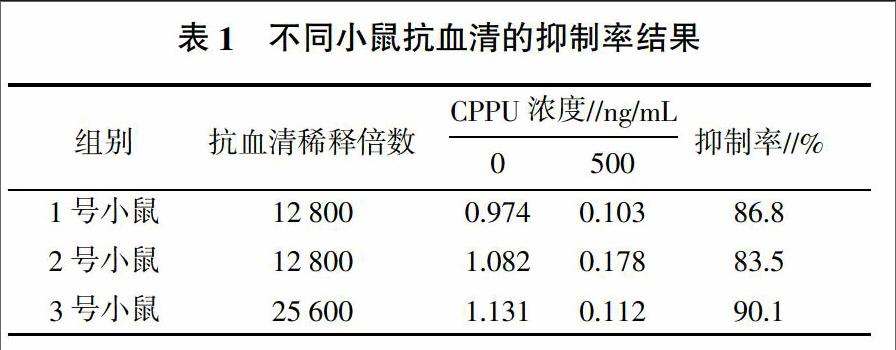
抗血清的效价与抗血清中特异性抗体浓度成正比,而活化的B淋巴细胞是抗体分泌细胞,因此,效价越高则活化的B淋巴细胞越多。在融合时选用效价高的小鼠脾细胞有利于融合出针对目标抗原的杂交瘤细胞。采用棋盘方阵滴定法确定最佳的包被抗原浓度为2 μg/mL,其中3号小鼠抗血清效价最高。分别采用浓度为0、500 ng/mL的CPPU作为竞争抗原,对不同小鼠的抗血清进行间接竞争ELISA检测,记录OD450 nm并计算抑制率,其结果如表1所示。从表1中可以看出在竞争抗原CPPU浓度达到500 ng/mL时,3号小鼠抗血清的抑制率超过90%,因此,选用3号小鼠的脾细胞进行细胞融合。
2.3 单克隆抗体细胞筛选
经过细胞融合、筛选,得到了1株稳定分泌抗CPPU抗体的杂交瘤细胞B7B6 24。经过多次传代、冻存和复苏,该株杂交瘤细胞能保持很好的抗体分泌能力且效价稳定。
2.4 单克隆抗体亚型鉴定
经降植烷处理后的小鼠腹腔注射B7B6 24雜交瘤细胞,10~15 d后采集腹水。以2 μg/mL包被抗原包被酶标板,采用间接ELISA方法检测腹水抗体的亚型,检测结果显示B7B6 24的抗体亚型为IgG1。采用间接ELISA方法测定单克隆抗体B7B6 24的腹水效价为1∶32 000。
2.5 间接竞争ELISA法的建立
2.5.1 标准曲线绘制 根据间接ELISA棋盘方阵滴定法确定的最佳抗原包被浓度以及抗体稀释倍数进行间接竞争ELISA试验,在此过程中确定最佳竞争时间、封闭时间、酶标二抗反应时间以及竞争模式。4 ℃包被12 h;抗原最佳包被浓度2 μg/mL,单克隆抗体稀释倍数为1∶32 000;5%脱脂奶粉封闭120 min;板内竞争反应模式;37 ℃竞争反应90 min;酶标二抗浓度为1∶4 000;酶标二抗反应时间为60 min。
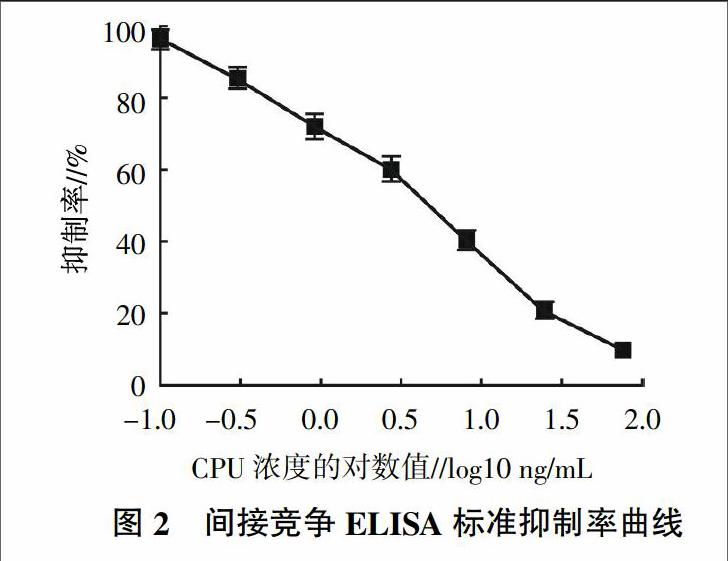
由图2可知,线性回归方程为y=-0.316 3Ln(x)+0.686 5(R2=0.990 1),其IC50值为3.89 ng/mL。
2.5.2 单克隆抗体特异性分析 通过间接竞争ELISA法检测,表明B7B6 24杂交瘤细胞所产生的单克隆抗体与四螨嗪、赤霉素、噻苯隆的交叉反应率均小于0.39%(表2),表明所制备的单克隆抗体对CPPU具有高度的特异性。
2.6 加标回收率
在葡萄样品中加入3种不同浓度的CPPU标准品溶液并进行提取,采用间接竞争ELISA法进行测定样品加标回收率,检测结果如表3所示。有结果可知,样品平均加标回收率在91.4%~112.4%之间,变异系数在5.9%~14.4%之间(表3),表明该方法具有较好的准确性和灵敏度。
3 小结与讨论
以活性酯法制备的CPPU-H1-OVA为免疫抗原免疫小鼠,获得的小鼠脾细胞与SP2/0鼠骨髓瘤细胞融合,经筛选,得到了一株稳定分泌抗CPPU抗体的杂交瘤细胞B7B6 24;将其注射入小鼠腹腔,获得腹水,经鉴定腹水抗体亚型为IgG1,效价为1∶32 000;使用该抗体建立了间接竞争ELISA检测方法,该方法中最佳包被条件为4 ℃包被12 h、抗原最佳包被浓度2 μg/mL、单克隆抗体稀释倍数为1∶32 000、5%脱脂奶粉封闭120 min、采用板内竞争反应模式37 ℃竞争反应90 min、酶标二抗浓度为1∶4 000、酶标二抗反应时间为60 min,IC50值可以达到3.89 ng/mL;抗体与其它几种农药交叉反应很小;平均加标回收率为91.4%~112.4%,变异系数为5.9%~14.4%。因此可以运用本研究所建立的间接竞争ELISA方法对葡萄等果品中CPPU残留量进行初步检测与筛选。
参考文献:
[1] 陈卫军,张耀海,李云成,等.果蔬中常用植物生长调节剂分析方法研究进展[J].食品科学,2012,3(11):283-289.
[2] 孙竹波,刘忠德,刘 震,等.0.1%氯吡脲可溶性液剂对西瓜产量和品质的影响[J].北方园艺,2006(1):25-26.
[3] 吕中伟,王 鹏,张晓锋,等.植物生长调节剂对阳光玫瑰葡萄膨大及果实品质的影响初探[J].中外葡萄与葡萄酒,2015(6):38-39.
[4] AINALIDOU A,KARAMANOLI K,MENKISSOGLU-SPIROUDI U.CPPU treatment and pollination:Their combined effect on kiwifruit growth and quality[J].Scientia Horticulturae,2015,193:147-154.
[5] KIM J G,TAKAMI Y,MIZUGAMI T,et al. CPPU application on size and quality of hardy kiwifruit[J].Scientia Horticulturae, 2006,110(2):219-222.
[6] ADANIYA S,MINEMOTO K,MOROMIZATO Z,et al. The use of CPPU for efficient propagation of pineapple[J].Scientia Horticulturae,2004,100(1-4):7-14.
[7] 董金磊,郭文川.不同质量浓度氯吡脲对猕猴桃果实理化参数的影响[J].西北农林科技大学学报(自然科学版),2015,43(10):145-151.
[8] 李瑞娟,于建垒,宋国春.氯吡脲的环境行为及其安全性的研究进展[J].农药,2008,47(4):240-243.
[9] 陈槐萱,杨春平,程薇波,等.青春期前氯吡脲暴露对雌性大鼠生殖发育的影响[J].环境与健康杂志,2015,32(1):33-36.
[10] 罗伟强,肖小华,杜 卓,等.整体柱固相萃取-高效液相色谱法在线分析水果中的氯吡脲[J].色谱,2014,32(4):407-412.
[11] 胡江涛,盛 毅,方 智,等.分散固相萃取-高效液相色谱法快速检测猕猴桃中的氯吡脲[J].色谱,2007,25(3):441-442.
[12] 侯玉茹,杨 媛,石 磊,等.固相萃取-高效液相色譜法检测葡萄中氯吡脲的研究[J].食品科技,2011,36(1):255-258.
[13] 邵金良,樊建麟,林 涛,等.高效液相色谱法同时测定果蔬中5种植物生长调节剂残留[J].食品安全质量检测学报,2015,6(8):3255-3261.
[14] 吴莉莉,吕媛媛,沈 兵,等.高效液相色谱-串联质谱法快速测定水果中氯吡脲残留量[J].理化检验:化学分册,2014,50(2):206-209.
[15] BHARAT U,KAUSHIK B,RAMTEKE S D,et al. Dissipation kinetics of forchlorfenuron,6-benzyl aminopurine,gibberellic acid and ethephon residues in table grapes(Vitis vinifera)[J].Food Chemistry,2013,141(4):4208-4214.
[16] LIU D,GUO W.Identification of kiwifruits treated with exogenous plant growth regulator using Near-infrared hyperspectral reflectance imaging[J].Food Analytical Methods,2014,8(1):164-172.
[17] SUAREZ-PANTALEON C,ESTEVE-TURRILLAS F A,MERCADER J V,et al. Development and validation of a direct competitive monoclonal antibody-based immunoassay for the sensitive and selective analysis of the phytoregulator forchlorfenuron[J].Analytical and Bioanalytical Chemistry,2012,403(7):2019-2026.
[18] CELIA S P,MERCADER J V,CONSUELO A,et al. Production and characterization of monoclonal and polyclonal antibodies to forchlorfenuron[J].Journal of Agricultural and Food Chemistry,2008,56(23):11122-11131.

