紫雀花清除自由基活性研究
舒越昊+张妮++邹荣灿+吴玉巧+余正文

摘要:探究紫雀花(Parochetus communis)不同溶剂提取物及主要异黄酮的体外抗氧化活性。采用清除DPPH·法测定紫雀花石油醚、乙酸乙酯、正丁醇和水提物以及芒柄花苷、刺芒柄花素、维生素C的体外抗氧化活性。紫雀花的乙酸乙酯(IC50=0.016 2 mg/mL)和正丁醇提取物(IC50=0.045 9 mg/mL)显示显著的抗氧化活性,水提物其次,石油醚提取物最差;乙酸乙酯提取物的主要异黄酮刺芒柄花素和正丁醇提取物的主要异黄酮芒柄花苷的抗氧化活性微弱。紫雀花乙酸乙酯和正丁醇提取物具有显著的抗氧化活性,而主要异黄酮刺芒柄花素和芒柄花苷不是两个提取物清除DPPH·的有效活性成分。
关键词:紫雀花(Parochetus communis);抗氧化活性;DPPH·;異黄酮
中图分类号:S58;Q505 文献标识码:A 文章编号:0439-8114(2016)24-6550-03
DOI:10.14088/j.cnki.issn0439-8114.2016.24.056
自由基(ROS)是细胞进行有氧代谢时的产物。需氧生物利用O2进行正常有氧代谢时会产生O22-,再由O22-衍生出H2O2等活性氧。最终H2O2在Fe2+等过渡金属离子的介导下产生羟自由基(·OH)。活性氧在机体中的主要功能是对基因进行转录和表达,以及信号的传导和调节控制细胞的分裂、分化等[1]。同时又被人体内的抗氧化酶如超氧化物歧化酶和过氧化氢酶等以及其他非酶的内源性抗氧化剂所清除。但人体正常细胞内每天会形成大量的自由基;因而当未被清除的自由基存在时仍可改变细胞的生物膜脂质、蛋白质、DNA等重要的生物大分子的性质,显示出“氧毒性”,从而引发人体细胞衰老、损害甚至癌变[2,3]。人体得到较好的营养补充时,机体对自由基的产生与清除能达到一种稳定、正常的平衡状态,使活性氧自由基能正常发挥作用。除人体自身的内源性抗氧化剂对自由基的清除和损伤后修复的能力以外,外源性抗氧化剂也起着十分重要的作用。如维生素C(抗坏血酸)、BHA(丁基羟基茴香醚)、BHT(二丁基羟基甲苯)等是在食品加工上常用的抗氧化剂[4]。然而如BHA、BHT等人工合成抗氧化剂虽有一定的抗氧化能力,但因其功效低和有刺激性,并经动物试验证明,服用这类合成抗氧化剂后,对机体产生了毒性和致癌性。与之相比,维生素C等植物源天然抗氧化剂不仅具有有效性和广谱性,而且对生物的毒性低甚至无毒。从药食同源植物中发掘天然抗氧化剂已成为必然趋势。
紫雀花(Parochetus communis)又名金雀花、蓝雀花、生血草、一颗血,为蝶形花科紫雀花属草本植物。生于2 000 m左右海拔的山地和荒坡的阴凉、湿润处。紫雀花主要分布于贵州毕节、普安、兴仁、遵义等地及四川、云南;国外如印度、不丹、缅甸、斯里兰卡和泰国等也有少量分布。紫雀花为贵州苗族同胞常用草药,性味甘,微温,有补肾壮阳之效,用于治疗外感发热、肾虚阳痿、水肿和瘰疬[5,6]。紫雀花的食用价值和医用价值得到了苗族同胞的肯定。本实验室曾从紫雀花中分离鉴定得到刺芒柄花素、芒柄花苷、美迪紫檀素、车轴草醇、3′,6-二甲氧基-5′-羟基异黄酮-7-O-β-D-葡萄糖苷、阿佛洛莫生-7-O-β-D-葡萄糖苷、β-谷甾醇、1-三十烷醇、邻苯二酸二辛酯、邻苯二酸二丁酯、新植二烯,其中刺芒柄花素、芒柄花苷两个异黄酮含量较高[7,8]。研究表明,异黄酮为蝶形花科植物的代表性成分,大多具有良好的抗氧化活性,如大豆异黄酮[9]、葛根异黄酮[10]、黄芪异黄酮[11]等。本试验采用DPPH法对紫雀花的石油醚、乙酸乙酯、正丁醇和水提物以及刺芒柄花素、芒柄花苷进行抗氧化活性的研究。通过深入研究该药食同源性植物的抗氧化活性,为苗药紫雀花的资源开发和临床应用提供理论依据。
1 材料与方法
1.1 材料、试剂和仪器
紫雀花于2015年8月采自贵州省兴仁县,经贵州师范大学张潮博士鉴定为蝶形花科植物紫雀花。
1,1-二苯基-2-三硝基苯肼(DPPH)(Tokoy Chemical Industry/Japan公司);刺芒柄花素标准品(西安玉泉生物科技有限公司);芒柄花苷标准品(南京世洲生物科技有限公司);抗坏血酸(中国药品生物制品检定所);聚酰胺薄膜(20 cm×20 cm)(浙江省台州市路桥四甲生化塑料厂);乙醇、甲醇、氯仿、甲酸、三氯化铝均为分析纯。
CXP-100型多功能粉碎机(上海市晟喜制药机械有限公司);RE-2000型旋转蒸发器(上海洪旋实验仪器有限公司);MS105DU型电子天平(梅特勒-托利多仪器有限公司);KQ-500DE型超声清洗器(昆山市超声仪器有限公司);UV759CRT型紫外分光光度计(上海佑科仪器仪表有限公司);XMTD-6000型电热恒温水浴锅(上海宜昌仪器沙筛厂);3650A型紫外分析仪(上海科艺光学仪器厂)。
1.2 方法
1.2.1 提取方法 将紫雀花干样品用粉碎机粉碎后,精准称取其粉末20.000 g,加入400 mL 75%乙醇浸泡60 min后,超声波辅助提取3次,每次15 min,过滤后合并提取液。减压回收溶剂,得到紫雀花浸膏(3.893 g)。将上述浸膏加入20倍量的去离子水制成悬浮液,依次等体积用石油醚、乙酸乙酯和正丁醇萃取,分别萃取3次,合并萃取液。减压回收溶剂得石油醚提取物(0.155 g)、乙酸乙酯提取物(0.280 g)、正丁醇提取物(0.338 g)、水提取物(0.920 g)。
1.2.2 聚酰胺薄层层析 将紫雀花乙酸乙酯提取物、正丁醇提取物、刺芒柄花素、芒柄花苷用甲醇溶解得供试液。乙酸乙酯、正丁醇及刺芒柄花素供试液点样于聚酰胺薄膜上,用甲醇∶水∶甲酸(16∶2∶0.3)展开;乙酸乙酯、正丁醇及刺芒柄花苷供试液点样于聚酰胺薄膜上,用氯仿∶甲醇∶甲酸(8∶2∶0.1)展开。喷1%AlCl3乙醇溶液显色,在254 nm波长的紫外光灯下检视。
1.2.3 DPPH·清除活性测定[12] 对照组:在离心管中加入0.04 mg/mL DPPH 2 mL和无水甲醇2 mL充分混合,暗室反应40 min。无水甲醇为空白对照,517 nm处紫外分光光度法快速测定吸光度(A0)。样品对照组:在离心管中加入不同浓度的样品溶液2 mL和无水甲醇2 mL充分混合后,暗室反应40 min后快速测定517 nm处的吸光度,记为(A1)。样品组:在离心管中加DPPH无水甲醇溶液2 mL和不同浓度的样品溶液2 mL充分混合,暗室反应40 min后,快速于517 nm處测定吸光度(A2)。以刺芒柄花素无水甲醇溶液、芒柄花苷无水甲醇溶液和维生素C水溶液代替样品溶液,其中维生素C作为阳性对照。每组平行测定吸光度3次,求3次的平均值,代入公式计算其清除率Y(%)。以样品浓度和清除率Y进行线性回归,求半抑制浓度(IC50)和自由基清除能力(AE),AE=1/IC50。试验数据采用Excel处理、进行线性回归。
Y=[1-(A2-A1)/A0]×100%
2 结果与分析
2.1 薄层层析
乙酸乙酯提取物和刺芒柄花素在Rf值为0.55的位置显示相同颜色的斑点,表明刺芒柄花素主要存在于乙酸乙酯提取物中;正丁醇提取物和芒柄花苷在Rf值为0.57的的位置显示相同颜色的斑点,芒柄花苷主要存在于正丁醇提取物中[13]。
2.2 DPPH·的清除活性
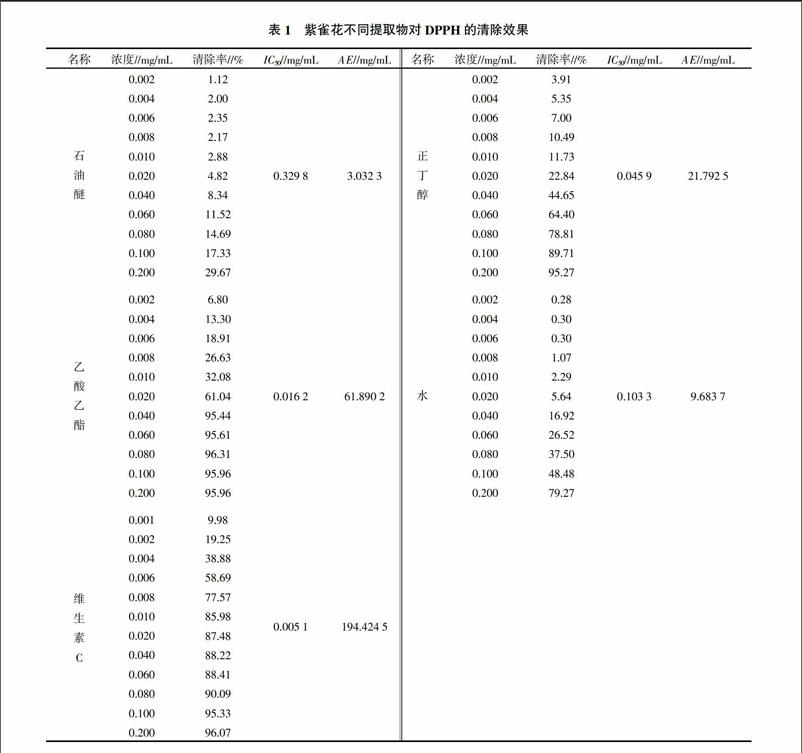
从表1可以看出,紫雀花不同提取物清除自由基能力顺序:乙酸乙酯>正丁醇>水>石油醚。石油醚提取物的浓度增加,清除率缓慢上升,显示较低的清除效果。由图1可知,紫雀花的不同提取物对清除DPPH·的能力有所不同。其乙酸乙酯提取物浓度为0.04 mg/mL时,清除率达到95.44%,大于0.100 mg/mL的浓度与维生素C清除率几乎相等。正丁醇提取物0.200 mg/mL对DPPH·的清除效果与乙酸乙酯和维生素C的清除率相当。刺芒柄花素和芒柄花苷的折线图平缓,其中刺芒柄花素有微弱的清除能力。
3 结论
紫雀花的乙酸乙酯和正丁醇提取物对清除DPPH·体系有明显的效果。虽然这两个提取物分别含有刺芒柄花素和芒柄花苷,但它们不是乙酸乙酯和正丁醇提取物清除DPPH·的有效活性成分。紫雀花乙酸乙酯部位和正丁醇部位的抗氧化活性成分还有待进一步研究。
紫雀花不同溶剂提取物清除DPPH·自由基活性随着浓度的增加而升高,高浓度的乙酸乙酯和正丁醇提取物,其抗氧化活性与维生素C相当,表明紫雀花具有较好的药食兼用价值,值得深入研究开发。
参考文献:
[1] 方允中,郑荣梁.自由基生物学的理论与应用[M].北京:科学出版社,2002.
[2] 方允中,杨 胜,伍国耀.自由基、抗氧化剂、营养素与健康的关系[J].营养学报,2003,25(4):337-343.
[3] 惠宏襄,赵小宁,金 明,等.自由基与细胞凋亡[J].生物化学与生物物理进展,1996,23(1):12-16.
[4] 张春晖.食品防腐剂和抗氧化剂在肉制品中的应用[A].第十四届中国国际食品添加剂和配料展览会学术论文集[C].北京:中国食品添加剂和配料协会,2010.
[5] 彭泽邦.贵州中药资源[M].北京:中国医药科技出版社,1990.
[6] 汪 毅,李朝斗.精选草药彩色图谱2[M].贵阳:贵州科技出版社,2014.
[7] 张 妮.苗药金雀花化学成分的分析[D].贵阳:贵州师范大学,2015.
[8] 张 妮,穆淑珍,王家胜,等.金雀花提取物正丁醇沉淀部分化学成分研究[J].林产化学与工业,2015(3):121-124.
[9] 徐春华,张治广,谢明杰.大豆异黄酮的抗氧化和抗肿瘤活性研究[J].大豆科学,2010,29(5):870-873.
[10] 曹钟灵,李建北,张东明.葛属植物中异黄酮类化合物的研究进展[J].中药材,2005,28(1):67-71.
[11] 王晓辉,刘 涛,李 清,等.高效液相色谱法同时测定黄芪中的五种异黄酮类成分[J].色谱,2006,24(5):486-488.
[12] 曾 宇,江 滨,马世平,等.DPPH自由基清除法筛选当归芍药散抗氧化活性有效部位[J].广东医学院学报,2013,29(2):138-141.
[13] 徐 颖,董文宾,张建华.聚酰胺薄层色谱法分离鉴定异黄酮[J].中国粮油学报,2005,20(5):127-129.

