Ag-rGO 共掺杂对Bi2WO6微观结构与光催化脱氮性能的影响∗
高彦华
(东北石油大学化学化工学院 石油与天然气化工省重点实验室,黑龙江 大庆163318)
进入21世纪以来,环境污染和能源短缺成为人类亟待解决的重大问题,而工业染料废水对环境的污染尤为严重,寻求廉价高效的环境污染治理技术已成为科技工作者关注的焦点。半导体光催化处理技术在有机污染物的处理中具有其它传统水处理所无法比拟的优势,是一种极具发展前途的水处理技术,在太阳能的利用和环境保护方面有着重大的战略意义[1-3]。
近年来,金属氧化物作为光催化剂降解环境中有机污染物的应用,引起了广泛的关注。TiO2及Zn O纳米材料虽已经被广泛研究,但由于两者禁带宽度比较大,(TiO2的禁带宽度为3.2 e V,Zn O的禁带宽度为3.3 e V),只能在紫外光的激发下对有机物进行降解,这一不足严重限制了两者的应用[4-6]。Bi2WO6作为一种稳定、高效、环保的新型半导体光催化材料,其隶属于Aurivillius氧化物家族,其禁带宽度为2.7 e V,同时拥有类似钙钛矿层状三维结构,在光催化过程中,这种层状结构不仅有助于在光生载流子的转移,更能提高光催化剂的量子效率[7-8]。石墨烯是一种新颖的二维蜂窝状纳米材料,具有特殊的单原子层结构,被认为是到目前为止存在的最薄材料。其氧化产物即氧化石墨烯具有比表面积大、亲水性强和较好的物理化学性能等优点,在大多数极性有机溶剂和水中都具有很好的分散稳定性,可作为一种高活性载体[9-13]。同时,采用高活性Ag对其复合后的r GO/Bi2WO6进行改性[14-15]。因此,作者制备了一种高比表面积、高活性金属改性的Ag-rGO/Bi2WO6光催化剂,考察了形貌等特征,并以罗丹明B(Rh B)为目标化合物配制有机染料废水来考察其脱氮性能。
1 实验部分
1.1 试剂与仪器
Bi(NO3)3·5H2O:分析纯,北京化工厂;Na2WO4·2H2O、Ag NO3、无水乙醇:分析纯,天津市科密欧化学试剂有限公司;罗丹明B:分析纯,上海化学试剂有限公司;天然鳞片石墨:150 μm,湖南国盛石墨科技有限公司。
X射线能谱仪:DMAX-2000,日本理学公司;扫描电镜:EVOMA25,德国卡尔蔡司;紫外-可见分光光度计:UV-2550,Shimadzu公司;光催化反应仪:BL-GHX-9,上海比朗仪器有限公司。
1.2 Bi2WO6纯体催化剂的制备
称取0.824 6 g(0.002 5 mol)Na2WO6·2 H2O加入15 m L去离子水,磁力搅拌30 min,称取2.425 g(0.005 mol)Bi(NO3)3·5H2O加入15 m L去离子水,磁力搅拌30 min。将搅拌后的Na2WO6·2 H2O溶液逐滴加入到Bi(NO3)3·5 H2O溶液中,形成白色前驱体,磁力搅拌30 min。将混合液转移到高压反应釜中,反应温度为180℃,反应时间为20 h,反应结束后多次抽滤,并用乙醇、去离子水洗涤,65℃干燥研磨备用。
1.3 载体氧化石墨烯的制备
以磷片石墨为原料,通过改进的Hummers法制备氧化石墨,具体制备过程如下:在三口烧瓶中加入1.0 g鳞片石墨,加入浓H2SO475 m L,冰水浴反应2 h,缓慢加入3.0 g高锰酸钾,40℃水浴条件下磁力搅拌反应2 h;继续加热到95℃的油浴中,反应30 min后,缓慢加入质量分数为15%的H2O2还原至反应停止(无气泡产生),得到氧化石墨棕红色的混合液,离心,低浓度的HCl洗涤3次,乙醇洗至中性,60℃干燥,得到棕色固体氧化石墨。将获得的氧化石墨分散在水溶液中高功率超声处理1.5 h,得到了棕色澄清溶液的氧化石墨烯溶液。
1.4 Ag-rGO/Bi2WO6复合光催化剂的制备
在超声备用的r GO溶液中分别加入Na2WO6·2H2O和Bi(NO3)3·5H2O溶液,方法同1.2制备r GO/Bi2WO6;将配好的Ag NO3溶液逐滴加入到r GO/Bi2WO6中超声处理2h,待溶液混合均匀,进行光照处理2 h,可制备AgrGO/Bi2WO6催化剂。
1.5 光催化剂性能评价
以RhB为目标化合物配制有机染料来考察其脱氮性能。光催化反应在500 W氙灯光照下,光催化反应仪中光催化反应后,离心,紫外可见分光光度计(λ=554 nm处)检测混合液吸光度的变化,由此来评价催化剂的脱氮性能。
2 结果与讨论
2.1 Ag-rGO/Bi2WO6光催化剂的表征分析
2.1.1 改性后Bi2WO6的XRD分析
不同方法改性后的Bi2WO6XRD谱图见图1。
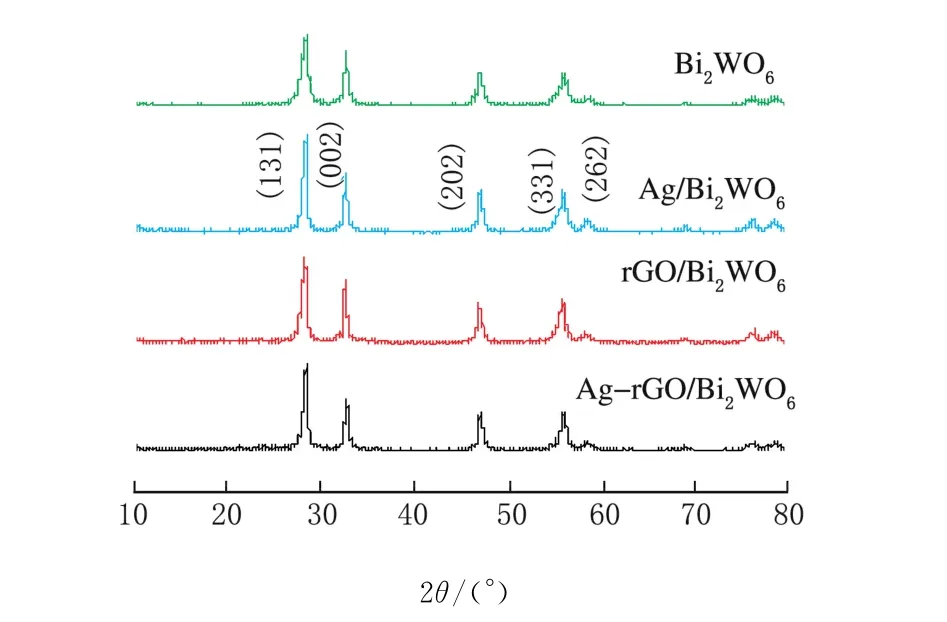
图1 不同方法改性后的Bi2WO6XRD谱图
从图1可以看出,实验制备的Bi2WO6、Ag/Bi2WO6、r GO/Bi2WO6以 及 Ag-rGO/Bi2WO6催化剂都出现了相似的衍射峰,其均为纯态的正交晶系结构,其衍射峰与斜方晶型Bi2WO6型相一致(JCPDS No.39-0256)。掺杂改性前后对比可知,主峰位置对应,其衍射峰仍比较尖锐,结晶度都比较好,说明载体石墨烯以及活性金属助剂Ag的加入对样品晶型影响比较小。
2.1.2 改性后Bi2WO6的SEM图分析
改性后Bi2WO6的SEM图见图2。
由图2可以看出,纯Bi2WO6是由无数二维纳米片自组装成的三维鸟巢状结构,纳米片堆积的较紧密,颗粒规整。作者自制的r GO片层较薄,能够提供预期的高比表面积;当对其进行r GO及Ag改性后,Bi2WO6鸟巢状结构遭到不同程度的破坏,纳米片分散、疏松。特别是同时加入两种后Bi2WO6球体被完全破坏,二维极薄的纳米片分散度进一步增加,且分散沉积在r GO片层上,进而比表面积得到大大地增加,说明极薄的片层r GO结构能够为Bi2WO6的结晶及生长提供位点,阻止了Bi2WO6二维纳米片的紧密堆积及颗粒的团聚现象,使得纳米片变薄变得更加松散,因此,在一定程度上将有利于光催化活性的提高。

图2 改性后Bi2WO6的SEM图
2.1.3 Ag-rGO/Bi2WO6的比表面积及孔径分布
改性后的催化剂的N2吸附-脱附等温线见图3。
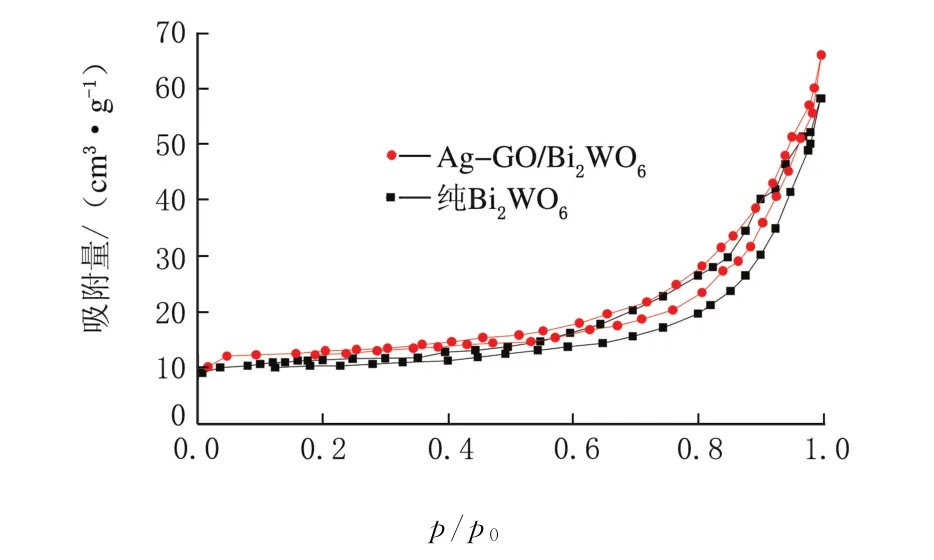
图3 N2吸附-脱附等温线
由图3可以看出,在p/p0=0.5~0.9区域出现明显的滞后环,该等温线属于典型的IV型吸附曲线,说明该催化剂属于介孔结构材料,这一结构有利于污染有机物在催化剂表面的吸附,从而能够提高光催化活性。
催化剂粒径分布情况见图4。

图4 催化剂粒径分布情况
由图4的孔径分布曲线可以看出,改性后的Ag-rGO/Bi2WO6孔径较纯Bi2WO6粒径小,主要集中在2~5 nm,两者的比表面积大小分别为37.86、25.73 m2/g。这一结论正与之前表征的SEM结果一致。进一步说明了Ag-r GO/Bi2WO6的表面吸附能力大大高于纯Bi2WO6的表面吸附能力。因此,适量的Ag以及r GO能够抑制Bi2WO6的晶粒生长,增加比表面积。
2.2 Ag-rGO/Bi2WO6的光催化性能测试
2.2.1 不同Ag+掺杂量的样品光催化性能
通过500 W氙灯的可见光照射,降解c(RhB)=0.5×10-5mol/L的溶液来考察Ag+改性的r GO/Bi2WO6的光催化性能。不同掺杂量的样品光催化性能见图5。
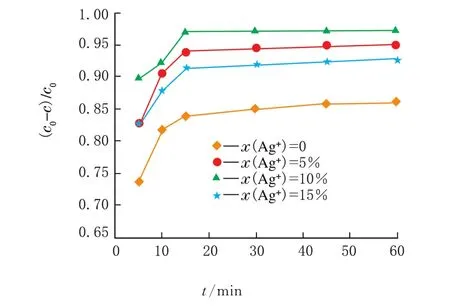
图5 不同x(Ag+)对样品的光催化性能影响
从图5可以看出,由Ag+掺杂的样品催化能力较r GO/Bi2WO6样品有明显提高。其中,10%时,光催化效果最好。由此推断,Ag+掺杂能有效提高钨酸铋的光催化活性。分析原因可能为:Ag+的加入不仅抑制了晶粒的增长,大大提高了比表面积,提高了表面吸附能力,同时也抑制了光生电子-空穴的复合,提高了其利用率。但是当Ag+掺杂量过多时,中心的有效活性位减少,光能利用率降低,从而使得催化剂的催化性能降低。因此确定最佳x(Ag+)=10%,Rh B最终降解率达到95%。
2.2.2 不同m(催化剂)的样品光催化性能
在最佳的x(Ag+)=10%条件下,在相同浓度、相同体积RhB模拟液中加入不同催化剂进行光催化脱氮实验见图6。
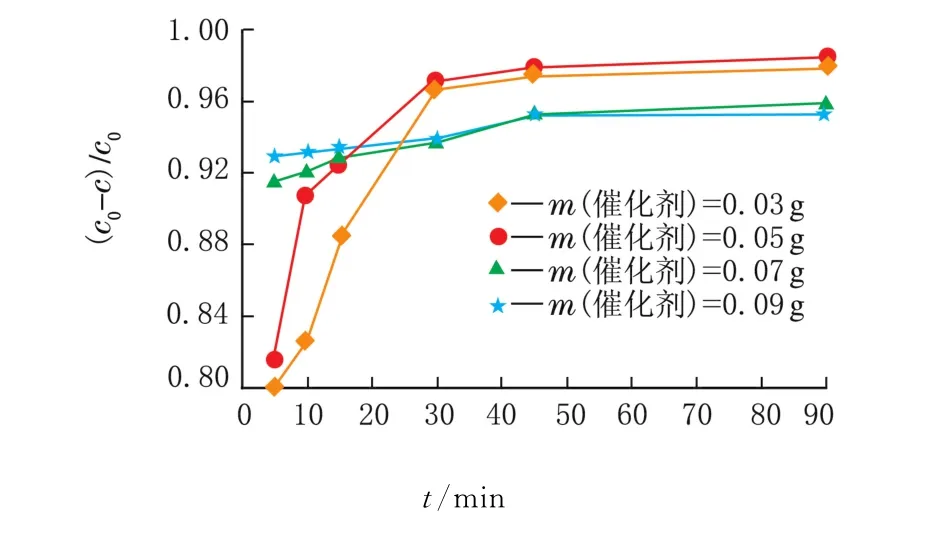
图6 不同m(催化剂)的光催化性能测试
从图6可以看出,不同m(催化剂)下RhB的降解率不同,最佳用量为m(催化剂)=0.05 g,最终降解率达到98%。当过量的催化剂使用时,形成的悬浮液浓度过大会降低可见光透过率,因此光催化活性降低。
2.2.3 不同c(RhB)的光催化性能
在上述最佳实验条件下,进一步考察溶液中的不同c(RhB)对其光催化性的影响,结果见图7。
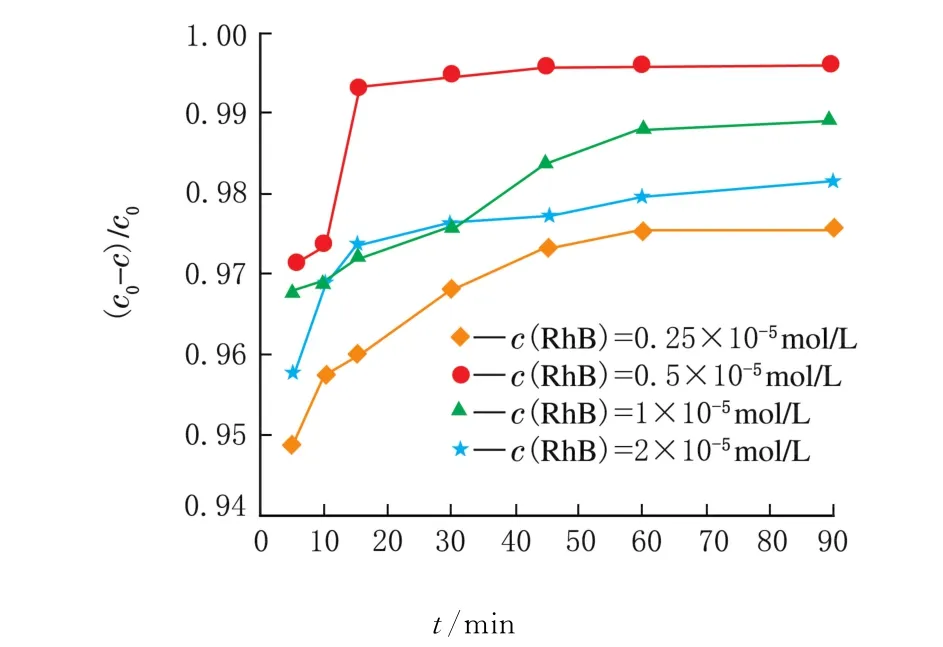
图7 不同c(RhB)的光催化性能测试
由图7可知,当c(Rh B)=0.5×10-5mol/L时降解率最高,这可以理解为当c(RhB)较低时,活性位点相对多,吸附脱附平衡效率高,光催化利用率高,光催化降解30 min降解率达99.5%。继续增大模拟液染料浓度,活性位点相对较少,吸附脱附平衡效率低,光催化降解速率减。因此最佳模拟液c(RhB)=0.5×10-5mol/L。
2.2.4 不同V(H2O2)的光催化性能
在上述最佳条件下,分别向RhB溶液中加入了0.5、1、2、3 m L的 H2O2,Ag掺杂的 Bi2WO6对罗丹明的降解率随时间的变化曲线见图8。
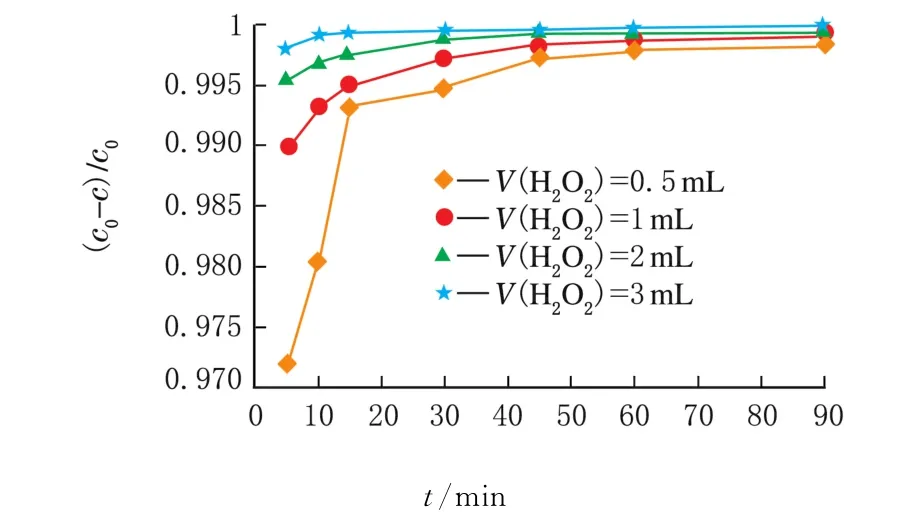
图8 不同V(H2O2)对催化剂光催化性能的影响
由图8可知,在同一c(RhB)和m(催化剂)但V(H2O2)不同时,降解率会有明显的不同,与未添加H2O2相比脱氮率明显加快。这是因为H2O2的添加,产生了更多的具有强氧化能力的·OH,同时作为电子的受体,有效抑制了催化剂表面电子-空穴对的复合。双氧水添加量越多,降解率越大,当V(H2O2)=3 m L时,罗丹明的降解率最大。
3 结 论
作者采用分步水热法制备Ag-r GO/Bi2WO6纳米粉末,对优化后催化剂进行形貌结构的表征,考察了Ag-r GO/Bi2WO6光催化脱氮效果,得出如下结论。
(1)通过X射线衍射(XRD)、扫描电镜(SEM)、表面积孔隙度测定(BET)等手段对所合成催化剂的形貌结构进行考察可知,适量的Ag+以及r GO对Bi2WO6掺杂后催化剂的晶体结构并未发生明显改变,但Bi2WO6鸟巢状结构遭到不同程度的破坏,纳米片分散、疏松。颗粒孔径变小,变均匀,比表面积增大,特别是活性金属Ag+的掺杂有效地抑制了光生电子的复合,在一定程度上将有利于光催化活性的提高;
(2)改性的Ag-r GO/Bi2WO6光催化轻质油脱氮反应的最优条件为:x(Ag+)=10%,m(催化剂)=0.05 g,c(RhB)=0.5×10-5mol/L,V(H2O2)=3 m L时最高降解率达99.5%,说明改性后的光催化活性大大提高。
[1] DING M L,HAN J,QIU W,et al.Recovery of silver metal from low concentrated wastewater by photocatalysis[J].International Journal of Modern Physics B,2015,29(10/11):154-158.
[2] MARTÍNEZ F,LÓPEZ-MUÑOZ M J,AGUADO J,et al.Coupling membrane separation and photocatalytic oxidation processes for the degradation of pharmaceutical pollutants[J].Water Research,2013,47(15):5647-5658.
[3] KUMAR S,SURENDAR T,BARUAH A,et al.Synthesis of a novel and stable gC3N4-Ag3PO4hybrid nanocomposite photocatalyst and study of the photocatalytic activity under visible light irradiation[J].Journal of Materials Chemistry A,2013,1(17):5333-5340.
[4] XIAO X,HU R,LIU C,et al.Facile microwave synthesis of novel hierarchical Bi24O31Br10nanoflakes with excellent visible light photocatalytic performance for the degradation of tetracycline hydrochloride[J].Chemical Engineering Journal,2013,225:790-797.
[5] JI K,DAI H,DENG J,et al.3DOM BiVO4supported silver bromide and noble metals:High-performance photocatalysts for the visible-light-driven degradation of 4-chlorophenol[J].Applied Catalysis B:Environmental,2015,168:274-282.
[6] JIANG H Y,LIU G,LI M,et al.Efficient organic degradation under visible light byα-Bi2O3with a Cu Ox-assistant electron transfer process[J].Applied Catalysis B:Environmental,2015,163:267-276.
[7] WANG Z,YOSHINAGA K,BU X R,et al.Low temperature fabrication&photocatalytical activity of carbon fiber-supported TiO2with different phase compositions[J].Journal of hazardous materials,2015,290:134-141.
[8] LI Y,LIU C,XU P,et al.Controlled fabrication of ordered mesoporous titania/carbon fiber composites with high photoactivity:synergistic relationship between surface adsorption and photocatalysis[J].Chemical Engineering Journal,2014,243:108-116.
[9] YANG H P,HU H L,NI Z H,et al.Comparison of surfaceenhanced Raman scattering on graphene oxide,reduced graphene oxide and graphene surfaces[J].Carbon,2013,62:422-429.
[10]BHUSHAN G,PIA D,CARITA K.Graphene vs.reduced graphene oxide:A comparative study of graphene-based nanoplatforms on electrochromic switching kinetics[J].Carbon,2016,96:377-381.
[11]WANG R,YANG R,WANG B,et al.Efficient degradation of methylene blue by the nano TiO2-functionalized graphene oxide nanocomposite photocatalyst for wastewater treatment[J].Water,Air,&Soil Pollution,2016,227(1):1-9.
[12]ULLAH K ,ALI A,YE S,et al.Microwave-assisted synthesis of Pt-graphene/TiO2nanocomposites and their efficiency in assisting hydrogen evolution from water in the presence of sacrificial agents[J].Science of Advanced Materials,2015,7(4):606-614.
[13]DUTTA S,SAHOO R,RAY C,et al.Biomolecule-mediated CdS-TiO2-reduced graphene oxide ternary nanocomposites for efficient visible light-driven photocatalysis[J].Dalton Transactions,2015,44(1):193-201.
[14]YOO S M,RAWAL S B,LEE J E,et al.Size-dependence of plasmonic Au nanoparticles in photocatalytic behavior of Au/TiO2and Au@SiO2/TiO2[J].Applied Catalysis A:General,2015,499:47-54.
[15]ROGERS H M,WHITE T A,STONE B N,et al.Nonchromophoric halide ligand variation in polyazine-bridged Ru(II),Rh(III)bimetallic supramolecules offering new insight into photocatalytic hydrogen production from water[J].Inorganic Chemistry,2015,54(7):3545-3551.

