高速逆流色谱法分离红葡萄皮中的花色苷
李媛媛,李灵犀,,崔艳,孙宝山*
(1.沈阳药科大学药学院,辽宁沈阳110016;2.沈阳药科大学功能食品与葡萄酒学院,辽宁沈阳110016)
高速逆流色谱法分离红葡萄皮中的花色苷
李媛媛1,李灵犀1,2,崔艳2,孙宝山2*
(1.沈阳药科大学药学院,辽宁沈阳110016;2.沈阳药科大学功能食品与葡萄酒学院,辽宁沈阳110016)
建立高速逆流色谱(HSCCC)法分离制备红葡萄皮中花色苷单体的方法。以乙腈-正丁醇-甲基叔丁基醚-水-三氟乙酸(1∶40∶1∶50∶0.01,V/V)为溶剂体系,上相(有机相)为固定相,下相(水相)为流动相,流速为2.0 mL/min,转速为950 r/min,进样量为200 mg,分离得到的组分利用紫外-可见(UV)光谱和液质联用(HPLC-MS)技术进行定性分析。结果表明,经过一次高速逆流分离即可得到3种花色苷单体,分别为飞燕草色素-3-O-葡萄糖苷、锦葵色素-3-O-葡萄糖苷和芍药色素-3-O-葡萄糖苷,高效液相色谱(HPLC)峰面积归一法计算其纯度分别为93.7%、95.2%、91.6%。采用高速逆流色谱法成功从红葡萄皮中一次性分离得到3种高纯度的花色苷单体,其中芍药色素-3-O-葡萄糖苷为首次分离得到。
红葡萄皮;花色苷;高速逆流色谱;分离
近年来,植物花色苷所表现出的多种生物活性引起了人们的广泛关注[1-4],特别是随着食用合成色素暴露出的慢性毒性、致癌等问题[5-7],从葡萄皮等天然植物中提取天然无害的食用色素已成为食品科学研究中的重要课题。大量的研究表明,从植物中提取得到的花色苷具有很好的抗氧化、抗癌、抗炎、抑菌、降血脂等生物活性[8-12]。然而这些花色苷生物活性的研究多来自于花色苷粗提物,有关花色苷单体生物活性的研究却相对较少。由于花色苷粗提物中的成分比较复杂,既含有花色苷单体化合物又含有原花青素、酚酸、白藜芦醇等其他多酚类化合物[13]。这些多酚类化合物同样也具有很强生物活性,这就导致有关花色苷生物活性的研究结果存在不确定性,相应的作用机制也就不能够被进一步阐明[14-15]。另外,由于国内市场上花色苷标准品的缺乏,目前有关花色苷定量分析的研究仍采用pH示差法测量其总花色苷含量,而非花色苷单体的含量[16]。因此,找到一种快速有效的分离方法来大量制备花色苷单体显得尤为重要。但花色苷结构的相似性和复杂性,使得硅胶色谱等传统分离技术难以大规模分离得到高纯度的花色苷单体[17-19]。高速逆流色谱(high-speedcountercurrent chromatography,HSCCC)作为一种新兴的分离技术,具有操作简便、制备量大、无不可逆吸附等特点,被广泛用于天然活性成分的分离[20-23]。本研究建立了高速逆流分离制备红葡萄皮中3种主要花色苷单体的方法,能够有效快速有效的分离制备出高纯度的花色苷单体化合物,有助于今后进一步对花色苷单体生物活性的研究以及富含花色苷产品的质量标准的建立。
1 材料与方法
1.1 材料与试剂
红葡萄皮多酚提取物:宁波北仑康正生物技术有限公司;对照品飞燕草色素-3-O-葡萄糖苷、锦葵色素-3-O-葡萄糖苷、芍药色素-3-O-葡萄糖苷:上海西宝生物科技有限公司。
乙腈、甲醇(均为色谱纯)、正丁醇、甲基叔丁基醚、乙腈、三氟乙酸(均为分析纯):山东禹王集团。
1.2 仪器与设备
TBE-300B高速逆流色谱仪:上海同田生化技术有限公司;TBP-5002输液泵、UV-2000D紫外检测器:上海三为科学仪器有限公司;DC-0506低温恒温槽:上海同田生化技术有限公司;Alliance e2695高效液相色谱仪(配2998PDA检测器):美国Waters公司;BSA124S电子天平:北京赛多利斯科学仪器有限公司;RE-52A旋转蒸发仪:上海亚荣生化仪器厂;KQ-300DB数控超声波清洗器:昆山市超声仪器有限公司;LTQ Orbitrap XL ETD液相色谱质谱联用仪:赛默飞世尔科技公司。
1.3 方法
1.3.1 样品预处理
称取红葡萄皮多酚提取物400 mg,置于具塞锥形瓶中,加入HSCCC溶剂体系乙腈-正丁醇-甲基叔丁基醚-水-三氟乙酸(1∶40∶1∶50∶0.01,V/V)的有机相150 mL,超声(100 W、40℃)提取10 min,过滤,重复上述操作,合并滤液,滤液经35℃减压浓缩后真空冷冻干燥(-60℃、24 h),得到花色苷粗提物,干燥保存备用。
1.3.2 高速逆流色谱分离
以乙腈-正丁醇-甲基叔丁基醚-水-三氟乙酸(1∶40∶1∶50∶0.01,V/V)为溶剂体系,充分混合,静置分层,超声脱气10 min,上相(有机相)为固定相,下相(水相)为流动相。先以35 mL/min的流速泵入固定相,待固定相充满管道后,打开主机调整转速为950 r/min,主机正转,温度为25℃,以2.0 mL/min的流速泵入流动相,当流动相从主机出口流出后进样(200 mg的花色苷粗提物溶于20 mL的下相),检测波长280 nm。根据峰形手动收集组分A、B、C、D、E,35℃真空浓缩后冷冻干燥。
1.3.3 纯度测定与组分鉴定
(1)紫外-可见光谱分析
高速逆流分离所得的组分用0.2%甲酸水溶解,分别在波长250~600 nm范围内进行扫描,分析其光谱特征。
(2)HPLC分析
高效液相色谱条件:Innoval C18色谱柱(5 μm,4.6 mm× 250 mm),检测波长525 nm,柱温:30℃,流速:0.5 mL/min,洗脱溶剂A为0.2%甲酸水溶液,B为0.2%甲酸乙腈溶液。梯度洗脱条件:0 min,5.4%B;59 min,14.1%B;60 min,20% B;80 min,27%B。峰面积归一化法的纯度计算公式为:
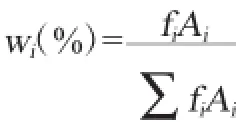
式中:wi、fi、Ai分别为待测组分i的峰面积百分数、校正因子和峰面积。
(3)苄硫醇水解
称取6mg的样品粉末,加入1mL的甲醇溶解。取0.5mL的样品溶液加入至0.5 mL的5%苄硫醇溶液中(0.2 mol/L盐酸酸化),密封,90℃反应2 min,冷水浴终止反应,过滤,进行高效液相色谱分析。
(4)液质联用分析
色谱条件:WatersSymmetryC18色谱柱(5 μm,4.6 mm× 250 mm),检测波长525 nm,柱温:30℃,流速:0.5 mL/min,洗脱溶剂A为0.2%甲酸水溶液,B为0.2%甲酸乙腈溶液。梯度洗脱条件为:0 min,5.4%B;59 min,14.1%B;60 min,20%B;80 min,27%B。
质谱条件:电喷雾(electronic spray ion,ESI)离子源;喷射电压4 kV;毛细管温度400℃;毛细管电压17 V;干燥气体流速16.7 L/min;辅助气体流速3.3 L/min,扫描质量范围:200~1 500 m/z,正离子模式。
(5)定性分析
高效液相定性:按照高效液相色谱(high performance liquid chromatography,HPLC)分析方法,通过对比组分和标准品的保留时间以及标准加入法对组分进行初步定性。
液质联用定性:按照液质联用分析方法,通过对比组分的质谱数据和文献的质谱数据来进一步的进行定性。
2 结果与分析
2.1 提取条件的确定
红葡萄皮多酚提取物中除花色苷外还含有大量的非目标组分,实验发现,直接以该提取物作为HSCCC进样原料时,这些非目标组分将严重影响分离效果,降低分离效率,因此应将其尽可能减少或除去。关于花色苷类物质的提取方法,常见的主要有:溶剂萃取法、超临界流体萃取法、超声波辅助提取法和酶法等[24]。本研究中采用超声波辅助提取法对红葡萄皮中花色苷的提取方法进行优化,以确定最佳提取工艺。
据文献报道花色苷在酸性条件下的提取率较高,且酸有助于保持花色苷的稳定性[25-26]。本研究在文献的基础上,考察了酸化乙醇和酸化甲醇两种溶剂体系[27-28]。HPLC峰面积百分含量分析结果表明,提取液中花色苷的含量分别为15.3%和17.9%,但是相应的杂质峰的种类也较多,影响花色苷的进一步分离;进而选择HSCCC溶剂体系的上相作为提取溶剂,结果发现提取液中花色苷的百分含量为19.4%,相应的杂质峰较少,此时经HSCCC进样后也可获得较好的分离效果。因此,本实验最终选择HSCCC溶剂体系的上相作为提取溶剂来对红葡萄皮中的花色苷进行提取。该方法与传统的提取工艺相比,对花色苷的提取率更高。
2.2 高速逆流色谱(HSCCC)分离
按照1.3.2的方法,以乙腈-正丁醇-甲基叔丁基醚-水-三氟乙酸(1∶40∶1∶50∶0.01,V/V)为溶剂体系,经过HSCCC分离,共分离得到5个组分,结果如图1所示。由图1可知,测得下固定相保留率为41.7%,说明该体系可行。从200mg葡萄皮粗提物中分离得到组分A(31.8 mg)、B(17.4 mg)、C(0.9 mg)、D(5.9 mg)、E(3.3 mg)。
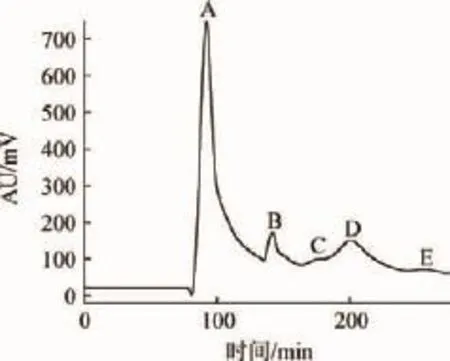
图1 高速逆流色谱法分离红葡萄皮花色苷的色谱图Fig.1 HSCCC chromatogram of anthocyanins separated from the red grape skins
2.3 紫外-可见光谱分析
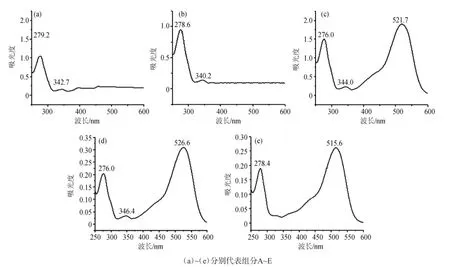
图2 高速逆流色谱法分离红葡萄皮花色苷中组分的紫外光谱图Fig.2 Ultraviolet spectrogram of the anthocyanins components separated from red grape skins by HSCCC
花色苷是黄酮类化合物,在波长280 nm与520 nm左右有特征吸收峰,而其他类黄酮化合物(如黄酮、黄酮醇、黄烷酮等)在波长300~400 nm和240~280 nm的紫外区有吸收[29],因此可将在波长280 nm和520 nm左右有无特征吸收作为判断是否为花色苷类物质的依据。
由图2可知,组分A在279.2 nm和342.7 nm有吸收,组分B在278.6 nm和340.2 nm有吸收,二者均在520 nm处没有吸收,故推测组分A、B为非花色苷类化合物。组分C在276.0 nm和521.7 nm有特征吸收、组分D在276.0 nm和 526.6 nm有特征吸收、组分E在278.4 nm和515.6 nm有特征吸收,故推测组分C、D、E为花色苷类化合物。
2.4 HPLC分析
采用SPRANGER I等[30]建立的苄硫醇水解方法,对组分A、B水解后经HPLC分析计算得出其聚合度分别为7.6±0.2和6.2±0.1,由此确定组分A、B为多聚体。
采用高效液相色谱峰面积归一法,对组分C、D、E 3个组分进行纯度检测分析,结果见图3。根据峰面积计算出组分C、D、E的纯度分别为93.7%、95.2%、91.6%。
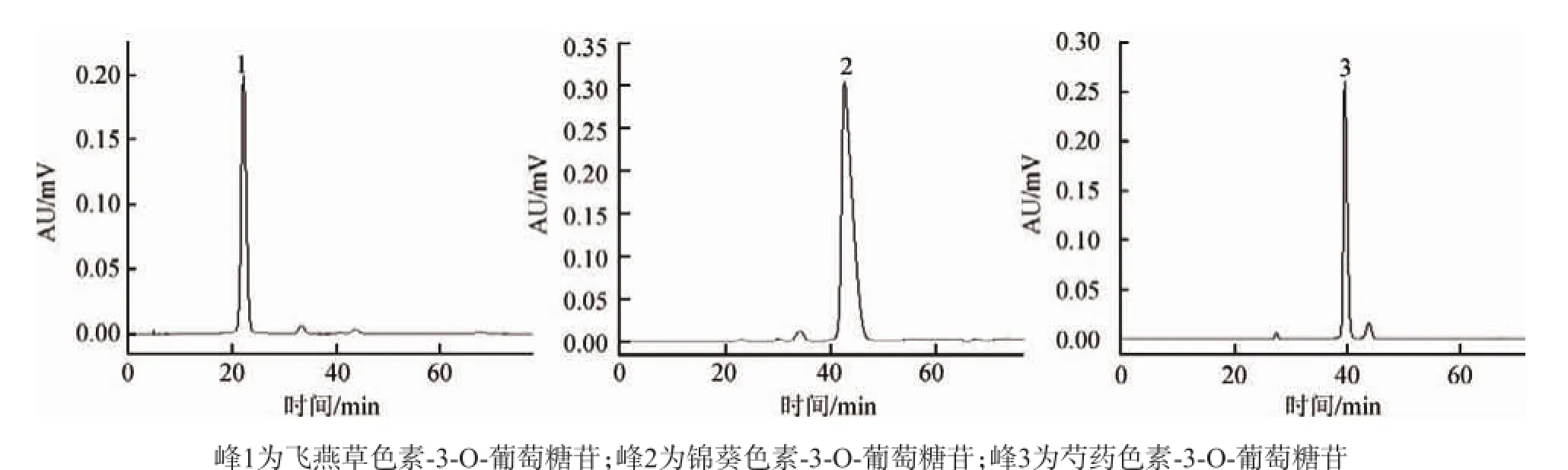
图3 高速逆流色谱法分离红葡萄皮花色苷中组分的HPLC色谱图Fig.3 HPLC chromatograms of the anthocyanins components separated from red grape skins by HSCCC
2.5 分离组分鉴定
采用液质联用在正离子模式下对HSCCC分离得到的三个组分进行鉴定,并对目标离子进行二级质谱分析,结合文献报道以及与对照品对比保留时间和特征吸收波长,最终确定这3个花色苷单体,结果见表1。
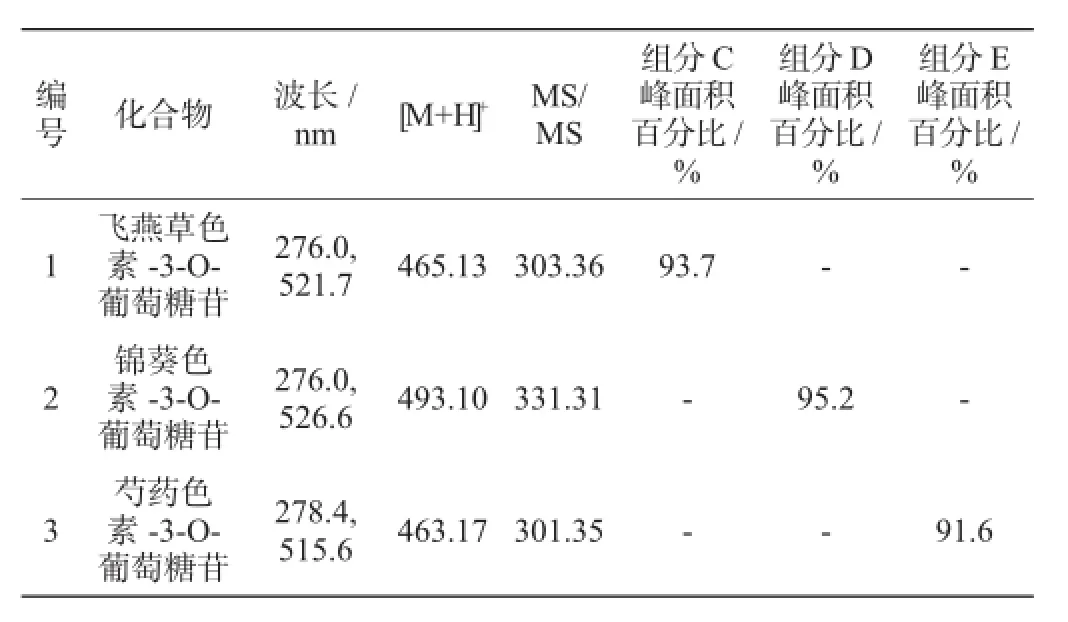
表1 高速逆流色谱法分离红葡萄皮花色苷中组分鉴定结果Table 1 Identification results of the anthocyanins components separated from red grape skins by HSCCC
由表1可知,组分C的一级质谱中(ESI+)分子离子峰m/z为465.13,二级质谱中碎片离子为m/z303.36。[M-162+H]+,是分子离子峰失去3-O位上结合的糖基所得的碎片,推测为飞燕草色素-3-O-葡萄糖苷。经过进一步与标准品对比,确认化合物为飞燕草色素-3-O-葡萄糖苷(delphinidin-3-O-glucoside)。上述质谱信息与文献对比结果基本一致[31-32]。
组分D的一级质谱中(ESI+)分子离子峰m/z为493.10,二级质谱中碎片离子为m/z 331.31。[M-162+H]+,是分子离子峰失去3-O位上结合的糖基所得的碎片,推测为锦葵色素-3-O-葡萄糖苷。经过进一步与标准品对比,确认化合物为锦葵色素-3-O-葡萄糖苷(malvidin-3-O-glucoside)。上述质谱信息与文献对比结果基本一致[31-32]。
组分E的一级质谱中(ESI+)分子离子峰m/z为463.17,二级质谱中碎片离子为m/z 301.35。[M-162+H]+,是分子离子峰失去3-O位上结合的糖基所得的碎片,推测为芍药色素-3-O-葡萄糖苷。经过进一步与标准品对比,确认化合物为芍药色素-3-O-葡萄糖苷(peonidin-3-O-glucoside)。上述质谱信息与文献对比结果基本一致[31-32]。
3 结论
本研究通过对提取溶剂的考察,采用高速逆流溶剂体系的上相作为提取溶剂来提取红葡萄皮中的花色苷组分,与传统的提取工艺相比,提取液中花色苷的百分含量由15.3%(酸化乙醇)和17.9%(酸化甲醇)增加至19.4%,对花色苷的提取率更高。
与传统的分离方法相比,本研究建立的HSCCC分离方法,可得到飞燕草色素-3-O-葡萄糖苷、锦葵色素-3-O-葡萄糖苷和芍药色素-3-O-葡萄糖苷分别为93.7%、95.2%、91.6%的花色苷单体化合物。
对于传统的柱色谱分离来说,多聚体与花色苷的分离一直是个难点,本实验中利用HSCCC可以有效的实现两者的分离,有助于今后对多聚体的深入研究。
[1]TABART J,KEVERS C,PINCEMAIL J,et al.Comparative antioxidant capacities of phenolic compounds measured by various tests[J].Food Chem,2009,113(4):1226-1233.
[2]TSAI P J,HUANG H P.Effect of polymerization on the antioxidant capacityofanthocyaninsinRoselle[J].Food Res Int,2004,37(4):313-318.
[3]HE J,GIUSTI M M.Anthocyanins:natural colorants with health-promoting properties[J].Annu Rev Food Sci Technol,2010,1:163-187.
[4]WALLACE T C.Anthocyanins in cardiovascular disease[J].Adv Nutr, 2011,2(1):1-7.
[5]BAO J,CAI Y,SUN M,et al.Anthocyanins,flavonols,and free radical scavenging activity of Chinese bayberry(Myrica rubra)extracts and their color properties and stability[J].J Agr Food Chem,2005,53(6):2327-2332.
[6]HULI H S,CHAUDHARY P,BENIWAL V,et al.Microbial pigments as natural color sources:current trends and future perspectives[J].J Food Sci Technol,2015,52(8):4669-4678.
[7]AMIN K A,HAMEID H A,ELSTTAR H A.Effect of food azo dyes tartrazine and carmoisine on biochemical parameters related to renal,hepatic function and oxidative stress biomarkers in young male rats[J].Food Chem Toxicol,2010,48(10):2994-2999.
[8]MA T,HU N,DING C,et al.In vitroandin vivobiological activities of anthocyanins fromNitraria tangutorunBobr.fruits[J].Food Chem,2016, 194:296-303.
[9]王超.蓝莓酒渣花色苷的提取及抗氧化活性研究[D].大庆:黑龙江八一农垦大学,2015.
[10]吴涛.花色苷对肥胖的干预及其相关机理的研究[D].杭州:浙江大学,2014.
[11]韩永斌,朱洪梅,顾振新,等.紫甘薯花色苷色素的抑菌作用研究[J].微生物学通报,2008,35(6):913-917.
[12]王全逸.马铃薯多酚类化合物对结肠癌和肝癌细胞增殖的影响及花色苷生物合成关键酶基因的研究[D].南京:南京农业大学,2010.
[13]沈伟,孙晓杰,张秀桥,等.大叶蛇葡萄化学成分研究[J].时珍国医国药,2010(4):866-867.
[14]李焱.刺葡萄籽原花青素的提纯与其抗衰老功能评价[D].长沙:湖南农业大学,2013.
[15]成智涛.刺葡萄籽原花青素提取、提纯及其抗氧化性的研究[D].长沙:湖南农业大学,2007.
[16]唐琳,李子江,赵磊,等.两种pH值法测定玫瑰花花色苷含量的比较[J].食品科学,2009,30(18):310-313.
[17]WANG E,YIN Y,XU C,et al.Isolation of high-purity anthocyanin mixtures and monomers from blueberries using combined chromatographic techniques[J].J Chromatogr A,2014,1327:39-48.
[18]王维茜,邓洁红,刘永红.半制备型高效液相色谱法分离刺葡萄花色苷单体[J].食品科学,2016,37(18):71-76.
[19]张素敏,隋洪涛,隋韶奕,等.葡萄花色苷的研究进展及应用前景[J].北方果树,2007(3):1-3.
[20]YANG Y,HUANG Y,GU D,et al.Separation and purification of three flavonoids fromHelichrysum arenarium(L)Moench by HSCCC[J]. Chromatographia,2009,69(9-10):963-967.
[21]CAO X,WANG C,PEI H,et al.Separation and identification of polyphenols in apple pomace by high-speed counter-current chromatography and high-performance liquid chromatography coupled with mass spectrometry[J].J Chromatogry A,2009,1216(19):4268-4274.
[22]陆英,李佳银,罗晋,等.高速逆流色谱制备分离紫甘薯花色苷[J].分析化学,2011,39(6):851-856.
[23]刘雪辉,王振,吴琪,等.高速逆流色谱法分离玫瑰茄中的花色苷[J].现代食品科技,2014,30(1):190-194.
[24]米佳,闫亚美,曹有龙,等.花色苷类物质的提取,分离,鉴定[J].宁夏农林科技,2016,57(1):40-47.
[25]孙建霞,张燕,胡小松.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学,2009,42(3):996-1008.
[26]邓洁红.刺葡萄皮色素的研究[D].长沙:湖南农业大学,2007.
[27]赖剑峰,杨荣玲,林耀盛,等.杨梅花色苷分离纯化制备矢车菊素-3-葡萄糖苷的研究[J].热带作物学报,2013,34(7):1354-1358.
[28]孙荣琴,郭华春.七个紫甘薯品种块根花色苷含量的比较[J].作物杂志,2008,6(1):56-59.
[29]王卫东,李超,许时婴.高效液相色谱-串联质谱法分离鉴定黑莓花色苷[J].食品科学,2009,30(14):230-234.
[30]SPRANGER I,SUN B,MATEUS A M,et al.Chemical characterization and antioxidant activities of oligomeric and polymeric procyanidin fractions from grape seeds[J].Food Chem,2008,108(2):519-532.
[31]WU X,PRIOR R L.Systematic identification and characterization of anthocyanins by HPLC-ESI-MS/MS in common foods in the United States:fruitsandberries[J].J Agr Food Chem,2005,53(7):2589-2599.
[32]POMAR F,NOVO M,MASA A.Varietal differences among the anthocyanin profiles of 50 red table grape cultivars studied by high performance liquid chromatography[J].J Chromatogr A,2005,1094(1):34-41.
Isolation of anthocyanins from red grape skins by high-speed countercurrent chromatography
LI Yuanyuan1,LI Lingxi1,2,CUI Yan2,SUN Baoshan2*
(1.School of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110016,China; 2.School of Functional Food and Wine,Shenyang Pharmaceutical University,Shenyang 110016,China)
The method for separation and preparation of anthocyanin monomers from red grape skins by high-speed countercurrent chromatography (HSCCC)was established.Using acetonitrile-n-butyl alcohol-methyl tert-butyl ether(MTBE)-water-trifluoroacetic acid(TFA)(1∶40∶1∶50∶0.01,V/V) as solvent system,upper-phase(organic phase)as stationary phase and lower phase(water phase)as mobile phase,with the flow rate of 2 ml/min,rotation speed of 950 r/min and sample injection of 200 mg,the compounds obtained were identified by ultraviolet-visible(UV)spectroscopy and high performance liquid chromatography-mass spectrometry(HPLC-MS)for qualitative analysis.The results showed that the major anthocyanins were delphinidin-3-O-glucoside,malvidin-3-O-glucoside and peonidin-3-O-glucoside.They were successfully separated one from another through HSCCC with the purity of 93.7%,95.2%and 91.6%,respectively.Three anthocyanins monomers with high purity were successfully one-time separated from red grape skins by HSCCC and the compound of peonidin-3-O-glucoside was firstly isolated in this work.
red grape skins;anthocyanins;high-speed countercurrent chromatography;separation
R28
0254-5071(2017)02-0157-05
10.11882/j.issn.0254-5071.2017.02.034
2016-11-08
辽宁省科技厅引进海外研发团队专项资金(辽外专2011-5号)
李媛媛(1991-),女,硕士研究生,研究方向为葡萄与葡萄多酚。
*通讯作者:孙宝山(1962-),男,教授,博士,研究方向为葡萄与葡萄酒科学。

