水牛乳中可培养乳酸菌多样性分析
谢芳,杨承剑*,杨小梅,唐艳,曾庆坤
(中国农业科学院广西水牛研究所,广西南宁530001)
水牛乳中可培养乳酸菌多样性分析
谢芳,杨承剑*,杨小梅,唐艳,曾庆坤
(中国农业科学院广西水牛研究所,广西南宁530001)
采用传统分离培养方法,从三品杂交生水牛奶混合样品中,分离出105株乳酸菌,通过形态、生理生化、API细菌鉴定系统及16S rDNA基因序列分析方法对各菌株属种进行鉴定。16S rRNA序列分析结果显示,105株菌共分为5个属8个种,呈现较为丰富的乳酸菌多样性,具体数量分布为乳酸乳球菌21株,植物乳杆菌19株,格氏乳球菌17株,乳明串珠菌13株,食窦魏斯氏菌11株,肠膜明串珠菌8株,类肠膜魏斯氏菌6株,嗜热链球菌5株,糊精乳杆菌5株。由此可知,水牛乳中可培养乳酸菌优势菌群的主次关系为:乳酸乳球菌(Lactococcus lactis)>植物乳杆菌(Lactobacillus plantaru)>格氏乳球菌(Lactococcus garvieae)>乳明串珠菌(Leuconostoc lactis)>食窦魏斯氏菌(Weissella cibaria),此为后续开发水牛乳中优势乳酸菌资源提供了良好的理论基础。
水牛乳;可培养菌株;乳酸菌;多样性;16S rDNA
我国水牛资源丰富,主要分布在广东、广西、云南等南方十八省区,它具有较强的免疫力,迄今尚未有水牛疯牛病例报道[1]。据报道,水牛奶蛋白质、脂肪、维生素、微量元素含量均高于黑白花牛奶,且口味香醇,营养全面,在民间享有“奶中之王”的美誉[2-3],随着人们生活水平的提高,水牛奶制品也日渐成为人们消费的“新宠”。
水牛乳在其自然发酵过程中,牛乳发酵产酸,酪蛋白遇酸凝固,即成酸奶[4],而赋予酸奶独特风味和良好凝乳状态的关键微生物,便是乳酸菌,其益生性、抑菌性及发酵性一直成为国内外学者研究的热点。近年来,有文献对不同地区发酵乳制品中乳酸菌多样性进行了一些分析[5],但有关水牛乳及其发酵乳中乳酸菌多样性的研究少见报道。API(analytic products INC)鉴定系统是由法国生物-梅里埃公司生产的细菌数值分类鉴定系统,该生化鉴定是根据微生物对各种生理条件、生化指标、代谢反应进行分析,并将结果转化成软件可以识别的数据,进行聚类分析,与已知的参比菌数据库进行比较,最终对未知菌进行鉴定的一种技术。它目前有1 000种生化反应,可鉴定的细菌大于550种,是世界范围内应用最广、最受微生物科学家推崇的国际标准化产品,相较传统的生化发酵试验,快速省力[6],但仅限于可培养菌的鉴定,对于非可培养菌的鉴定有一定限制,必须结合分子生物学技术来共同完成。本研究旨在通过传统培养、API鉴定系统和16S rDNA序列分析,全面深入了解水牛乳中乳酸菌的组成及优势菌群,拟从水牛乳中分离出一些可培养的乳酸菌,将其运用到水牛发酵乳的生产开发中,所谓“源于水牛乳而用于水牛乳”,使这些安全而优质的乳酸菌资源得以保留,并为后续开发具有自主知识产权的优良乳酸菌种和益生型水牛酸乳提供理论研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
生鲜水牛乳样品3份,于实验当天取自广西水牛研究所水牛种畜场,为三品杂交[7]水牛奶,水牛品种为:巴基斯坦尼里-拉菲、印度摩拉、广西本地水牛,在取样30 min内到达实验室,将3份样品混匀过滤后进行分菌实验。
1.1.2 培养基
乳酸菌分离培养基(MRS):蛋白胨10 g,牛肉浸粉8 g,酵母浸粉4 g,葡萄糖20 g,磷酸氢二钾2.0 g,柠檬酸氢二铵2.0 g,乙酸钠5.0 g,硫酸镁0.2 g,硫酸锰0.04 g,琼脂14 g,吐温-80 1 g,蒸馏水1 000 mL。
M17琼脂培养基:大豆胨5 g,蛋白胨2.5 g,酪蛋白胨2.5 g,酵母浸粉2.5 g,牛肉浸粉5.0 g,乳糖5.0 g,抗坏血酸钠0.5 g,β-甘油磷酸钠19.0 g,硫酸镁0.25 g,琼脂12.75 g,蒸馏水1000mL,固体培养基为含20g/LCaCO3的M17培养基。
MRS肉汤培养基:酪蛋白酶消化物10 g,肉膏粉10 g,酵母膏粉4 g,柠檬酸三铵2 g,乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.05 g,磷酸氢二钾2.0 g,葡萄糖20 g,吐温-80 1.08 g,蒸馏水1 000 mL。
1.1.3 试剂
API 50 CH/API 20 E试剂条、API50 CHL培养基:法国梅里埃公司;30%过氧化氢:天津市科密欧化学试剂有限公司;G1060革兰氏染色试剂盒:北京索宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SPX-150生化培养箱:北京科伟永兴仪器有限公司;SW-CJ-1F超净工作台:苏州苏洁净化设备有限公司;YM50立式压力蒸汽灭菌器:上海三申医疗器材有限公司;HC-2518R冷冻高速离心机:BBI北京京立离心机有限公司;JD500-2型电子天平:梅特勒-托多利仪器有限公司;尼康ECLIPSE 50i正置生物显微镜:Nikon日本公司;DYCP-31DN DNA电泳槽、DYY-5稳压电泳仪:北京六一仪器厂;DK-8D电热恒温水槽:上海一恒科学仪器有限公司;FR980凝胶成像仪:上海复日科技仪器有限公司;2720 thermal cycler PCR仪:Applied Biosystems美国应用生物系统公司;Ezup柱式细菌基因组DNA抽提试剂盒:生工生物工程(上海)股份有限公司。
1.3 试验方法
1.3.1 乳酸菌的培养、分离与纯化
将生鲜水牛乳进行梯度稀释后分别涂布于改良MRS平板和含20 g/L CaCO3的M17平板上,于37℃培养24 h。挑取肉眼可见、生长较快、单个有溶钙圈的菌落进行划线、反复分离、纯化,取纯菌株进行革兰氏染色镜检、过氧化氢酶试验,根据参考文献[8-9],选取革兰氏染色阳性、过氧化氢酶试验阴性、无芽孢的菌株分别于灭菌的MRS肉汤培养基中增殖培养,将此批待选菌编号,分别取样于4℃保存和甘油管冷冻保藏备用。
1.3.2 菌种的鉴定
采用传统形态、生理生化[8-10]及16S rDNA基因序列测定[11]相结合的方式来鉴定菌株属种。
API鉴定:采用API 50CH/API20 E鉴定系统分别对乳酸菌中的杆菌和球菌进行生化鉴定,API 50CH鉴定系统专用于乳酸杆菌和相关菌的鉴定,API20 E则可以作为API50CH的补充或球菌的鉴定[12],具体操作按说明书进行。
DNA提取:使用生工Ezup柱式细菌基因组DNA抽提试剂盒,具体操作步骤详见说明书。
聚合酶链式反应(polymerasechainreaction,PCR)扩增:使用TAKARAMightyAmp□DNAPolymeraseVer.2(R071Q)进行PCR扩增,反应体系如下:10×PCR缓冲液5 μL;正、反向引物均为10 mmol/L各2.5 μL;dNTP(10 mmol/L)4 μL;基因组DNA1.0μL;TaqDNA聚合酶0.5μL;双蒸水34.5μL。PCR扩增循环参数为:98℃预变性2min;98℃变性10s,56℃退火15 s,72℃延伸2 min,共35个循环;再72℃延伸5 min。电泳:使用1%的琼脂糖凝胶电泳,电压120 V,电泳30 min,每孔上样2 μL。
1.3.3 菌种的保藏
将已筛选纯化的菌种接种到5 mL灭菌MRS肉汤培养基中,36℃摇床培养12~24 h,取800 μL的菌株培养液与400 μL 50%灭菌甘油于2 mL离心管中混匀,-80℃冷冻保藏。后续鉴定的纯菌株亦采用此法冷冻保藏。
2 结果与分析
2.1 菌株分离培养结果
根据参考文献[8-10],革兰氏染色阳性、过氧化氢酶阴性、无芽胞菌,可初步定为乳酸菌。本试验从3种混合水牛乳样品中共分离出105株乳酸菌,主要分球菌和杆菌两种,在显微镜下呈球状和杆状,具体细胞形态见图1(油镜× 100)。由图1可知,球菌多为圆形,单个、成对或短链状排列,无鞭毛,不运动;杆菌为长杆、短杆状或成丝状,单个、短链或长链排列,不运动。

图1 部分乳酸菌细胞形态Fig.1 Cell morphology of part lactic acid bacteria
2.2 菌株的生理生化特性分析
将分离培养得到的105株乳酸菌,经革兰氏染色镜检后,按杆菌和球菌分类标记,以API50 CH/API20 E鉴定系统进行生化鉴定。具体操作按说明书进行[13],将培养24 h和48 h后的生化反应试剂条分别取出读数,参照鉴定表,将结果输入生化项分析鉴定系统查询,即可得到菌株的种属信息,对于符合率>80%的,可认定为菌株的具体种属[14],其API生化鉴定结果见表1。
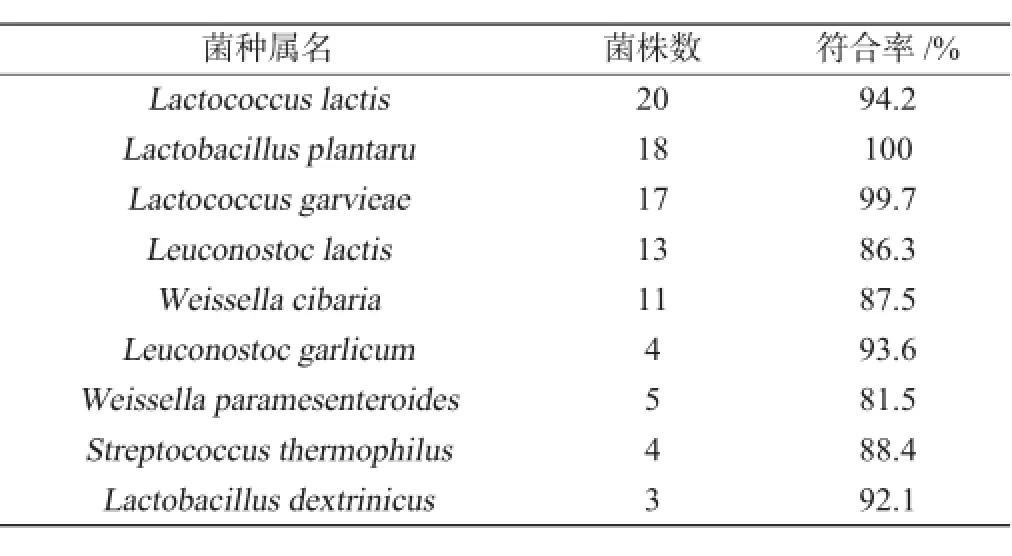
表1 菌株的API生化鉴定结果Table 1 API biochemical identification results of strains
由表1可知,在分离的105株菌中,有95株菌的API鉴定符合率都在80%以上,占总菌株数的90%,还有10株菌缺码,占总菌株数的10%,对于这10株无法由API50 CH/API20 E鉴定得到种属信息的菌株,可以通过后续基因测序来对其进行补充和完成。
2.3 菌株16S rDNA鉴定结果
将上述实验中分离得到可培养的105株乳酸菌,利用Ezup柱式细菌基因组DNA抽提试剂盒,提取其乳酸菌基因组,对基因组进行16S rDNA区PCR扩增[11],对扩增结果进行琼脂糖凝胶电泳检测,选择扩增效果好的部分菌株电泳结果见图2。

图2 部分菌株16S rDNA基因的PCR扩增结果Fig.2 PCR amplification results of part strains 16S rDNA gene
将乳酸菌基因PCR扩增成功的电泳目的条带片段回收,送生工生物(上海)有限公司进行测序,将测序结果输入GenBank数据库,运用BLAST程序将测序结果与NCBI核酸数据库中的公开序列进行比对(http://blast.ncbi.nlm. nih.gov/Blast),用mega4.0构建菌株系统发育树,结果见图3。
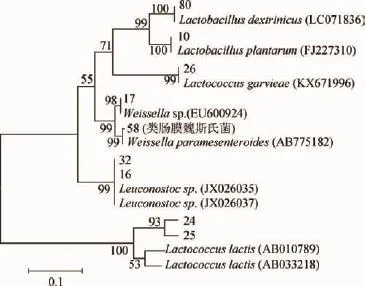
图3 部分菌株的系统发育树Fig.3 Phylogenetic tree of part lactic acid bacteria
由图3可知,16SrDNA鉴定出乳酸乳球菌(Lactococcus lactissubsp.lactis)21株,植物乳杆菌(Lactobacillus plantaru)19株,格氏乳球菌(Lactococcus garvieae)17株,乳明串珠菌(Leuconostoc lactis)13株,食窦魏斯氏菌(Weissella cibaria)11株,肠膜明串珠菌(Leuconostoc mesenteroides)8株,类肠膜魏斯氏菌(Weissella paramesenteroides)6株,嗜热链球菌(Streptococcus thermophilus)5株,糊精乳杆菌(Lactobacillus dextrinicus)5株。
本试验对最初采用API生化鉴定中出现的疑似错误进行分析,因API系统中试剂条对温度、氧、碳源、酶都有一定要求,而可培养菌株的适宜温度、碳源等条件不一定一致,有局限性,鉴定结果平均符合率仅为91%,为保证菌株鉴定的准确性,故试验补充了16S rDNA鉴定,从两种鉴定结果来看,16S rDNA鉴定显然更准确,API是用生化反应间接鉴定出菌种的类别,而16S rDNA鉴定是由分子水平直接准确鉴定出菌株的属种。即一个属于分类鉴定,另一个属于精准鉴定,故在今后的试验中应依据实验所需而慎重选择用哪种鉴定方法更合理。
3 结论
本试验通过平板稀释法从三品杂交生水牛奶混合样品中分离筛选出乳酸菌105株,利用革兰氏染色镜检、API细菌鉴定系统、16S rDNA基因序列分析三种方法相结合,最终鉴定出水牛乳中共有乳酸乳球菌(Lactococcus lactis subsp.lactis)21株、植物乳杆菌(Lactobacillus plantaru)19株、格氏乳球菌(Lactococcus garvieae)17株、乳明串珠菌(Leuconostoc lactis)13株、食窦魏斯氏菌(Weissella cibaria)11株、肠膜明串珠菌(Leuconostoc mesenteroides)8株、类肠膜魏斯氏菌(Weissella paramesenteroides)6株、嗜热链球菌(Streptococcus thermophilus)5株、糊精乳杆菌(Lactobacillus dextrinicus)5株,分别涉及到乳酸菌的乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、链球菌属(Streptococeus)、魏斯氏菌属(Weissella)共5个属8个种,呈现出较为丰富的多样性,具体菌株数量占分离总菌株数的百分比分别为乳球菌36%,乳杆菌23%,明串乳菌20%,魏斯氏菌16%,链球菌5%。由此可见,乳球菌为水牛乳中可培养乳酸菌的优势菌群,乳杆菌、明串珠菌的数量差别不大,可认为是水牛乳中的次要优势菌群,再其次是魏斯氏菌和链球菌。这些乳酸菌大部分具有良好的益生性和发酵性,是水牛乳中宝贵的菌种资源。目前我国大部分的商品酸奶乳酸菌多样性非常有限,主要是保加利亚乳杆菌和嗜热链球菌两种,若将上述水牛乳中分离培养的这些安全而优良的乳酸菌资源应用于酸奶的发酵中,势必为商品酸奶在菌种多样性方面提供更多更优质的选择[15],更为后续我国南方地区特有的水牛乳功能性发酵产品的深度开发提供更多更可靠的乳酸菌菌种资源。
[1]柯耀波.广西水牛奶产业发展对策[J].广西大学学报:哲学社会科学版,2010,32(1):239.
[2]曾庆坤,杨炳壮,梁坤,等.不同品代水牛奶理化性质的研究[J].中国乳品工业,2007,35(5):13-15.
[3]牟诗鹏.浅述广西水牛奶发展现状及发展趋势[D].南宁:广西职业技术学院,2012.
[4]赵蕊,霍贵成.新疆酸奶子中乳酸菌多样性分析[J].山东大学学报:理学版,2008,43(7):18-19.
[5]董晓婉,李宝坤,李开雄,等.新疆蒙古族和哈萨克族传统乳制品中乳酸菌多样性的比较[J].食品工业科技,2013,21(34):162-166.
[6]姚纲,张健鹏,胡红焱,等.用API 50 CH系统鉴定9株产高光学纯度D-乳酸野生菌株[J].中国实用医药,2014,8(3):264-265.
[7]黄右军,尚江华,梁梦玫,等.河流型水牛与沼泽型水牛杂交后代(2n=49)染色体遗传与繁殖力的研究[J].遗传,2003,25(2):155-159.
[8]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:3-5,54-57,100-102,125.
[9]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:260-282,370-378.
[10]R E布坎南.伯杰细菌鉴定手册[M].北京:科学出版社,1984.
[11]谢芳,曾庆坤,杨承剑,等.水牛乳中高产γ-氨基丁酸乳酸菌的筛选与鉴定[J].中国酿造,2015,34(4):103-104.
[12]何蕾.我国传统奶制品中乳酸菌多样性研究[D].成都:四川农业大学,2010.
[13]BOYD M A,ANTONIO M A,HILLIER S L.Comparison of API50 CH strips to whole-chromosomal DNA probes for identification ofLactobacillusspecies[J].J Clin Microbiol,2005,43(10):5309.
[14]汪瑞忠,吴燕芬,刘艳,等.自制GNW21F反应板和API20E在革兰阴性杆菌鉴定中的结果比较[J].上海医学检验杂志,2002,17(2):111-112.
[15]武俊瑞.东北传统发酵特色食品中主要微生物多样性研究[D].沈阳:沈阳农业大学,2013.
Diversity analysis of culturable lactic acid bacteria in water buffalo milk
XIE Fang,YANG Chengjian*,YANG Xiaomei,TANG Yan,ZEN Qingkun
(Guangxi Buffalo Research Institute,Chinese Academy of Agricultural Sciences,Nanning 530001,China)
105 strains were isolated from the milk samples of hybrid buffalo by traditional method in this study.The strains were identified by morphological,physiological and biochemical identification,API system and 16S rDNA gene sequence analysis.Results showed that 105 strains were classified into 5 genera and 8 species,21 strains wereLactococcus lactis,19 strains wereLactobacillus plantaru,17 strains wereLactococcus garvieae,13 strains wereLeuconostoc lactis,11 strains wereWeissella cibaria,8 strains wereLeuconostoc mesenteroides,6 strains wereWeissellaparamesenteroides,5 strains wereStreptococcus thermophilus,and 5 strains wereLactobacillus dextrinicus,which presenting a rich diversity of lactic acid bacteria.Therefore,the culturable dominate lactic bacteria in the buffalo milk in order were as follows:Lactococcus lactis,Lactobacillusplantaru,Lactococcus garvieae,Leuconostoc lactisandWeissella cibaria.The results were beneficial to the development and research of lactic acid bacteria in water buffalo milk.
buffalo milk;culturable strain;lactic acid bacteria;diversity;16S rDNA
Q939
0254-5071(2017)02-0119-04
10.11882/j.issn.0254-5071.2017.02.026
2016-08-17
广西水牛研究所基本科研业务费项目(水牛基160209)
谢芳(1980-),女,研究实习员,本科,研究方向为乳品加工。
*通讯作者:杨承剑(1981-),男,副研究员,博士,研究方向为动物营养及乳品科学。

